- Хлороводород, соляная кислота (HCl)
- Хлорноватистая кислота (HClO) и ее соли
- Хлористая кислота (HClO2) и ее соли
- Хлорноватая кислота (HClO3) и ее соли
- Хлорная кислота (HClO4) и ее соли
- Оксид хлора (I), оксид дихлора ( Cl2O)
- Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
- Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
- Оксид хлора (VII) (Cl2О7)
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Хлор (Cl)
- Химические свойства хлора
- Получение и применение хлора
- 🔥 Видео
Видео:Получение ХЛОРА. Реакция СОЛЯНОЙ КИСЛОТЫ и ПЕРМАНГАНАТА КАЛИЯ. Химические опыты. Chemical experimentСкачать

Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
- при очень сильном нагревании
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
- взаимодействует с основными и амфотерными оксидами:
- реагирует с основаниями и амфотерными гидроксидами:
- Вступает в реакцию с аммиаком:
- взаимодействует с солями более слабых кислот:
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl — окисляется до свободного хлора:
2Cl — — 2e — = Cl2 0
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
- Реакция гипохлоритов с диоксидом углерода и водой :
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO –слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложениегипохлоритов при нагревании:
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
- Взаимодействуют с другимисолями, если продуктом является слабый электролит:
Видео:Хлор. 9 класс.Скачать

Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
- Вступает в реакциис щелочами с образованием хлоритов:
- При длительном хранении разлагается:
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
- реагируют с сильными кислотами:
- являются слабыми восстановителями и сильными окислителями в кислой среде:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
- Окисляет некоторые вещества:
- Разлагается при слабом нагревании:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
- Хлораты сильные окислители.
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
Видео:Получение ХЛОРНОЙ КИСЛОТЫ и не только!Скачать

Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
- Как сильный окислитель окисляет многие вещества:
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильнымиокислителями
- Взаимодействуют с сильными кислотами:
- При нагревании более 550ºС разлагаются:
Оксиды хлора
Видео:Реакция Хлората Натрия и Соляной Кислоты. Реакция NaClO3 и HCl. Выделение Хлора.Скачать

Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
- Является сильным окислителем:
- При температуре выше 20ºС или на свету разлагается:
Видео:Получение ХЛОРА CI2. Реакция ДИОКСИДА СВИНЦА и СОЛЯНОЙ КИСЛОТЫ. Опыты по химии. Опасные опыты домаСкачать

Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
- Разлагается в концентрированной хлороводородной кислоте:
- Проявляет окислительно-восстановительные свойства:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
Видео:Классификация неорганических реакций, РИО, ОВР | Разбор заданий 11,13-15, 20 | Химия ОГЭ 2024Скачать

Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
- При нагревании разлагается:
Видео:Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Please wait.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

We are checking your browser. gomolog.ru
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Хлороводородная кислота. 9 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e26346379d7976a • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:ХЛОРОВОДОРОД | Соляная кислота | Химия 9 классСкачать

Хлор (Cl)
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название «хлорин», которое вскоре было сокращено до «хлор» с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название «галоген», но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре — на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору «по барабану» с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений — хлорофилла.
Природный хлор состоит из смеси двух изотопов:
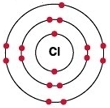
Рис. Строение атома хлора.
Электронная конфигурация атома хлора — 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора — этот раствор называется хлорная вода.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой — кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор «охотно» вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Видео:Получение жидкого хлора и некоторые его реакции / Isolation of liquid chlorine and its reactions.Скачать

Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде — водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде — натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
🔥 Видео
Опыты по химии. Получение хлороводорода и растворение его в водеСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Хлороводородный фонтан, получение соляной кислоты. (химия)Скачать

Получение хлора в лабораторииСкачать
