Аллиловый спирт, имея в молекуле кратную связь и гидроксильную группу, проявляет свойства спиртов и непредельных соединений:
1. Взаимодействие с галогенами с образованием β — дигалоидгидринов глицерина
Совершенно иначе, чем этиловый спирт, относится аллиловый спирт к хлору и брому; тогда как обыкновенный спирт дает с ними продукты замещения и окисления (напр. хлораль), аллиловый спирт прямо присоединяет два атома хлора, брома или йода, образуя β-дигалоидгидрины глицерина C3H6Cl2O, C3H6Br2O и C3H6J2O:
2. Реакция гидрирования:
3. Реакция гидратации в присутствии кислорода с образованием глицерина:
4. Окисление с образованием альдегида
Окислителями переводится в альдегид — акролеин, дальнейшее окисление дает акриловую кислоту:
5. Взаимодействие со щелочными металлами с образованием алкоголятов
Со щелочными металлами получаются алкоголяты, которые при действии хлористого аллила дают соответствующий этиловому эфиру аллиловый эфир (С3Н5)2О:
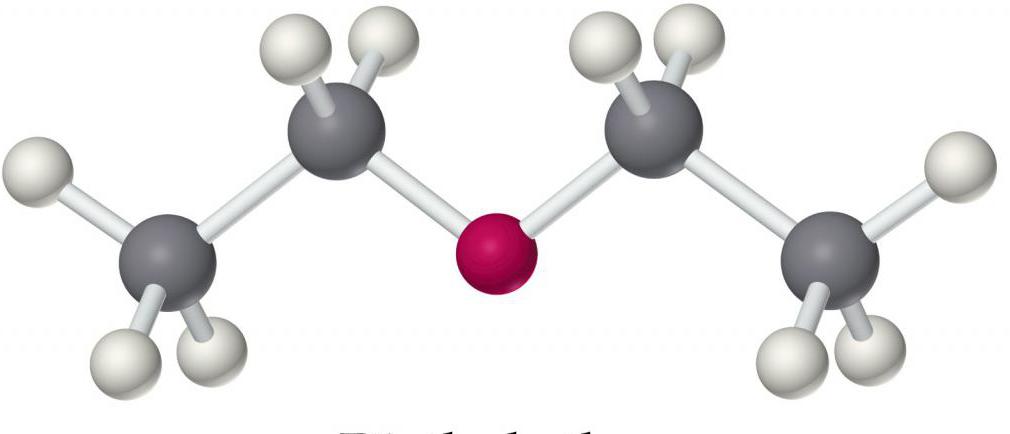
6. Межмолекулярная дегидратация спиртов с образование простых эфиров:
7. Взаимодействие с минеральными и органическими кислотами с образованием сложных эфиров
Образование сложных эфиров происходит при взаимодействии с минеральными и органическими кислотами:
8. Взаимодействие с магнийгалогеналкилами
Происходит замещение гидроксильного водорода на магнийгалоген и выделение углеводорода:
9. Взаимодействие с хлористым фосфором — PCl3
Треххлористый фосфор дает хлористый аллил C3H5Cl, изомерный с α- и β – хлорпропиленами:
Аналогичным путем образуется йодистый аллил C3H5J:
10. Гидратация под действием слабых минеральных кислот
При действии слабых минеральных кислот аллильный спирт способен присоединять элементы воды, причем превращается в пропиленгликоль который, вновь теряя воду, переходит уже в изомерный с аллиловым спиртом пропионовый альдегид или его продукты конденсации:
Полимеризация аллилового спирта идет по следующей схеме:
Операторная модель химико-технологической системы
Операторная схема жидкофазного гидролиза хлористого аллила в аллиловый спирт представлена на рисунке 1.
Хлорпроизводное и водный раствор гидролизирующего агента подают на всасывающую линию компрессора 2, который эмульгирует смесь и сжимает её до давления 15 атм. Причем переключающее устройство гидравлического клапана пускает в действие поршневую ступень компрессора. При этом, в системе давление повышается до желаемого уровня.
В подогревателе 3 реакционная масса нагревается до температуры 1400С, и в изолированном от теплопотерь реакторе 4 процесс ведут до высокой степени конверсии хлорпроизводного (95% и более). После этого жидкость дросселируют в клапане редуктора 5 почти до атмосферного давления, причем часть ее в испарителе — сепараторе 6 испаряется и пары отделяются от жидкости. Органические продукты отгоняют с острым водяным паром; из нижней части испарителя 6 отводят раствор хлористого натрия и избыток щелочи.
В ректификационной колонне 7 аллиловый спирт отделяют, азеотропной перегонкой от диаллилового эфира. Из верхней части колонны при 77,8°С отбирают тройную азеотропную смесь аллилового спирта, диаллилового эфира и воды. Смесь поступает в сепаратор 8, где разделяется на два слоя: нижний (89,5% воды, 10% аллилового спирта и 0,5% диаллилового эфира), и верхний (90% диаллилового эфира; 8,6% аллилового спирта и 1,4% воды). Из сепаратора 8 верхний слой перетекает в аппарат 9, куда также подают воду для извлечения аллилового спирта в сепараторе 10. Из нижней части колонны 7 жидкость направляют в ректификационную колонну 11 для выделения аллилового спирта.
В процессе синтеза, с ректификационных колонн 7, 11, 13 аллиловый спирт поступает в сборник 14.
Щелочь из испарителя — сепаратора 6 вновь возвращается на стадию синтеза.
Побочные продукты от ректификационных колонн 11 и 13: вода и диаллиловый эфир, поступают на стадию утилизации сырья.
Разработка и оптимизация методов получения аллилового спирта является актуальной в химической технологии.
Пропеновый спирт, полупродукт производства глицерина, синтетических смол и пластических материалов, и используется в производстве фармацевтических препаратов и в химическом синтезе вообще, но самое большое применение аллиловый спирт нашел в производстве различных сложных эфиров аллила, из которых наиболее важными являются диаллил — фталат и диаллил — изофталат , которые служат в качестве мономеров и реполимеров .
Рис.1. Операторная схема получения аллилового спирта из хлористого аллила:
1 — смеситель; 2 — компрессор; 3 — подогреватель; 4 – реактор; 5 – редуктор; 6 – испаритель — сепаратор; 7, 11, 13 — ректификационная колонна; 8, 10 – сепаратор; 9, 12 – смеситель; 14- сборник
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Аллиловый спирт: получение, формула, химические свойства
Аллиловый спирт также называется пропен-2-ол-1. Относится к простым одноатомным спиртам, является прозрачной жидкостью с достаточно высокой температурой кипения. Возможно его смешивание с водой и органическими растворителями. Используется для получения глицерина, аллиловых эфиров и так далее.
Видео:Взаимодействие фенола с бромной водойСкачать

Краткая характеристика спиртов
Спирты — вещества, имеющие в своем составе углеводороды, а также гидроксогруппу (-ОН), определяющую их класс, одну или несколько. Гидроксильная группа одна из наиболее распространенных.
Спирты подразделяются на одноатомные (одна -ОН группа), многоатомные (2-3 -ОН группы). Также их можно разделить на спирты первичные (гидроксильная группа присоединяется к атому углерода, связанному только с одним углеводородом), вторичные (гидроксильная группа, присоединенная к углероду, соединенному с двумя углеводородами), третичные (с углеродом, соединенным с тремя углеводородами соответственно).
Спирты используются в производстве других химических веществ. Применяются в парфюмерии и медицине, в промышленности, как растворители и смазки.
Спирты, имеющие не более одиннадцати углеводородов, представляют собой жидкость, а с большим количеством — уже твердые вещества. Спирты имеют плотность меньше единицы, следовательно, они легче воды. Также они обладают высокой температурой кипения и плавления за счет водородных связей.
Нами будет рассмотрен один из представителей данного класса — аллиловый спирт, имеющей очень важное значение в промышленности и производстве.
Видео:Взаимодействие этилена с бромной водойСкачать

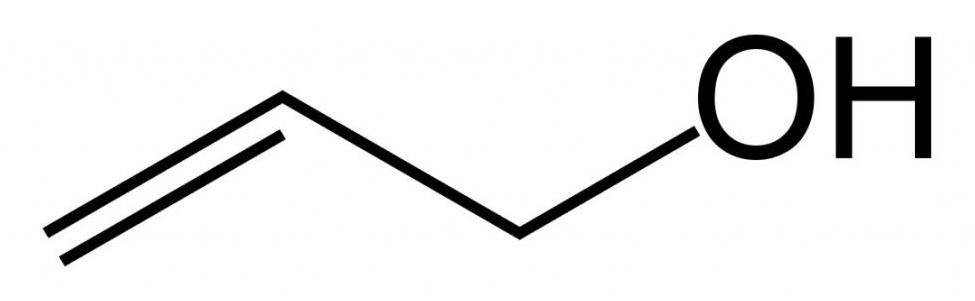
Структурная формула
Как уже было сказано выше, пропен-2-ол-1 относится к простым одноатомным спиртам. Структурная формула аллилового спирта представлена ниже.
Также стоит отметить, что за свет двойной связи относится к классу ненасыщенных (непредельных спиртов). Это бесцветная жидкость, которая имеет характерный спиртовой запах, температуру кипения 96,9 °С, ПДК=2мг/м 3 .
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Получение
В получении аллилового спирта одним из наиболее применяемых способов является гидролиз аллилхлорида.
Реакция записывается следующим образом:
В лаборатории омыление аллилхлорида производят с добавлением водного раствора гидроксида кальция. Реакция должна протекать в автоклаве с мешалкой при температуре не меньше 150 °С. В промышленности же используют 10 % едкий натр при определенном давлении и такой же температуре. Только в таких условиях можно создать достаточно большой выход, составляющий 90-95 %.
Получение аллилового спирта возможно стандартными реакциями дегидрирования пропанола, изомеризации оксида пропилена и взаимодействия глицерина и муравьиной кислоты.
Синтез данного спирта производят пропусканием паров окиси пропилена над катализатором, которым является фосфат лития.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Свойства
Особенности химических свойств аллилового спирта обусловлены реакциями, характерными для аллильных соединений и спиртов. Этот спирт может вступать в реакции галогенирования и гидрогалогенирования по правилу Марковникова.
Для аллильного спирта характерны стандартные для алкенов реакции. Гидрирование происходит с разрывом двойной связи и насыщением углеводородов. Гидратация протекает в присутствии кислорода, и в результате образуется глицерин.
Так же интересной реакцией является межмолекулярная дегидратация, процессе которой которой образуются простые эфиры, представленные на рисунке.
Аллильные спирты, как правило, окисляются до альдегидов свежеосажденным гидроксидом марганца.
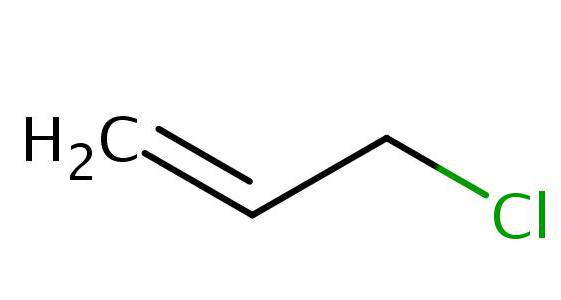
А при взаимодействии с серной кислотой (концентрированной), нагретой до температуры 100 °С, или в присутствии хлорида цинка при температуре 20 °С, в присутствии хлорида меди образуется аллилхлорид.
Аллилхлорид — это хлорорганическое соединение с систематическим названием 3-хлорпропен. Оно активно применяется в промышленности и имеет огромное значение в синтезе аллильных соединений.
Для аллилового спирта характерна полимеризация при воздействии на него кислорода или других окислителей. В результате полимеризации образуется такое вещество, как полиаллиловый спирт.
Химические реакции с аллиловым спиртом используют для получения таких веществ, как глицерин, глицидол. Аклоерин получают простым окислением, а взаимодействием с минеральными и органическими кислотами получают сложные аллиловые эфиры.
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Выводы
Итак, мы разобрались, что аллиловый спирт — первичный непредельный спирт, которому свойственны признаки как спиртов, так и аллильных соединений. Он достаточно активен, растворим в органике и смешивается с водой в определенных пропорциях. Он применяется в промышленности и лаборатории, имеет характерный спиртовой запах.
Аллиловый спирт очень токсичен и ядовит. Он может оставлять ожоги на коже и обжигать верхние дыхательные пути, поражать нервную систему и печень. Будьте осторожны, используя его в лаборатории, соблюдайте технику безопасности и не пренебрегайте средствами собственной защиты.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💥 ВидеоРЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  7.3. Спирты: Способы получения. ЕГЭ по химииСкачать  Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  Взаимодействие этилена с бромной водойСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Реакция этилена с раствором перманганата калияСкачать  Химия. Растворимость спиртов в воде, горение спиртов, качественные реакцииСкачать  Взаимодействие ацетилена с бромной водойСкачать  8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать  Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать  1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать  Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  |