Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
- Кратко об идеальном газе
- Что это адиабатический процесс?
- Уравнения Пуассона для адиабатического процесса
- Пример задачи
- 2.4. Адиабатный процесс
- Адиабатический процесс | Все его важные концепции и графические кривые
- Тема обсуждения: адиабатический процесс.
- Определение адиабатического процесса
- Адиабатический процесс Пример
- Формула адиабатического процесса
- Идеальный газ
- Вывод адиабатического процесса
- Адиабатический процесс Работа выполнена.
- Адиабатический график
- Адиабатическая энтропия, адиабатическое сжатие и расширение
- Обратимый адиабатический процесс
- Необратимый адиабатический процесс
- 🎦 Видео
Видео:29. Адиабатический процесс. Уравнение ПуассонаСкачать

Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Видео:Адиабатный процесс. 10 класс.Скачать

Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
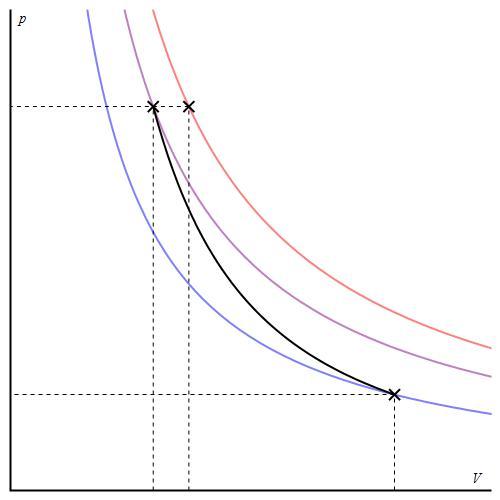
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Видео:Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

2.4. Адиабатный процесс
Адиабатный процесс — это процесс, при котором не происходит теплообмена с внешней средой.
Физически это означает, что процесс протекает достаточно быстро и система не успевает обменяться теплотой с внешними телами. Однако коль скоро мы имеем дело с равновесными процессами, скорость адиабатного процесса не должна быть слишком уж велика. Примером таких процессов может служить распространение звуковых колебаний в упругой среде.
Выведем уравнение, описывающее адиабатный процесс. Ранее мы имели дело с самыми простыми уравнениями процессов
— для изотермического процесса;
— для изобарного процесса;
— для изохорного процесса.
Поскольку в адиабатном процессе dQ = 0, из первого начала термодинамики следует, что
C другой стороны,
Приравнивая эти выражения, находим
Умножая уравнение (2.28) на V g –1 , получаем в левой части полный дифференциал
В результате интегрирования (2.29) приходим к уравнению адиабатного процесса
Графически адиабатный процесс описывается на (р,V) — диаграмме кривыми, похожими на изотермы (рис. 2.12), но идущими круче, так как g > 1, поскольку Сp > СV.
Рис. 2.12. Адиабатный процесс в идеальном газе: 1 — адиабата, 2 — изотерма
Это и понятно, так как при адиабатном расширении газ совершает работу за счет внутренней энергии, и его температура падает, что еще больше уменьшает давление по сравнению с изотермическим расширением.
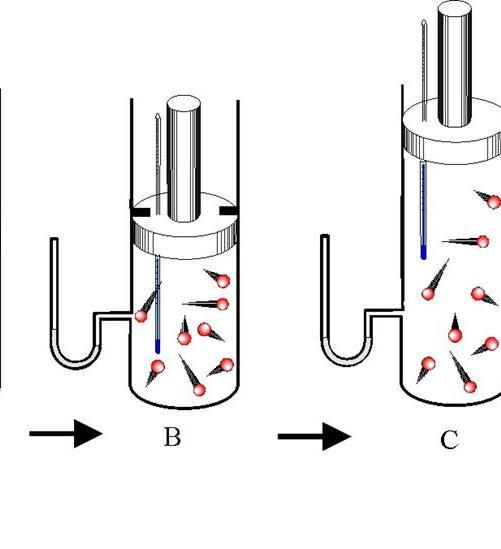
Экспериментальное исследование адиабатного процесса в идеальном газе можно выполнить с помощью установки, представленной на рис. 2.13.
Рис. 2.13. Экспериментальное изучение адиабатного процесса в идеальном газе
Учитывая, что из уравнения состояния идеального газа следует пропорциональность
уравнение адиабатного процесса можно также представить в виде
Первый закон термодинамики в применении к адиабатному процессу позволяет вычислить работу газа при адиабатном расширении:
Выражения для работы при адиабатном процессе с учетом уравнения Клапейрона — Менделеева можно выразить также через температуры в начале и конце процесса
Для бесконечно малых изменений параметров уравнения (2.32), (2.33) переходят в соотношения
Пример. Горючая смесь в двигателе Дизеля (см. рисунок выше) воспламеняется при температуре Т2 = 1 100 К. Начальная температура смеси Т1 = 350 К. Определим, во сколько раз нужно уменьшить объем смеси при сжатии, чтобы она воспламенилась. Сжатие будем считать адиабатным. Показатель адиабаты для смеси g = 1,4.
Для решения удобнее воспользоваться уравнением адиабатного процесса в форме (2.31):
Отсюда сразу следует выражение для степени сжатия горючей смеси:
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Адиабатический процесс | Все его важные концепции и графические кривые
Видео:Физика. Термодинамика: Адиабатный процесс. Центр онлайн-обучения «Фоксфорд»Скачать

Тема обсуждения: адиабатический процесс.
- Определение адиабатического процесса
- Примеры адиабатических процессов
- Формула адиабатического процесса
- Вывод адиабатического процесса
- Выполненная работа адиабатического процесса
- Обратимый адиабатический процесс и Необратимыйадиабатический процесс
- Адиабатический график
Видео:Эта тема ВСЕГДА встречается на экзамене ЦТ — Изопроцессы (Физика для чайников)Скачать

Определение адиабатического процесса
Соблюдая первый закон термодинамики, процесс, происходящий при расширении или сжатии, когда нет теплообмена от системы к окружающей среде, может быть известен как адиабатический процесс. В отличие от изотермического процесса, адиабатический процесс передает энергию окружающей среде в виде работы. Это может быть как обратимый, так и необратимый процесс.
В действительности, идеально адиабатический процесс никогда не может быть получен, поскольку ни один физический процесс не может происходить самопроизвольно, а система не может быть идеально изолирована.
Следуя первому закону термодинамики, который гласит, что когда энергия (как работа, тепло или материя) переходит в систему или из нее, внутренняя энергия системы изменяется в соответствии с законом сохранения энергии, где E можно обозначить как внутренняя энергия, а Q — это тепло, добавленное к системе, а W — проделанная работа.
ΔE=Q—W
Для адиабатического процесса, в котором нет теплообмена,
ΔE= —W
Условия, необходимые для протекания адиабатического процесса:
- Система должна быть полностью изолирована от окружающей среды.
- Чтобы передача тепла происходила за достаточное время, процесс должен выполняться быстро.
Видео:Лекция №7. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВСкачать

Адиабатический процесс Пример
- Процесс расширения в двигателе внутреннего сгорания среди горячих газов.
- Квантово-механический аналог осциллятора, классически известного как квантовый гармонический осциллятор.
- Сжиженные газы в системе охлаждения.
- Воздух, выпущенный из пневматической шины, является наиболее важным и частым случаем адиабатического процесса.
- Лед, хранящийся в морозильной камере, следует принципам, согласно которым тепло не передается в окружающую среду и обратно.
- Турбины, использующие тепло в качестве среды для создания работы, считаются отличным примером, поскольку они снижают эффективность системы, поскольку тепло теряется в окружающую среду.
Видео:Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Формула адиабатического процесса
Выражение адиабатического процесса в математических терминах может быть дано следующим образом:
ΔQ = 0
ΔU = -W, (так как в системе отсутствует тепловой поток)
Рассмотрим систему, в которой выполняется исключение теплового и рабочего взаимодействий в стационарном адиабатическом процессе. Единственные энергетические взаимодействия — это граничная работа системы в ее окружении.
Идеальный газ
Количество тепловой энергии на единицу температуры, недоступной для выполнения определенной работы, можно определить как энтропию системы. Спекулятивный газ, который представляет собой беспорядочное движение точечных частиц, подверженных межчастичным молекулярным взаимодействиям, идеален.
Молярная форма формулы идеального газа определяется следующим образом:
Уравнение адиабатического процесса можно обозначить как:
PVY = постоянный
Для обратимого адиабатического процесса
- P 1-Y T Y = постоянная,
- VT F / 2 = постоянная,
- TV Y-1 = константа. (T = абсолютная температура)
Этот процесс также известен как изэнтропический процесс, идеализированный термодинамический процесс, включающий передачу работы без трения и адиабатический. В этом обратимом процессе нет передачи тепла или работы.
Видео:мкт ИЗОТЕРМИЧЕСКИЙ процесс ИЗОХОРНЫЙ процесс ИЗОБАРНЫЙ процессСкачать

Вывод адиабатического процесса
Изменение внутренней энергии dU в системе сделать работу dВт плюс добавленное тепло dQ с ним можно связать первый закон термодинамики, с помощью которого можно вывести адиабатический процесс.
Добавление тепла увеличивает количество энергии U определение удельной теплоемкости как количества тепла, добавляемого на единицу повышения температуры на 1 моль вещества.
(n — количество молей), Следовательно:
Получено из закон идеального газа,
Уравнение слияния 1 и 2,
Для постоянного давления Cp, добавляется тепло и,
γ — это удельная теплоемкость
Используя концепции интеграции и дифференциации, мы пришли к следующему:
Это уравнение, приведенное выше, становится реальным для данного идеального газа, который содержит адиабатический процесс.
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Адиабатический процесс Работа выполнена.
Для давления P и площадь поперечного сечения A перемещение на небольшое расстояние dx, действующая сила будет определяться следующим образом:
А проделанную работу в системе можно записать так:
Чистая работа, произведенная для расширения газа из объема газа Vi к Vf (от начального до финального) будут представлены как
W = площадь ABDC от графика, построенного как имеет место адиабатический процесс. Условия, которые необходимо соблюдать, связаны с примером совершенно непроводящего поршневого цилиндра с одной граммовой молекулой идеального газа. Емкость баллона должна быть изготовлена из изоляционного материала, а кривая на графике должна быть более резкой.
Принимая во внимание, что в аналитическом методе для вывода работы, выполненной в системе, будет следующее:
Изначально для адиабатического изменения можно предположить:
Который может быть,
Из (1),
Принимая T1 и т2 как начальная и конечная температуры газа соответственно,
Используя это в уравнении (2),
Тепло, необходимое в процессе расширения для выполнения работы:
Поскольку R — универсальная газовая постоянная, и во время адиабатического расширения совершаемая работа прямо пропорциональна снижению температуры, в то время как работа, совершаемая во время адиабатического сжатия, отрицательна.
Это можно представить как работа, выполненная в адиабатическом процессе.
И тепло, выделяемое во время процесса:
Видео:Физика 10 класс. Адиабатный процесс.Скачать

Адиабатический график
Математическое представление кривой адиабатического расширения представлено следующим образом:
P, V, T — давление, объем и температура процесса. Рассматривая начальные условия системы как P1, V1, и т1, также определяя финальную стадию как P2, V2, и т2 соответственно, графическая диаграмма PV построена по существу для движения поршневого цилиндра, адиабатически нагретого от начального до конечного состояния для XNUMX кг воздуха.
Видео:Решение графических задач на тему Газовые законыСкачать

Адиабатическая энтропия, адиабатическое сжатие и расширение
Газ, которому позволено свободно расширяться без передачи ему внешней энергии от более высокого давления к более низкому, будет по существу охлаждаться по закону адиабатического расширения и сжатия. Точно так же газ нагреется, если его сжать с более низкой температуры до более значительной температуры без передачи энергии веществу.
- Посылка воздуха расширится, если давление окружающего воздуха уменьшится.
- На больших высотах наблюдается снижение температуры из-за уменьшения давления, поскольку они прямо пропорциональны в случае этого процесса.
- Энергия может использоваться либо для работы по расширению, либо для поддержания температуры процесса, но не для того и другого одновременно.
Видео:Работа, совершаемая при термодинамических процессах. 10 класс.Скачать

Обратимый адиабатический процесс
Процесс без трения, в котором энтропия системы остается постоянной, получил название обратимого или обратимого. изоэнтропический процесс. Это означает, что изменение энтропии постоянно. Внутренняя энергия эквивалентна работе, совершаемой в процессе расширения.
Поскольку нет теплопередачи,
Которое значит что,
Примеры обратимого изоэнтропического процесса можно найти в газовые турбины.
Видео:Адиабатный процесс. Практическая часть. 10 классСкачать

Необратимый адиабатический процесс
Как следует из названия, процесс рассеяния внутреннего трения, приводящий к изменению энтропии системы во время расширения газов, является необратимым адиабатическим процессом.
Обычно это означает, что энтропия увеличивается по мере развития процесса, который не может быть выполнен в равновесии и не может быть отслежен до исходного состояния.
🎦 Видео
Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать