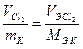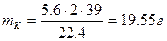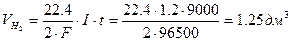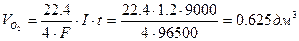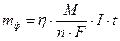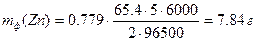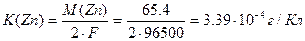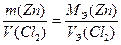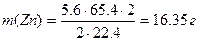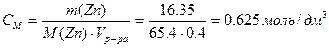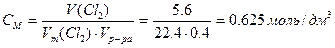Задача 686.
Составить уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl2 с инертными электродами.
Решение:
а) Электролиз расплава едкого натра
В расплаве едкого натра содержатся ионы Na+ и OH-:
Ионы натрия восстанавливаются на катоде: NaOH ⇔ Na + + OH — .
На аноде ионы ОН — окисляются с образованием воды и кислорода:
2ОН — — 2 
Два атома кислорода, соединяясь друг с другом, образуют молекулу:
Таким образом, процесс окисления ионов ОН — можно выразить уравнением:
4ОН — — 4 
Умножив уравнение катодного процесса на четыре, и сложив его с анодным процессом, получим:
4Na + + 4OH — ⇔ 4Na + H2O + O2↑
у катода у анода
Процесс в целом можно выразить уравнением:
Таким образом, при электролизе расплава едкого натра у катода выделяется металлический натрий, а у анода – газообразный кислород и вода.
б) Электролиз расплава соли NiCl2 находятся ионы Ni 2+ и Cl — : NiCl2 ⇔ Ni 2+ + 2Cl — .
В расплаве соли NiCl2 находятся ионы Ni 2+ и Cl — :
Образующиеся ионы никеля восстанавливаются на катоде с образованием металлического никеля:
Ni 2+ + 2 
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые соединяясь друг с другом, образуют молекулу хлора:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение процесса:
Ni 2+ + 2Cl — = Ni + Cl2↑
у катода у анода
Таким образом, при электролизе расплава соли хлорида никеля (II) на катоде выделяется металлический никель, а на аноде – газообразный хлор.
Задача 687.
Составить схемы электролиза водных растворов Н2SO4, CuCl2, Pb(NO3)2 с платиновыми электродами.
Решение:
а) Электролиз водного раствора Н2SO4
Стандартный потенциал системы: 2Н + + 2 
2Н2О + 2 
Поскольку, отвечающий этой системе стандартный электродный потенциал (1,23В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему:
2SO4 2- — 2 
Ионы SO4 2- , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение реакции электролиза серной кислоты:
Таким образом, одновременно с выделением водорода у катода и кислорода у анода образуется вода (катодное пространство) и серная кислота (анодное пространство). После приведения членов в обеих частях равенства получим:
2H2O — 4 
у катода у анода
Вывод:
При электролизе раствора серной кислоты происходит разложение воды на катоде и аноде, в результате чего происходит выделение водорода (в катодном пространстве) и кислорода (в анодном пространстве), а серная кислота остаётся без изменения.
б) Электролиз водного раствора CuCl2
Медь располагается в ряду активности после водорода, поэтому на катоде восстанавливается металл:
Катод (–): Cu 2+ + 2ē = Cu 0
На аноде будет происходить электрохимическое окисление ионов Cl-, приводящее к выделению хлора:
Анод (+): 2Cl – — 2ē = 2Cl – → Cl2↑.
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно выше, чем стандартный потенциал (+1,23 В), характеризующий систему
Вывод:
Таким образом, при электролизе водного раствора хлорида меди на катоде выделяется медь, на аноде – хлор.
в) Электролиз водного раствора Рb(NO3)2
Рb(NO3)2 – соль средней активности металла и кислородсодержащей кислоты. Стандартный электродный потенциал электрохимической системы:
Pb 2+ + 2 

Pb 2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
Ионы NO3 — , движущиеся при гидролизе к аноду, будут накапливаться в анодном пространстве. Умножим уравнение катодного процесса на два и сложим его с уравнением анодного процесса, получим суммарное уравнение:
2Pb 2+ + 2H2O = 2Pb + O2↑ + 4H +
у катода у анода
Приняв во внимание, что одновременно происходит накопление ионов NO3 — в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Вывод:
При электролизе водного раствора нитрата свинца на катоде выделяется свинец, на аноде – газообразный кислородрд, в растворе образуется азотная кислота (анодное пространство).
Видео:Электролиз. 10 класс.Скачать

Запишите уравненеие реакции электролиза (инертный электрод ) нитрата никеля, гидроксида никеля, азотной кислоты
Запишите уравненеие реакции электролиза (инертный электрод ) нитрата никеля, гидроксида никеля, азотной кислоты
Электролиз нитрата никеля в водном растворе:
2NI(NO3)2 + 2H2O = 2Ni + O2 + 4HNO3
На катоде (+): Ni(2+) + 2e = Ni—————x2
на аноде (-): 2H2O — 4e = O2 + 4H(+)——x1
———————————
NI(OH)2 + H2O = H2 + O2 + Ni(OH)2
здесь гидроксид никеля не будет участвовать в электролизе, поскольку он не растворим в воде. Вместо него электролизу подвергается вода
—————————
С азотной кислотой та же ситуация, электролизу подвергается вода
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз расплавов и водных растворов электролитов
3.1 Задачи на тему «Электролиз расплавов и водных растворов электролитов»
Задача 3.1: Составьте схемы электролиза (уравнения электродных процессов, молекулярное уравнение электролиза) водных растворов солей. Рассчитайте ЭДС поляризации при электролизе растворов этих солей с платиновым (инертным) анодом.
a) Ni(NO3)2 b) MgSO4 c) Pb(NO3)2 d) ZnSO4
e) Ca(NO3)2 f) CuSO4 g) Mn(NO3)2 h) Na2CO3
Задача 3.2: Составьте схемы электролиза (уравнения электродных процессов, молекулярное уравнение электролиза) водных растворов солей. Рассчитайте ЭДС поляризации при электролизе растворов этих солей с платиновым (инертным) анодом.
a) NiCl2 b) BaCl2 c) SnCl2 d) ZnCl2
e) FeCl3 f) BiCl3 g) KCl h) AlCl3
Задача 3.3: Составьте схемы электролиза расплавов следующих солей:
a) хлорид кальция CaCl2, йодид натрия NaI
b) хлорид алюминия AlCl3, хлорид калия KCl
c) бромид калия KBr, хлорид магния MgCl2
d) фторид кальция CaF2, бромид натрия NaBr
Задача 3.4: Какой металл будет выделяться на катоде в первую очередь из раствора, содержащего несколько солей: нитрат никеля, нитрат серебра и нитрат меди. Выразите уравнениями электродные процессы.
Задача 3.5: Раствор содержит ионы Fe 2+ , Hg 2+ , Bi 3+ , Pb 2+ с одинаковой молярной концентрацией. В какой последовательности будут разряжаться эти ионы на катоде при электролизе раствора?
Задача 3.6: Составьте схемы электролиза водных растворов указанных солей с инертным и активным анодом (см. табл. 7).
Таблица 7 – Варианты заданий
| Раствор соли | Материал анода | |
| a | Сульфат цинка ZnSO4 | цинк, уголь |
| b | Хлорид олова (II) SnCl2 | олово, уголь |
| c | Нитрат никеля Ni(NO3)2 | никель, уголь |
| d | Хлорид меди (II) CuCl2 | медь, уголь |
| e | Сульфат никеля NiSO4 | никель, уголь |
| f | Хлорид цинка ZnCl2 | цинк, уголь |
| g | Сульфат хрома (III) Cr2(SO4)3 | хром, уголь |
Задача 3.7: Составьте схемы электролиза: a) раствора и расплава хлорида натрия; b) раствора и расплава гидроксида калия.
Задача 3.8: При пропускании электрического тока силой 6 А в течение 1 ч 14 мин 24 с на катоде выделилось 8.14∙10 -3 кг металла. Рассчитайте молярную массу, электрохимический эквивалент металла, проявляющего валентность, равную 2.
Задача 3.9: Раствор хлорида магния подвергали электролизу в течение 1 ч при силе тока 2.5 А. Составьте схему электролиза. Рассчитайте массу веществ, выделившихся на катоде и аноде.
Задача 3.10: Через раствор нитрата никеля в течение 2 ч 27 мин пропускали ток силой 3.5 А., рассчитайте, на сколько уменьшилась масса никелевого анода. Составьте схему электролиза.
Задача 3.11: При электролизе сульфата металла на аноде выделилось 178∙10 -3 дм 3 кислорода (н.у.), а на катоде 1∙10 -3 кг металла. Рассчитайте атомную массу металла, проявляющего валентность 2.
Задача 3.12: Через раствор сульфата цинка пропускали ток силой 0.4 А в течение 30 мин. При этом выделилось 0.25∙10 -3 кг цинка. Рассчитайте коэффициент выхода по току.
Задача 3.13: Рассчитайте эквивалентную массу и электрохимический эквивалент металла, если известна масса металла, выделившегося на катоде из раствора его соли при пропускании электрического тока определенной силы в течение известного времени (см. табл. 8). Принять, что выход по току составляет 100%.
Таблица 8 – Варианты заданий
| Масса металла, кг | Сила тока, А | Время электролиза | |
| a | 1.517∙10 -3 | 5.0 | 10 мин |
| b | 1.070∙10 -3 | 1.5 | 30 мин |
| c | 10.000∙10 -3 | 4.0 | 57 мин 42 с |
| d | 13.070∙10 -3 | 10.0 | 32 мин 10 с |
Задача 3.14: Сколько времени потребуется для разложения на угольных электродах:
a) 20.8∙10 -3 кг водного раствора сульфата кадмия при силе тока 2 А? Выход по току 75 %.
b) 0.5 моль серной кислоты при силе тока 3 А?
c) 6.725∙10 -3 кг водного раствора хлорида меди при силе тока 5 А? Выход по току 95 %.
Задача 3.15: Рассчитайте силу тока, при которой следует проводить электролиз водных растворов солей для получения металлов:
a) 2.79∙10 -3 кг железа из FeSO4 в течение 40 мин при выходе по току 70 %;
b) 6.54∙10 -3 кг цинка из ZnSO4 в течение 1 ч при выходе по току 65 %;
c) 0.26∙10 -3 кг хрома из Cr(NO3)3 в течение 10 мин при выходе по току 68 %.
Задача 3.16: Деталь хромируется в водном растворе Cr2(SO4)3. При какой силе тока следует проводить электролиз, чтобы в течение 1 ч на поверхности детали выделилось 1.3∙10 -3 кг хрома; выход по току 90 %.
Задача 3.17: Рассчитать выход по току, если при электролизе растворов нижеперечисленных солей (см. табл. 9) при силе тока 5 А в течение 32 мин на катоде выделилось указанное количество металла:
Таблица 9 – Варианты заданий
| Раствор соли | Масса выделившегося металла, кг | |
| a | NiSO4 | 2.0∙10 -3 |
| b | CuCl2 | 2.5∙10 -3 |
| c | Zn(NO3)2 | 2.2∙10 -3 |
| d | AgNO3 | 7.5∙10 -3 |
| e | BiCl3 | 5.6∙10 -3 |
| f | MnSO4 | 2.1∙10 -3 |
| g | CdCl2 | 4.8∙10 -3 |
Задача 3.18: Деталь подвергается электрохимическому никелированию в водном растворе сульфата никеля с никелевым анодом при силе тока 3 А. Рассчитайте время, необходимое для нанесения на поверхность детали 1.8∙10 -3 кг никеля. Выход по току составляет 100 %.
Задача 3.19: За какое время была оцинкована стальная деталь, если вес металла покрытия составляет 3.92∙10 -3 кг, процесс ведется при силе тока 3.2 А; выход по току 95 %.
Задача 3.20: Выход по току при получении металлического кальция при электролизе расплава CaCl2 составляет 90 %. Какое количество электричества необхрдимо пропустить через электролизер, чтобы получить 0.2 кг кальция?
Задача 3.21: Ток какой силы надо пропускать через расплав хлорида магния в течение 10 ч, чтобы получить 0.5 кг магния; выход по току 85 %.
Задача 3.22: Рассчитайте массу алюминия, которую можно получить при электролизе расплава оксида алюминия, если в течение 1 ч пропускать ток силой 2∙10 4 А; выход по току составляет 85 %.
Задача 3.23: При электролизе растворов MgSO4 и CuSO4 в электролизерах, соединенных последовательно, на катоде одного из них выделилось 0.2∙10 -3 кг водорода. Выразите уравнениями электродные процессы. Рассчитайте массы веществ, выделившихся на электродах обоих электролизеров.
Задача 3.24: Через раствор сульфата железа (II) пропускали ток силой 13.4 А в течение 1 ч. Рассчитайте массу железа, выделившегося на катоде, если выход по току равен 70 %.
Задача 3.25: Рассчитайте нормальную (эквивалентную) концентрацию раствора AgNO3, если для выделения всего серебра из 0.065 дм 3 этого раствора потребовалось пропускать ток силой 0.6 А в течение 20 мин (электролиз протекает на графитовых электродах).
Задача 3.26: Какой силы ток необходим для выделения на катоде в течение 1 ч всего металла, содержащегося:
a) в 0.5 дм 3 0.1 М раствора ZnCl2
b) в 0.3 дм 3 0.02 н раствора Pb(NO3)2
c) в 1 дм 3 0.015 М раствора BiCl3
d) в 0.25 дм 3 0.15 н раствора CuSO4
Задача 3.27: В течение какого времени неодходимо пропускать ток силой 3 А, чтобы выделить весь металл, содержащийся:
a) в 2 дм 3 0.05 н раствора NiCl2
b) в 0.3 дм 3 0.2 М раствора CuSO4
c) в 0.08 дм 3 2 н раствора CrCl3
d) в 0.1 дм 3 0.01 н раствора Hg(NO3)2
Задача 3.28: При электролитическом осаждении всего хрома из 0.6 дм 3 раствора Cr(NO3)3 на аноде выделилось 5.6 дм 3 газа (н.у.). Рассчитайте молярную концентрацию исходного раствора нитрата хрома (III).
3.2 Примеры решения задачна тему «Электролиз расплавов и водных растворов электролитов»
Пример 1. Составьте уравнения электродных процессов и молекулярное уравнение электролиза расплава хлорида калия. За какое время при силе тока 10 А на одном из электродов выделяется 5.6 дм 3 хлора (н.у.); какое вещество и в каком количестве образуется на другом электроде?
Решение: В расплаве хлорид калия подвергается термической диссоциации на ионы K + и Cl — . При наложении разности потенциалов катионы K + перемещаются к отрицательно заряженному электроду – катоду; анионы Cl — – к положительно заряженному электроду – аноду. При достижении потенциала разложения на катоде протекает процесс восстановления катионов K + , а на аноде – процесс окисления анионов Cl — .
K (-): K + + 1e = K
A (+): 2Cl — — 2e = Cl2
Записываем молекулярное уравнение электролиза
Массы и объемы образующихся на электродах веществ рассчитываем по I закону Фарадея
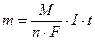
где m – масса вещества, г; М – молярная масса вещества, г/моль; 1/n – фактор эквивалентности; n – число принимаемых или отдаваемых частицей электронов; F – число Фарадея, 96500 Кл (количество электричества, необходимое для выделения 1 эквивалента любого вещества); I – сила тока, А; t – время, с.
I∙t = Q – количество электричества, Кл.
M/(n∙F) = K – электрохимический эквивалент, г/Кл.
Если при электролизе образуется газообразные вещества, то массу m и молекулярную массу М можно заменить объемом V (н.у.) и молекулярным объемом Vm (моль), равным 22.4 дм 3 . Закон Фарадея принимает вид:
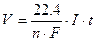
Рассчитываем время электролиза по уравнению:
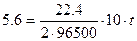
Рассчитываем массу калия, образовавшегося на катоде. Известно, что на электродах при прохождении одинакового количества электричества образуются эквивалентные количества веществ (II закон Фарадея), то есть
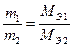
Пример 2. Рассчитайте массы веществ, выделившихся на электродах при электролизе водного раствора сульфата калия в течение 2.5 часа при силе тока 1.2 А.
Решение: В водном растворе сульфат калия подвергается практически полной диссоциации на ионы K + и SO4 2- . При наложении разности потенциалов катионы K + движутся к катоду, а анионы SO4 2- – к аноду. Вода является очень слабым электролитом и остается практически в виде молекул и в катодном и в анодном пространстве
Катод (-) Анод(+)
K + : φ 0 = -2.92 B SO4 2- : φ 0 = 2.05 B
H2O: φ 0 = -0.41 B H2O: φ 0 = 1.23 B
На катоде протекает процесс восстановления тех ионов или молекул, для которых величина электродного потенциала выше, то есть восстановление воды
K(-): 2H2O + 2e = H2 + 2OH —
На аноде протекает процесс окисления тех ионов или молекул, для которых величина электродного потенциала ниже, то есть окисление воды. Отметим, что при наличии бескислородных ионов, например, Cl — , Br — , I — , они окисляются на аноде в первую очередь в связи с перенапряжением выделения кислорода.
A(+): 2H2O – 4e = O2 + 4H +
Электролиз сводится к разложению воды. На катоде выделяется молекулярный водород, в пространстве вокруг катода накапливаются ионы ОН — . Создается щелочная среда (КОН); на аноде выделяется молекулярный кислород, в анодном пространстве накапливаются ионы Н + , создается кислая среда (H2SO4).
На основании электронно-ионных уравнений и электронного баланса составляем молекулярное уравнение электролиза
По I закону Фарадея рассчитываем объемы газов, выделившихся на электродах.
Пример 3. Составить уравнения электродных процессов при электролизе водного раствора сульфата никеля с никелевым анодом.
Решение: Сравнивая значения φ 0 электродных процессов
2H2O + 2e = H2 + 2OH — φ 0 = -0.41 B (pH = 7)
Ni 2+ + 2e = Ni φ 0 = -0.25 B
O2 + 4H + + 4e = 2H2O φ 0 = 1.23 B
Делаем вывод о том, что на катоде происходит восстановление ионов Ni 2+ (но не H2O), а на аноде происходит окисление никеля (но не молекул воды и ионов)
K(-): Ni 2+ + 2e = Ni
A(+): Ni – 2e = Ni 2+
Таким образом, при электролизе металлический анод выполняет роль не только проводника, но и подвергается окислению. Такой анод называется активным в отличие от инертного (платина, графит).
Электролиз с растворимым анодом часто проводят в целях создания металлических покрытий (гальваностегия). Покрываемое изделие при этом является катодом (его подключают к отрицательному полюсу источника постоянного тока), в роли анода используют металл, которым покрывают изделие.
Пример 4. Рассчитайте массу цинка, выделившегося при электролизе раствора ZnSO4 в течение 1 ч 40 мин при силе тока 5 А, если выход по току составляет 77.9 %. Чему равен электрохимический эквивалент цинка?
Решение: Массы веществ, фактически полученные при электролизе (mф), меньше, чем массы, рассчитанные по закону Фарадея (mрасч).
Коэффициент выхода по току (η = mф/mрасч) необходимо учитывать при расчетах по закону Фарадея
Электрохимический эквивалент цинка равен
Пример 5. Рассчитайте стандартную ЭДС поляризации при электролизе водного раствора с платиновыми электродами.
Решение: Учитываем значения электродных потенциалов и перенапряжение кислорода на платине (см. Приложение).
φH,OH 0 = -0.83 B при pH = 14 (стандартная реакция 2H2O + 2e = H2 + 2OH — )
φH,O 0 = 1.23 B (стандартная реакция O2 + 4H + + 4e = 2H2O)
Делаем вывод о том, что на катоде происходит восстановление молекул воды (величина φ 0 больше), а на аноде – окисление ионов Cl — (из-за высокого перенапряжения выделения кислорода, равного 1.6 В).
K(-): 2H2O + 2e = H2 + 2 OH —
A(+): 2Cl — — 2e = Cl2
Водород и хлор адсорбируются поверхностью платиновых электродов. При этом на катоде образуется водородный электрод, а на аноде – хлорный электрод. Они образуют гальванический элемент:
A(-): (Pt)H2 / OH — , H2O || Cl — / Cl2(Pt) :(+)K
ЭДС водородно-хлорного гальванического элемента направлена против внешней ЭДС и называется ЭДС поляризации. Явление «перерождения» электродов называется электрохимической поляризацией. Поляризация препятствует протеканию электролиза.
Рассчитываем ЭДС поляризации (Епол)
Епол = 1.36 – (-0.83) = 2.19 В
Для осуществления электролиза водного раствора NaCl к электродам надо приложить напряжение, превышающее 2.19 В.
Пример 6. При электролитическом осаждении всего цинка из 0.4 дм 3 раствора ZnCl2 на аноде выделилось 5.6 дм 3 хлора (н.у.). Рассчитайте массу цинка и молярную концентрацию исходного раствора. Составьте уравнения электродных процессов.
Решение: На катоде одновременно протекают процессы восстановления ионов Zn 2+ и молекул H2O, так как значения электродных потенциалов их близки по величине (φZn 0 = -0.76 B, φH,OH 0 = -0.83 B при pH = 14). На аноде происходит окисление ионов хлора, молекулы воды не окисляются из-за большого перенапряжения кислорода.
K(-): Zn 2+ + 2e = Zn
A(+): 2Cl — — 2e = Cl2
Рассчитываем массу выделившегося на катоде цинка по закону эквивалентов (II закон Фарадея)
Рассчитываем молярную концентрацию исходного раствора ZnCl2 ,учитывая, что из 1 моль ZnCl2 образуется 1 моль Zn и 1 моль Cl2:
1)
2)
Дата добавления: 2014-12-05 ; просмотров: 12129 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
📸 Видео
Гальванические элементы. 1 часть. 10 класс.Скачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз. Решение задач. 2 часть. 10 класс.Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Химия / 9 класс / ЭлектролизСкачать

91. Электролиз. Задачи (часть 2)Скачать

Электролиз растворов солей | Таисия Фламель | ЕГЭ Химия. ВебиумСкачать

Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

ЭлектролизСкачать

Электролиз. Решение задач. 1 часть. 10 класс.Скачать

ХИМИЯ 11 класс : Электролиз растворовСкачать

Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

7. ЭлектролизСкачать

Электролиз | ХИМИЯ ЕГЭ | Лия МенделееваСкачать