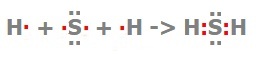Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Видео:Опыты по химии. Получение сероводорода и опыты с нимСкачать

Сероводород
Сероводород является аналогом воды. Его электронная формула
показывает, что в образовании связей El—S—Н участвуют два р-электрона внешнего уровня атома серы. Молекула H2S имеет угловую форму, поэтому она полярна.
Сероводород часто сопутствует нефти и природному газу, а также содержится в газах вулканических извержений п в водах минеральных источников (Пятигорск, Мацеста, Трускавец).
В больших количествах он скапливается при гниении серосодержащих органических веществ. Получают обычно сероводород действием разбавленных минеральных кислот на сульфид железа(П):
В обычных условиях сероводород — бесцветный газ с сильным характерным запахом тухлых яиц. Хорошо растворим в воде. В 1 объеме воды растворяется 4,37 объема сероводорода. В органических растворителях растворимость H2S значительно выше, например в 1 объеме этанола растворяется 17,89 объемов 112S.
Температура кипения сероводорода равна -60,8°С, при -85,7°С он переходит в твердое состояние.
Растворы сероводорода имеют кислую реакцию из-за диссоциации, которая протекает преимущественно по первой ступени:
Водный раствор H2S называется сероводородной водой. Способность образовывать водородные связи у H2S выражена слабее, чем у Н20. Сероводород является очень слабой кислотой, даже слабее угольной, которая обычно вытесняет H2S из сульфидов.
При нагревании H2S разлагается с образованием серы и водорода:
Степень окисления серы в H2S равна -2, поэтому в реакциях сероводород обычно проявляет восстановительные свойства. Как энергичный восстановитель, сероводород обычно окисляется, отдавая соответственно 2, б и 8 электронов. При этом сульфид-ион S 2 окисляется до S, S(IV) или S(VI).
Так, сероводород при взаимодействии с кислородом может окислиться либо до свободной серы, либо до S02: в смеси H2S с недостатком кислорода образуются S и Н20, что обычно используют для получения серы из различных газов, содержащих сероводород. В избытке кислорода сероводород сгорает с образованием воды и диоксида серы:
При взаимодействии сероводорода с галогенами образуются соответствующие галогенводородные кислоты:
Кислород воздуха окисляет сероводород в водных растворах на холоде, поэтому при длительном хранении растворы H2S мутнеют вследствие осаждения серы.
Различные окислители энергично реагируют с сероводородом. При действии азотной кислоты образуется свободная сера.
Раствор КМп04 обесцвечивается при пропускании через него сероводорода:
В реакции сероводорода с К2Сг207 Сг восстанавливается до Сг 3 ^:
Сероводород очень ядовит, при вдыхании связывается с гемоглобином, вызывая паралич, что нередко приводит к смертельному исходу. В малых концентрациях он менее опасен.
Сероводород образует два типа солей: средние — сульфиды (Na2S) и кислые — гидросульфиды (NallS).
Эти соли могут быть получены взаимодействием гидроксидов с сероводородом:
а также непосредственным взаимодействием серы с металлами или обменной реакцией солей с H2S.
Сульфиды щелочных металлов — бесцветные вещества, легко растворимые в воде. Сульфиды тяжелых металлов нерастворимы в воде.
Сульфиды щелочных и щелочно-земельных металлов в промышленности получают сплавлением сульфатов с углем:
Поскольку сульфиды являются солями слабой кислоты, то их водные растворы сильно гидролизованы. Так, сульфиды щелочных металлов при растворении в воде имеют щелочную реакцию:
Сульфид алюминия под влиянием воды гидролизуется необратимо:
Сульфид кальция в воде также подвергается гидролитическому разложению:
Сульфиды тяжелых металлов вследствие очень малой растворимости не гидролизуются. Все сульфиды, как и сам сероводород, являются энергич- и ы м и воеета и о вителям и:
При нагревании сульфиды взаимодействуют с кислородом, при этом происходит окисление S 2 до SO., или SO 2- . В некоторых случаях происходит восстановление металла:
Качественная реакция на сероводород (H2S) и сульфид-ион (S’ )
Концентрированные водные растворы сульфидов щелочных металлов растворяют серу, переходя в персульфиды:
Персульфиды следует рассматривать как соли иолисероводородных кислот общей формулы H2S„, где п = 2^-23.
Многочисленные соединения H2Sn (сульфаны) — желтые маслянистые жидкости, окраска которых изменяется в зависимости от п от желтого через оранжевый к красному. Персульфиды водорода можно получить действием кислот на (NH4)2S„ или Na2S„:
Наибольшее значение имеют персульфиды щелочных и щелочно-земельных металлов, а также (NH^S,, и FeS2 (пирит).
Персульфиды обладают свойствами как восстановителей, так и окислителей, что отличает их от сульфидов, для которых характерны только свойства восстановителей:
Персульфиды способны и к реакциям диспропорционирования:
Видео:Сероводород. Сульфиды. 9 классСкачать

Раствор сероводорода при хранении на воздухе мутнеет за счет образования серы напишите уравнение
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи для молекулы сероводорода.
Упражнение 2 Охарактеризуйте физические и химические свойства сероводорода.
Сероводород ― бесцветный газ, обладающий запахом тухлых яиц, немного тяжелее воздуха, растворяется в воде с образованием серной кислоты, ядовит.
Химические свойства сероводорода.
Реагирует со щелочами:
H2S + 2NaOH = Na2S + 2H2O
Проявляет сильные восстановительные свойства:
Очищают промышленные выбросы от сероводорода, окисляя его до серы оксидом серы (IV):
2H2S + SO2 = 3S + 2H2O
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 |2|4|2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Очищают промышленные выбросы от сероводорода, окисляя его до серы кислородом в недостатке:
2H2S + O2(недостаток) = 2S↓ + 2H2O
H2S -2 + O2 0 ⟶ S 0 + H2O -2
S -2 -2ē ⟶ S 0 |2|4|2 ― процесс окисления
О2 0 +4ē ⟶ 2О -2 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
В избытке кислорода сероводород горит:
2H2S + 3O2(избыток) = 2SO2 + 2H2O
H2S -2 + O2 0 ⟶ S +4 O2 -2 + 2H2O
S -2 -6ē ⟶ S +4 |6|12|2 ― процесс окисления
О2 0 +4ē ⟶ 2О -2 |4| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Проявляет сильные восстановительные свойства и в растворах (сероводородная кислота):
H2S + Br2 = S↓ + 2HBr
H2S -2 + Br2 0 ⟶ S 0 + 2HBr -1
S -2 -2ē ⟶ S 0 |2|2|1 ― процесс окисления
Br2 0 +2ē ⟶ 2Br -1 |2| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а бром — окислитель.
Более сильные окислители способны окислять сероводород до оксида серы (IV) и даже серной кислоты:
H2S + 3H2SO4 (конц.) = 4SO2↑ + 4H2O
H2S -2 + H2S +6 O4 ⟶ S +4 O2 + H2O
S -2 -6ē ⟶ S +4 |6|6|1 ― процесс окисления
S +6 +2ē ⟶ S +4 |2| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель , а серная кислота (за счёт атомов серы в степени окисления +6) — окислитель.
H2S + 8HNO3 (конц.) = H2SO4 + 8NO2↑ + 4H2O
H2S -2 + HN +5 O3 ⟶ H2S +6 O4 + N +4 O2 + H2O
S -2 -8ē ⟶ S +6 |8|8|1 ― процесс окисления
N +5 +1ē ⟶ N +4 |1| |8 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель , а азотная кислота (за счёт атомов азота в степени окисления +5) — окислитель.
Упражнение 3 Запишите сокращённое ионное уравнение качественной реакции на сульфид-ион.
Для обнаружения сероводородной кислоты и её солей в растворе используется растворимая соль свинца, в результате реакции образуется чёрный осадок сульфида свинца (II):
Pb 2+ + S 2- = PbS↓
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите молекулярные и ионные уравнения реакций сероводородной кислоты с хлорной водой, гидроксидом лития, нитратом свинца (II), оксидом серы (IV). В окислительно-восстановительных реакциях расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
H2S + Cl2 = S↓ + 2HCl
Схема окислительно-восстановительной реакции.
H2S -2 + Cl2 0 → S 0 + 2HCl -1
S -2 -2ē ⟶ S 0 | 2|2|1 ― процесс окисления
Cl2 0 +2ē ⟶ 2Cl -1 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента серы в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (H2S, S), а разными являются индексы элемента хлора в формуле исходного вещества и продукта реакции — коэффициент 1 (который обычно не пишем) только перед формулой хлора Сl2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а хлор — окислитель.
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 | 2|4|х2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4 | |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S -2 -4ē ⟶ 2S 0
S +4 +4ē ⟶ S 0
Добавим почленно эти уравнения, получим суммарную схему:
2S -2 + S +4 ⟶ 3S 0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Упражнение 2 Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
ZnS ⟶ H2S ⟶ S ⟶ FeS ⟶ SO2. Для окислительно-восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
ZnS + 2HCl = ZnCl2 + H2S↑
ZnS + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2S↑
ZnS + 2H + = Zn 2+ + H2S↑
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 | 2|4|х2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4 | |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S -2 -4ē ⟶ 2S 0
S +4 +4ē ⟶ S 0
Добавим почленно эти уравнения, получим суммарную схему:
2S -2 + S +4 ⟶ 3S 0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
S + Fe = FeS
Схема окислительно-восстановительной реакции.
S 0 + Fe 0 ⟶ Fe +2 S -2
Восстановитель Fe 0 — 2ē ⟶ Fe +2 | 2|2|1 ― процесс окисления
Окислитель S 0 + 2ē ⟶ S -2 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы железа и серы. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов железа и серы. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений (S, Fe, FeS) .
2FeS + 3O2 = 2FeO + 2SO2
Схема окислительно-восстановительной реакции.
FeS -2 + O2 0 ⟶ FeO + S +4 O2 -2
S -2 -6ē ⟶ S +4 |6|12|2 ― процесс окисления
O2 0 +4ē ⟶ 2O -2 |4 | |3 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 6 и 4. Это число 12, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 6 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 2 и 3 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений серы (FeS, SO2). Поскольку часть атомов кислорода не восстановилась, а вошла в состав FeO, поэтому ставим коэффициент 3 перед формулой кислорода О2.
2FeS + 3O2 ⟶ FeO + 2SO2 . Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Упражнение 3 Напишите по одному молекулярному уравнению реакции, соответствующему каждому из следующих ионных уравнений:
а) H2S + OH — = HS — + H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН — (LiOH, KOH, NaOH).
H2S + NaOH = NaHS + H2O
H2S + KOH = KHS + H2O
б) H2S + 2OH — = S 2- + 2H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН — (LiOH, KOH, NaOH).
H2S + 2NaOH = Na2S + 2H2O
H2S + 2KOH = K2S + 2H2O
в) HS — + OH — = S 2- + H2O;
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS — (LiHS, KHS, NaHS) и OH- (LiOH, NaOH, KOH).
NaHS + NaOH = Na2S + H2O
KHS + KOH = K2S + H2O
г) S 2- + Cu 2+ = CuS↓.
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS — (Li2S, K2S, Na2S) и Cu 2+ (CuF2, CuCl2, CuI2, CuSO4, Cu(NO3)2).
K2S + CuSO4 = K2SO4 + CuS↓
Na2S + CuSO4 = Na2SO4 + CuS↓
K2S + CuCl2 = 2KCl + CuS↓
Na2S + CuCl2 = 2NaCl + CuS↓
Na2S + Cu(NO3)2 = 2NaNO3 + CuS↓
K2S + Cu(NO3)2 = 2KNO3 + CuS↓
Упражнение 4 В химической реакции, протекающей по уравнению 2Н2S+Сl2=2S+2НСl, концентрация газообразного хлора за 3 минуты уменьшилась с 0,063 моль/л до 0,027 моль/л. Рассчитайте скорость химической реакции в данный промежуток времени.
1. Рассчитаем изменение концентрации вещества:
Δс=0,063 моль/л — 0,027 моль/л=0,036 моль/л
2. Рассчитаем промежуток времени:
Δt=3 мин=3●60 с=180 с
3. Вычисляем скорость химической реакции по формуле v= Δс/Δt, где Δ с — изменение концентрации вещества; Δ t — промежуток времени, за который произошло данное изменение концентрации.
v=0,036 моль/л : 180 с=0,0002 моль/л●с=0,2 моль/л●с
Ответ: 0,2 ммоль/л●с
Упражнение 5 В состав белой краски (свинцовых белил), нередко использовавшейся ранее для написания икон, входил сульфат свинца (II). Спустя длительное время белая краска таких икон чернела из-за взаимодействия с сероводородом. Образующийся сульфид свинца (II) – соль чёрного цвета. Для восстановления белых тонов икону обрабатывали раствором пероксида водорода, при этом сульфид свинца (II) вновь окислялся до сульфата свинца (II). Составьте уравнение этой реакции, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
PbS + 4H2O2 = PbSO4 + 4H2O
Схема окислительно-восстановительной реакции.
PbS -2 + H2O2 -1 ⟶ PbS +6 O4 -2 + H2O
S -2 -8ē ⟶ S +6 |8|8|1 ― процесс окисления
O -1 +2ē ⟶ O -2 |2 | |4 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 8 и 2. Это число 8, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 8 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 1 и 4 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (PbS, PbSO4). Поскольку часть атомов кислорода не восстановилась, а вошла в состав H2O, поэтому ставим коэффициент 4 только перед формулой пероксида водорода H2О2.
PbS + 4H2O2 = PbSO4 + H2O. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а пероксид водорода (за счёт атомов кислорода в степени окисления -1) — окислитель.
🎥 Видео
СЕРОВОДОРОД В ВОДЕ ИЗ СКВАЖИНЫ или ИЗ КОЛОДЦА? | ПОЛНЫЙ КУРС от А до Я ЗА 5 МИН.Скачать

Реакция сероводорода с ЧЕЛОВЕЧЕСКОЙ КРОВЬЮ!Скачать

Сульфидная (сероводородная) коррозия: последствияСкачать

🔥 ОГНЕННЫЙ ПОРОШОК загорается ОТ ВОЗДУХА. Интересный эксперимент своими руками.Скачать

УХОДИМ ОТ ИСПОЛЬЗОВАНИЯ БОРДОССКОЙ СМЕСИ КАК 100 ЗАЩИТЫ ОТ ВСЕГО.Скачать

Горение сероводорода. Химический опытСкачать

Очистка воды от железа и сероводорода своими руками в открытой емкости. Аэрация и обезжелезивание.Скачать

Запах сероводорода в скважинной воде (тех. задание: убрать запах перед системой очистки воды).Скачать

Адсорбция на границе фаз раствор-воздух (лабораторная работа)Скачать

Сероводород в водеСкачать

Адсорбция на поверхностях растворовСкачать

Сероводород в скважинеСкачать

Чудеса! Вот чем мне удалось растворить и вывести камни в желчном пузыреСкачать
Почему мутнеет самогон? Брызгоунос браги и опалесценция самогона. Очиститка помутневшего самогонаСкачать

Очистка воды от железа, марганца, сероводорода эжектором с аэрационной колоннойСкачать

Физика 10 класс (Урок№21 - Взаимные превращения жидкостей и газов.)Скачать

Напорная аэрация НЕ УДАЛЯЕТ сероводород 0,4 мг/л! Дозирование + замена фильтрующего материала!Скачать