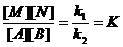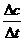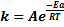Химическое равновесие. Обратимые и необратимые по равновесию реакции. Термодинамические условия равновесия. Константы химического равновесия. Прогнозирование смещения химического равновесия.
Химическое равновесие -состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем(А2 + В2 ⇄ 2AB)
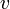
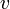
ΔG=0, ΔS=0, 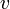
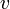
(Δ G – энергия Гиббса = ΔH — TΔS)
Обратимые хим.реакции-реакции, кот. при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях. Обратимость по направлению не тождественна с термодинамической обратимостью процесса. (ΔG 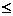
Необратимые хим.реакции-реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.( ΔG 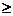
Константы химического равновесия
Скорость прямой реакции (обратимой): w₁= k₁* [A] [B] (1)
Cкорость обратной химический реакции: w₂=k₂* [N][M] (2)
Концентрации веществ, а в случае реальных р-ров активность (моль/л), фугитивность ( Па) в случае реальных газов , должны быть взяты в ст. их стехиометрических коэффициентов.
Константа равновесия( K)– постоянная величина-частное от деления константы скорости хим. реакции k₁ на константу скорости обратной реакции k₂. Если в уравнении для константы равновесия обратимой газовой реакции действующие массы всех реагентов представляют собой концентрации, выраженные в моль/л, то обозначается Кс, если же эти действующие массы заданы как соответствующие парциальные давления газов, то – Кр.
Равенства (1 и 2) следуют из закона действующих масс, они корректны лишь при опр. условиях. Предполагается, что средние расстояния между молекулами/ионами реагентов столь велики, что силовое взаимодействие м/у ними не отражается на их беспорядочном движении ( идеальные р-ры/газы, реальные газы приближаются к идеальных посредством понижения давления, растворы – по мере разбавления). Уравнение скоростей корректно лишь для одностадийных реакций, уравнение константы справедливо и для многостадийных реакций.
Численные значения константы равновесия зависят от : 1) природы реагентов, 2) температуры , 3) в случае обратимых реакций, сопровождающихся изменением V реагирующей системы — от давления. Не зависят от : 1) концентрации ( активности ), 2)парциальных давлений ( фугитивностей ).
Прогнозирование смещения химического равновесия.
Смещение ХРавн-я – изменение равновесных концентраций реаг. в-в и прод-в, вызванное к-либо воздействиями. Оно подчиняется принципу Ле Шателье-Брауна : «Если на систему, находящуюся в равновесии , оказать какое-либо воздействие, то в рез-те протекающих в ней процессов равновесие сместится в таком направлении, чтобы оказанный эффект был ослаблен.»
Факторы, влияющие на хим. равновесие:
1) Температура — при увеличении температуры ХРавн-е смещается в сторону эндотерм. р-ции, а при понижении – в сторону экзотермической.
2) Давление — при увеличении давления ХРавн-е смещается в сторону меньшего объема в-в, а при понижении – в сторону большего объема (только для газов)
3) Концентрация – при повышении концентрации одного из исходных в-в ХР смещается в сторону продуктов реакции, а при увеличении концентрации продуктов – в сторону исходных в-в.
4) Катализаторы не влияют на смещение ХРавн-я.
Условия протекания обратимых хим. реакций до конца:
1. Выпадает осадок
2. Выделяется труднорастворимый газ
3. Обр. слабый электролит ( например вода, хлорид ртути)
4. Обр. устойчивый комплексный ион или нейтральное комплексное соединение
5.Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучениея скоростей и механизмов биохимических процессов. Скорость химической реакции. Классификация реакций, применяющиеся в кинетике: реакции гомогенные, гетерогенные; реакции простые и сложные. Молекулярность реакции. Кинетические уравнения. Порядок реакции. Период полупревращения.
Хим. кинетика— раздел физ. химии, изучающий скорость и механизмы хим. реакций. Знание хим. К. повзоляет упр-ть ХР, регулировать их скорость. Можно ускорить ХР и тем самым увеличить выход продукта или замедлить.
Скорость явл. важнейщей хар-кой хим. превращений. Скорость 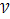
Δс= с₂-с₁ 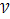
Δt=t₂-t₁ В ходе реакции идет убыль конц. исх. в-в и увеличение конц. продуктов реакции.
Скорость является функцией от времени: 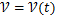
Скорость химической реакции зависит от:
1)природы веществ (экстенсивный ф-р-звисит от массы в-ва) закон Менделеева: свойства элементов и их соед. находятся в период. зависимости от зарядов их атомов;
2)от концентрации ( экстенсивный ф-р) закон действующих масс ( К.М.Гульберг, П.Вааге) : « при постоянной температуре 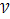
Чем больше конц.реагентов, тем больше % активных соударений молекул.
3)температуры ( интенсивный ф-р-число участников не изменяется, меняется их E ) правило Вант-Гоффа.
4)от присутствия катализаторов и ингибиторов,
Kat-инт.в-во, кот. в ничтожно малых кол-вах резко ускоряет реакцию.
Ing- в-во, замедляющее или предотвращающее течение какой-либо химической реакции.
Катализ бывает гомогенным ( kat в той же фазе, что и взаимод.в-ва), гетерогенным ( дает чистый продукт)
5)для вещества в твердом состоянии – от поверхности реагирующих веществ.
6) для в-ва в газообразном состоянии – от давления, из уравнения Менделеева-Клайперонаследует, что изменение каждого из компонентов газовой смеси должно оказывать на скорость газовой реакции то же влияние, что и пропорц. ему изм-ие этого же компонента.(p= cRT)
-простые- осуществляется посредством однотипных элементарных актов (взаимодействий или превращений частиц, в рез-те которого обр. новые частицы продуктов реакции или промежуточные продукты);
-сложные- те, которые состоят из нес-ких стадий, порядок реакции не совпадает с её молекулярностью.
2)по агрегатному состоянию:
-гомогенные-все исходные вещ-ва в одной фазе, реакция идет по всему объему смеси -гетерогенные- исх. вещ-ва в разных фазах, важна площадь соприкосновения реагирующих вещ-в.
Молекулярность- число молекул, одновременным взаимодействием которых осуществляется элементарный акт хим. реакции ( характеризуется только целыми числами).
Мономолекулярные р-ции-разложения (или изомеризации), бимолекулярные- осуществляются при столкновении 2 молекул; тримолекулярные; тетрамолекулярные.
Если выражение закона действующих масс для данной реакции известно, функц. зависимость концентр. участвующих в реакции в-в. от времени с(t) мб получена в аналитическом виде. Соответствующая функц. зависимость называется уравнением кинетики.
Порядок реакции-число, равное сумме показателей степеней конц. реагирующих веществ в уравнении для 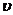
В виде случайного совпадения молекулярность может совпадать с порядком (для простых одностадийных реакций). Порядок реакции характеризует кинетическую зависимость скорости реакции от конц. реаг. в-в.
Период полупревращения-— это время, необходимое для того, чтобы исходная концентрация реагента уменьшилась вдвое. Измерение периода полупревращения приносит большую пользу при исследованиях порядка реакции. Например, в реакциях первого порядка период полупревращения 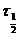
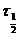
Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков.
Закон действующих масс ( К.М.Гульберг, П.Вааге) : «при постоянной температуре 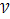
Чем больше конц.реагентов, тем больше % активных соударений молекул.
скорость прямой реакции : w₁=k₁*[A] a [B] b ,
скорость обратной реакции w₂=k₂*[M] m [N] n
примеры реакций , для которых k₁>>k₂ и w₁>>w₂ — обменные в р-рах,
примеры реакций, для которых k₂>k₁ и w₁>w₂ — гидролиз, заканчивающийся не полным превращением исх. соли в конечные продукты.
Чем больше ст.дробления (площадь контакта) , тем выше 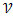
Порядок реакции-число, равное сумме показателей степеней конц.реагирующих в-в в кинетическом уравнении.
Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль хим.реакции: Eакт, уравнение Аррениуса.
Правило Вант-Гоффа : при повышении T реакции системы на каждые 10 C, скорость реакции увеличивается в 2-4 раза:
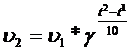
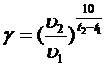
Для каждой реакции коэффициент свой ( от 2 до 4 ).
4)от присутствия катализаторов и ингибиторов,
Kat-инт.в-во, кот. в ничтожно малых кол-вах резко ускоряет реакцию.
С точки зрения закона действующих масс изменение скорости обусловлено температурной зависимости константы скорости.
Типы температурной зависимости:
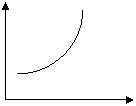
1) нормальный – возрастает скорость с увеличением t (характерна для простых реакций)
 |
2) аномальный – падение скорости с увеличением t (газофазная реакция азота (II) оксида с бромом)
 |
3) ферментативный – реакции с участием ферментов. (почти все реакции, протек. в организме).
 |
Ферменты-большие молекулы белковой природы,
2)проявлением каталитической акт.в довольно
мягких условиях T,p,кислотности среды.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
1. Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
2. Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
3. Молекулы должны быть правильно ориентированы относительно друг друга.
При низкой (для определённой реакции) температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Энергия активации (Ea) — та минимальная энергии, которую необходимо сообщить 1 моль в-ва, чтобы все молекулы в нем стали активными.
Уравнение Аррениуса:это уравнение связывает константу скорости.
Eа, A–постоянные, не зависящие от t. Величина А — предэкспоненциальный коэф-т,указывающий долю числа столкновений м/у молекулами, оканчивающими реакцию.;R –универсальная газовая постоянная=8,314 Дж/моль*К;T –абсолютная температура.

Энергия активации в реакциях = 0, => скорость мгновенна
Энергия активации в эндо- и экзо- реакциях неодинакова
- Разница между первым и нулевым порядком кинетики
- Содержание:
- Основное отличие — первый порядок против нулевого порядка кинетики
- Ключевые области покрыты
- Что такое кинетика первого порядка
- Что такое кинетика нулевого порядка
- Разница между первым и нулевым порядком кинетики
- Определение
- График концентрации реагента в зависимости от времени
- Концентрация реагента
- Оценить Закон
- Заключение
- Молекулярность реакции. Порядок реакции Уравнение кинетики реакций 1-го, 2-го и нулевого порядка. Период полупревращений.
- 📹 Видео
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Разница между первым и нулевым порядком кинетики

Видео:Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Содержание:
Видео:Порядок реакцииСкачать

Основное отличие — первый порядок против нулевого порядка кинетики
Химическая кинетика описывает скорости химических реакций. Концепция химической кинетики была впервые разработана по закону массового действия. Закон действия массы описывает, что скорость химической реакции пропорциональна массе реагентов. Согласно химической кинетике, реакции могут быть классифицированы как реакции нулевого порядка, реакции первого порядка и реакции второго порядка. главное отличие между первым и нулевым порядком кинетики является то, что скорость кинетики первого порядка зависит от концентрации одного реагента, тогда как скорость кинетики нулевого порядка не зависит от концентрации реагентов.
Ключевые области покрыты
1. Что такое кинетика первого порядка
— определение, свойства, примеры
2. Что такое кинетика нулевого порядка
— определение, свойства, примеры
3. В чем разница между первым и нулевым порядком кинетики
— Сравнение основных различий
Ключевые слова: концентрация, кинетика первого порядка, кинетика, закон действия массы, константа скорости, закон скорости, скорость реакции, кинетика нулевого порядка
Видео:Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Что такое кинетика первого порядка
Кинетика первого порядка относится к химическим реакциям, скорость реакции которых зависит от молярной концентрации одного реагента. Скорость реакции пропорциональна концентрации одного реагента. Может быть много других реагентов, принимающих участие в химической реакции, но только один реагент будет определять скорость реакции. Следовательно, известно, что другие реагенты находятся в нулевом порядке по отношению к этой конкретной реакции.
Например, давайте рассмотрим разложение пятиокиси азота (N2О5). Это мономолекулярная реакция. Это означает, что эта реакция состоит только из одного реагента. Скорость реакции может быть указана ниже.
k — константа скорости и [Н2О5 (г)] концентрация N2О5 (г), Буква «м» дает порядок реакции относительно концентрации N2О5 (г), Вышеупомянутое уравнение известно как закон скорости и для вышеупомянутого уравнения m = 1. Тогда скорость реакции может быть приведена ниже.
Значение m можно получить экспериментально. Здесь значение всегда будет одним. Это указывает на разложение N2О5 (г) это реакция первого порядка. Кроме того, порядок реакции может совпадать или не совпадать со стехиометрическим коэффициентом реагентов. В приведенном выше примере порядок реакции равен 1, хотя стехиометрический коэффициент равен 2. Скорость реакции первого порядка может быть показана на графике, как показано ниже.
Рисунок 1: График кинетики первого порядка
На приведенной выше диаграмме график с темными точками представляет собой график зависимости концентрации реагента от времени реакции. Это изогнутый график, который показывает, что скорость реакции изменяется с концентрацией реагента. График с белыми точками показывает график зависимости ln [концентрация реагента] от времени реакции. Это линейный граф.
Видео:5 3 Порядок реакцииСкачать

Что такое кинетика нулевого порядка
Кинетика нулевого порядка относится к химическим реакциям, скорость реакции которых не зависит от концентрации реагента. Другими словами, концентрация реагентов не влияет на скорость реакции. Поэтому, пока температура постоянна, скорость реакции будет постоянной в кинетике нулевого порядка.
Независимо от того, какие реагенты присутствуют и в какой степени их концентрации были изменены, скорость реакции останется неизменной. Поэтому скорость реакции задается как
Где k — константа скорости.
Хорошим примером для реакций нулевого порядка является разложение закиси азота в присутствии платины в качестве катализатора.
Скорость этой реакции равна константе скорости. Следовательно, скорость реакции может быть приведена ниже.
Рисунок 2: график зависимости концентрации реагента от времени реакции
Приведенный выше график показывает изменение концентрации реагентов в зависимости от времени реакции для кинетики нулевого порядка. Это линейный граф.
Видео:Кинетика || Лекция 3 || Реакции первого порядкаСкачать

Разница между первым и нулевым порядком кинетики
Определение
Кинетика первого порядка: Кинетика первого порядка относится к химическим реакциям, скорость реакции которых зависит от молярной концентрации одного реагента.
Кинетика нулевого порядка: Кинетика нулевого порядка относится к химическим реакциям, скорость реакции которых не зависит от концентрации реагента.
График концентрации реагента в зависимости от времени
Кинетика первого порядка: График зависимости концентрации реагента от времени для кинетики первого порядка представляет собой кривую кривую.
Кинетика нулевого порядка: График зависимости концентрации реагента от времени для кинетики нулевого порядка представляет собой линейный график.
Концентрация реагента
Кинетика первого порядка: Кинетические реакции первого порядка зависят от концентрации реагента.
Кинетика нулевого порядка: Кинетические реакции нулевого порядка не зависят от концентрации реагента.
Оценить Закон
Кинетика первого порядка: Закон скорости кинетических реакций первого порядка включает в себя константу скорости, умноженную на концентрацию реагента.
Кинетика нулевого порядка: Закон скорости кинетических реакций нулевого порядка включает в себя только константу скорости.
Заключение
Закон скорости или уравнение скорости дает наиболее важные детали о химической кинетике систем. Он описывает скорость конкретной реакции относительно концентрации реагента и константы скорости при постоянной температуре. Согласно кинетике химических реакций, существует три основных типа реакций. Это реакции нулевого порядка, реакции первого порядка, реакции второго порядка. Эти реакции отличаются друг от друга в зависимости от порядка реакции относительно реагентов, присутствующих в конкретной системе.
Рекомендации:
1. «Реакции первого порядка». Химия LibreTexts. Libretexts, 04 июля 2017 года. Веб.
Видео:Составляем кинетические уравненияСкачать

Молекулярность реакции. Порядок реакции Уравнение кинетики реакций 1-го, 2-го и нулевого порядка. Период полупревращений.
Молекулярность и порядок реакцииПри изучении реакций выделяют молекулярность и порядок реакции.Молекулярность реакции — это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения. В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,запись А > С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В>С или 2А > С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D > С или 2 А + В > С, или 3А>С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее. Выше было сказано, что порядок химической реакции выражаетсяс уммой:
где аi — показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции — экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции bB + dD = P,скорость которой W = КСBbCD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CD d тогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина — сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
В качестве критерия скорости реакции нередко используется период полупревращения t1/2 , равный времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией.
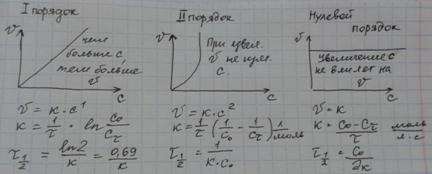
Первый порядок имеют реакции диссоциации или разложения молекул Н2 → 2Н; радиоактивного распада 22286Rn →4 2α +21882Rn (радон).
Для реакций первого порядка кинетическое уравнение имеет вид- dС/ dt = k1 С.
Разделяя переменные — dС/С = k1 dt и интегрируя полученное уравнение, находят ∫СС0 -dС/С = (integ)0t k1 dt, находят -(lnС – lnС0) = k1t
lnС = lnС0 – k1 t ; С = С0exp(-k1 t)
реакции первого порядка имеют особенности:
— график зависимости lnС от t выражается прямой линией. Это значит, что в полулогарифмических координатах, при разных начальных концентрациях прямые будут параллельны между собой;
-концентрация исходного вещества стремится к нулю при t-> oo. Полностью
вещество реагирует за бесконечно большой промежуток времени;
—скорость реакции также отличается экспоненциальной зависимостью r = k1С0e- k1 t
-размерность константы скорости реакции первого порядка соответствует обратному времени и ее можно выразить в обратных секундах, минутах, часах и т.д;
—время полупревращения при С = С0/2
t1/2 = ln2 /k, т.е. не зависит от начальной концентрации реагирующего вещества;
—кинетическая кривая реакции первого порядка инвариантна при линейном преобразовании концентрации (график имеет вид верхней части равносторонней гиперболы стр 249). Примеры реакций второго порядка : Н2 + I2 ->2НI ; или 2NО 2->2NО + О2
если в реакции участвуют два компонента, концентрации которых равны, то дифференциальное уравнение имеет вид — dС/dt = k2 С × С. (или С2)
Разделение переменных и интегрирование в пределах от Со до С приводит к следующему результату:
1/С — 1/С0 = k2 t
из уравнения следует, что концентрация исходных веществ зависит от времени следующим образом:
С = С0 / (1+ k2 С0 t)
Полученные уравнения позволяют отметить следующие особенности реакций второго порядка:
-при равенстве начальных концентраций реагирующих веществ обратная концентрация линейно зависит от времени (стр 251) 1/С = 1/С0 + k2 t
—константа скорости k2 = (1/ t) ( 1 /С — 1 /С0) = (1/t) (С0 – С) /СС0 где k – л моль-1 с-1
—время полупревращения при С=С0 /2
(1 /С0 /2) – (1 /С0) = k2 t1 /2 отсюда t1/2 = 1 / (k2 С0)
в отличие от реакций первого порядка время полупревращения реакций второго порядка обратно пропорционально начальной концентрациНулевой порядок имеет место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы. Нулевой порядок наблюдается если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул. Например, при фотохимических реакциях определяющим фактором может служить количество поглощенного излучения, а не концентрация вещества. Часто в каталитических реакциях скорость зависит от концентрации катализатора, а не от концентрации реагирующих веществ.
Кинетическое уравнение для реакция нулевого порядка имеет вид: — dС/ dt = k.
Разделяя переменные (- dС= k dt ) и интегрируя в пределах от начальной концентрации Со (t =0) до текущей концентрации С в момент времени t:- ∫СС0 dС = ∫0t k dt получают С = С0 — k t реакции нулевого порядка имеют следующие особенности:
-в соответствии с последним выражением в реакциях нулевого порядка концентрация исходного вещества линейно уменьшается о времени (кинетическая кривая — линейная зависимость стр 247);
—константа скорости k = (С0 – С ) /t. Ее размерность такая же как и размерность скорости реакции;
—время полупревращения t1/2, при С = С0/2 t1/2 = С0 / 2 k, т.е. для реакции нулевого порядка t1/2 пропорционально начальной концентрации исходного вещества.
Дата добавления: 2016-01-16 ; просмотров: 2857 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
📹 Видео
Кинетика | Реакции 1-го порядка | Олимпиадные задачи по химииСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Основы химической кинетикиСкачать

5 2 Кинетические уравненияСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

5 3 Определение порядка реакцийСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Задача недели. Химия. №38. Кинетика реакций первого порядкаСкачать

задачи на порядок хим реакцииСкачать

Скорость реакции. Химия – ПростоСкачать

5 1 Скорость химических реакцийСкачать

Химическая кинетика I. Порядок реакции.Скачать

КИНЕТИКА- КЛАССИФИКАЦИЯ РЕАКЦИЙСкачать