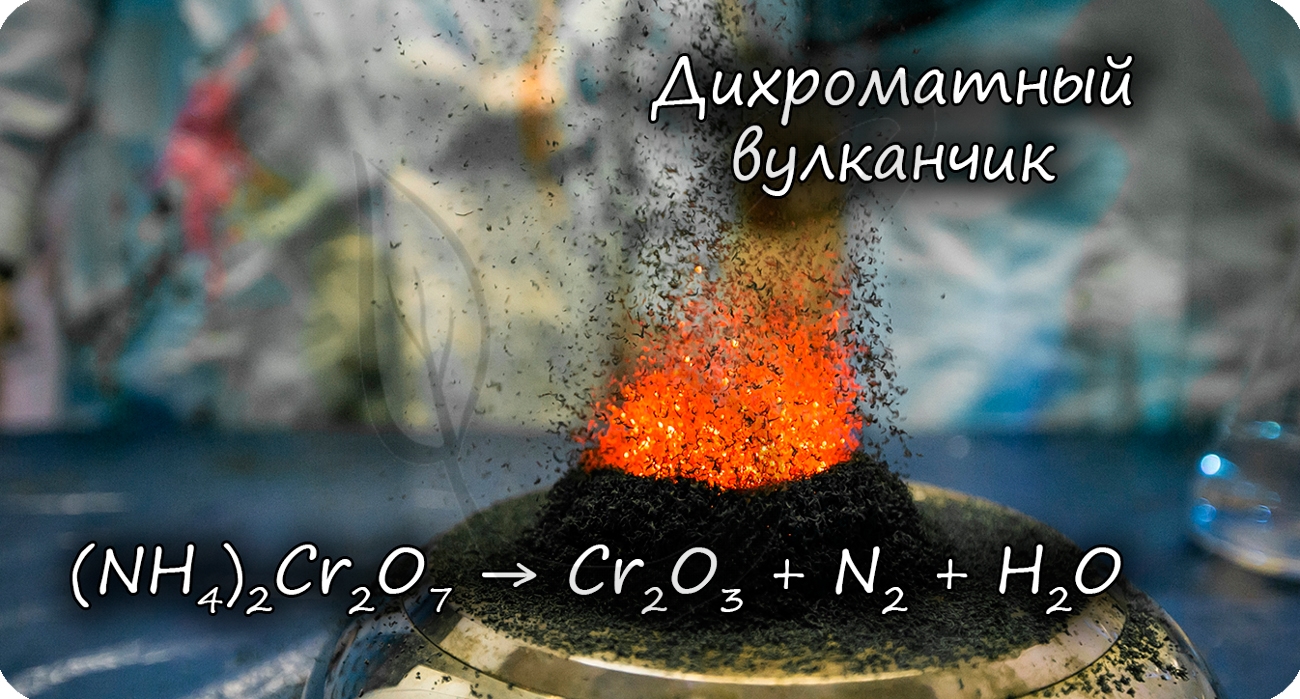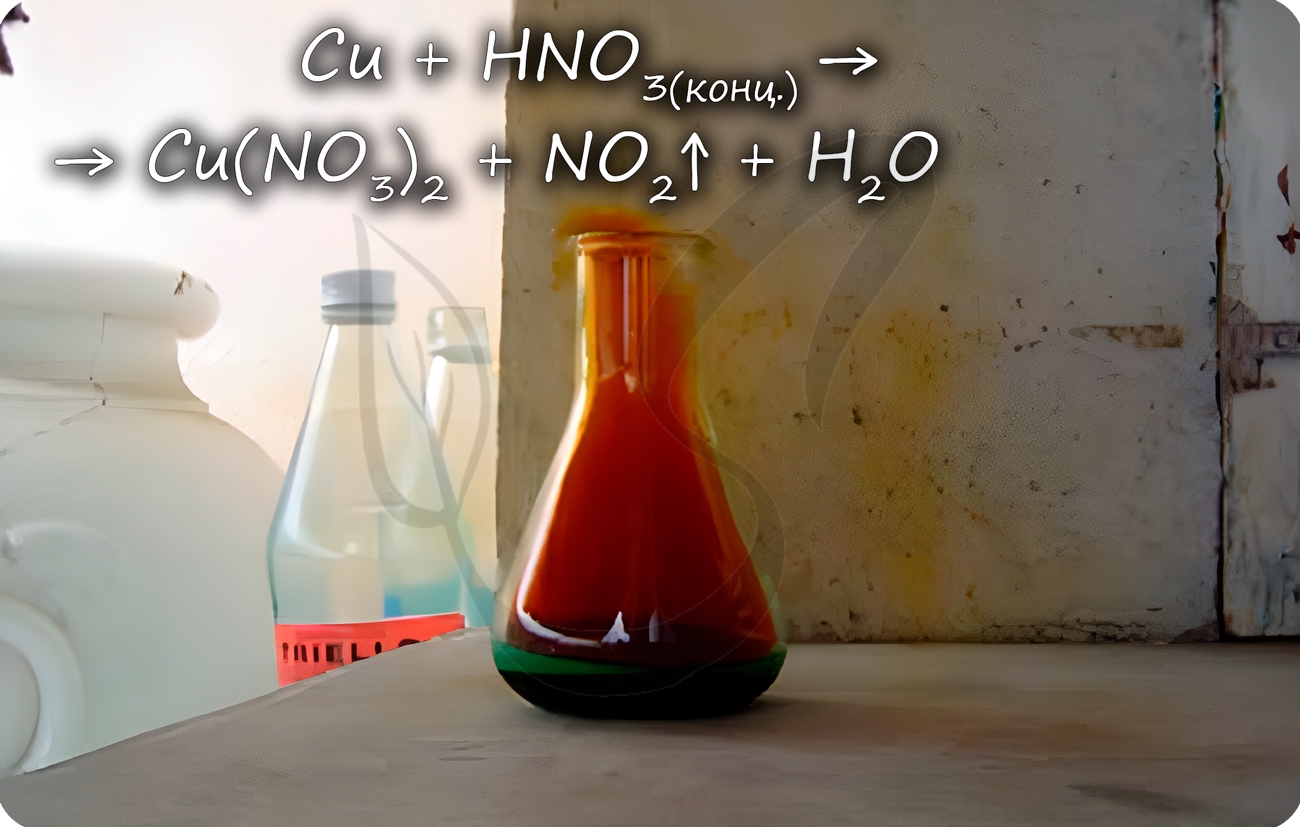- Положение в периодической системе химических элементов
- Электронное строение атома хрома
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид хрома (III)
- Способы получения
- Химические свойства
- Оксид хрома (II)
- Химические свойства
- Оксид хрома (VI)
- Способы получения
- Химические свойства
- Гидроксид хрома (III)
- Способы получения
- Химические свойства
- Гидроксид хрома (II)
- Способы получения
- Химические свойства
- Соли хрома
- Соли хрома (II)
- Соли хрома (III)
- Гидролиз солей хрома (III)
- Хромиты
- Соли хрома (VI)
- Хром, железо и медь
- Занятие элективного курса «Хром и его соединения»
- 🔥 Видео
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

3s 


Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890 о С, температура кипения 2680 о С, плотность хрома 7,19 г/см 3 .
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами . При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например , хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами . При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например , хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Обратите внимание , если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
1.3. Хром взаимодействует с фосфором . При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например , хром бурно реагирует с соляной кислотой :
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы , например медь, олово, серебро и др. из растворов их солей.
Например , хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например , при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид . При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например , оксид хрома (III) взаимодействует с оксидом натрия:
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет . При этом оксид хрома (III) проявляет кислотные свойства.
Например , оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства . В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например , оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами .
Например , оксид хрома (III) реагирует с серной кислотой:
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например , оксид хрома (III) реагирует с алюминием (термит):
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната калия:
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом . Все соединения хрома (II) – сильные восстановители.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами .
Например , оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами .
Например , оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например , сера окисляется до оксида серы (IV):
Оксид хрома (VI) также окисляет сложные вещества, например , сульфиты:
И некоторые органические веществ, например , этанол:
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например , хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например , хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами . При этом образуются средние соли.
Например , гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли . При этом гидроксид хрома (III) проявляет кислотные свойства.
Например , гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Например , при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например , хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например , хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства . В частности, реагирует с растворимыми кислотами .
Например , гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
3. Гидроксид хрома (II) – сильный восстановитель.
Например , под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Видео:Оксид Хрома(6) - CrO3. Реакция Дихромата Калия и Серной Кислоты. Реакция K2Cr2O7 и H2SO4.Скачать

Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
- Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Протекает в раскаленном состоянии.
Реакции с кислотами
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Реакции с солями менее активных металлов
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
- Реакции с неметаллами
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
И еще одна качественная реакция на ионы Fe 3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
- Реакции с неметаллами
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Реакции с кислотами
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
С оксидами неметаллов
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
- Реакции с кислотами
CuO + CO = Cu + CO2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Реакции с кислотами
Реакции с щелочами
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Реакции с кислотными оксидами
Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Получение ОКСИДА ХРОМА (VI) CrO3. Реакция ДИХРОМАТА КАЛИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. ОпытыСкачать

Занятие элективного курса «Хром и его соединения»
Разделы: Химия
Цель: углубить знания учащихся по теме занятия.
- дать характеристику хрома как простого вещества;
- познакомить учащихся с соединениями хрома разной степени окисления;
- показать зависимость свойств соединений от степени окисления;
- показать окислительно – восстановительные свойства соединений хрома;
- продолжить формирование умений учащихся записывать уравнения химических реакций в молекулярном и ионном виде, составлять электронный баланс;
- продолжить формирование умений наблюдать химический эксперимент.
Форма занятия: лекция с элементами самостоятельной работы учащихся и наблюдением за химическим экспериментом.
I. Повторение материала предыдущего занятия.
1. Ответить на вопросы и выполнить задания:
— Какие элементы относятся к подгруппе хрома?
— Написать электронные формулы атомов
— К какому типу элементов относятся?
— Какие степени окисления проявляют в соединениях?
— Как изменяется радиус атомов и энергия ионизации от хрома к вольфраму?
Можно предложить заполнить учащимся заполнить таблицу, используя табличные величины радиусов атомов, энергии ионизации и сделать выводы.
| Элемент | Электронные формулы | Радиус атома нм | Энергия ионизации эВ | Степень окисления |
| хром | …3s 2 3p 6 3d 5 4s 1 | 0,125 | 6,76 | +2,+3,+6 |
| молибден | …4s 2 4p 6 4d 5 5s 1 | 0,136 | 7,10 | +3,+4,+5,+6 |
| вольфрам | …5s 2 5p 6 5d 4 6s 2 | 0,140 | 7,98 | +3,+4,+5,+6 |
2. Заслушать сообщение учащегося по теме «Элементы подгруппы хрома в природе, получение и применение».
- Хром.
- Соединения хрома. (2)
- Оксид хрома; (2)
- Гидроксид хрома. (2)
- Соединения хрома. (3)
- Оксид хрома; (3)
- Гидроксид хрома. (3)
- Соединения хрома (6)
- Оксид хрома; (6)
- Хромовая и дихромовая кислоты.
- Зависимость свойств соединений хрома от степени окисления.
- Окислительно – восстановительные свойства соединений хрома.
Хром – это белый с голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см 3 ), температура плавления 1890˚С.
Химические свойства: хром при обычных условиях неактивный металл. Это объясняется тем, что его поверхность покрыта оксидной пленкой (Сr2О3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре:
Задание: составить уравнения реакций хрома с азотом, фосфором, углеродом и кремнием; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель.
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
Задание: составить электронный баланс, указать окислитель и восстановитель.
Хром реагирует с разбавленной серной и соляной кислотами:
Задание: составить электронный баланс, указать окислитель и восстановитель.
Концентрированные серная соляная и азотная кислоты пассивируют хром.
2. Соединения хрома. (2)
1. Оксид хрома (2) — СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) — Сr(ОН)2), не растворяется в воде, но растворяется в кислотах:
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (2) с серной кислотой.
Оксид хрома (2) легко окисляется на воздухе:
Задание: составить электронный баланс, указать окислитель и восстановитель.
Оксид хрома (2) образуется при окислении амальгамы хрома кислородом воздуха:
2Сr (амальгама) + О2 = 2СrО
2. Гидроксид хрома (2) — Сr(ОН)2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами:
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (2) с соляной кислотой.
Как и оксид хрома (2), гидроксид хрома (2) окисляется:
Задание: составить электронный баланс, указать окислитель и восстановитель.
Получить гидроксид хрома (2) можно при действии щелочей на соли хрома (2):
Задание: составить ионные уравнения.
3. Соединения хрома. (3)
1. Оксид хрома (3) — Сr2О3 – порошок темно – зеленого цвета, нерастворим в воде, тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома (3) – Сr(ОН)3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (3) с гидроксидом лития.
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (3) с конценрированной серной кислотой и концентрированным раствором гидроксида натрия.
Оксид хрома (3) может быть получен при разложении дихромата аммония:
2. Гидроксид хрома (3) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (3):
Задание: составить ионные уравнения
Гидроксид хрома (3) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (3), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия гидроксида хрома (3) с соляной кислотой и гидроксидом натрия.
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
4. Соединения хрома. (6)
1. Оксид хрома (6) — СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
- СrО3 + Н2О = Н2СrО4(хромовая кислота – образуется при избытке воды)
- СrО3 + Н2О =Н2Сr2О7(дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
Задание: составить уравнения химических реакций оксида хрома (6) с йодом, фосфором, углем; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель
При нагревании до 250 0 С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
2. Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО4 2- и дихромат – ионы Сr 2О7 2- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
5. Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr2О3 | СrО3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 |
Н2Сr2О7
→ ослабление основных свойств и усиление кислотных→
6. Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr +6 переходят в соединения Сr +3 под действием восстановителей: H2S, SO2, FeSO4
1. Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
2. Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr +3 переходят в соединения Сr +6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
- 2KCrO2 +3 Br 2 +8NaOH =2Na2CrO4 + 2KBr +4NaBr + 4H2O
- Cr +3 — 3e → Cr +6
- Br2 0 +2e → 2Br —
Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr +2 → Сr +3 → Сr +6 . Соединения хрома (2) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (3). Соединения хрома (6) – сильные окислители, легко восстанавливаются в соединения хрома (3). Соединения хрома (3) при взаимодействии с сильными восстановителями проявляют окислительные свойства, переходя в соединения хрома (2), а при взаимодействии с сильными окислителями проявляют восстановительные свойства, превращаясь в соединеня хрома (6)
К методике проведения лекции:
- Для активизации познавательной деятельности учащихся и поддержания интереса, целесообразно в ходе лекции проводить демонстрационный эксперимент. В зависимости от возможностей учебной лаборатории можно демонстрировать учащимся следующие опыты:
- получении оксида хрома (2) и гидроксида хрома (2), доказательство их основных свойств;
- получение оксида хрома (3) и гидроксида хрома (3), доказательство их амфотерных свойств;
- получение оксида хрома (6) и растворение его в воде (получение хромовой и дихромовой кислот);
- переход хроматов в дихроматы, дихроматов в хроматы.
- Задания самостоятельной работы можно дифференцировать с учетом реальных учебных возможностей учащихся.
- Завершить лекцию можно выполнением следующих заданий: напишите уравнения химических реакций с помощью которых можно осуществить следующие превращения:
- Cr→ CrCl2→ Cr(OH)2→ Cr(OH)3→ Cr(NO3)3→ Cr2O3→ Cr
- Cr →Cr(NO3)3→ Cr(OH)3→ K3[Cr(OH)6]→ Cr(OH)3→ CrCl3
- Cr2(SO4)3→ Cr(OH)3→ CrCl3
.III. Домашнее задание: доработать лекцию (дописать уравнения химических реакций)
Перечень рекомендуемой литературы:
- Васильева З.Г. Лабораторные работы по общей и неорганической химии. -М.: «Химия», 1979 – 450 с.
- Егоров А.С. Репетитор по химии. – Ростов-на-Дону: «Феникс», 2006.-765 с.
- Кудрявцев А.А. Составление химических уравнений. — М., «Высшая школа», 1979. — 295 с.
- Петров М.М. Неорганическая химия. – Ленинград: «Химия», 1989. – 543 с.
- Ушкалова В.Н. Химия: конкурсные задания и ответы. — М.: «Просвещение», 2000. – 223 с.
🔥 Видео
Химический вулкан и огненная метель с оксидом хрома!Скачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Реакция ОКСИДА ВАНАДИЯ, СЕРЫ и СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА ВАНАДИЯ. Опыты по химии дома.Скачать

Очень агрессивный реактив - ТРИОКСИД ХРОМА!Скачать

Серная кислота и ее соли. 9 класс.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Взаимодействие оксида меди с серной кислотойСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать

Триоксид Серы(6). Разложение Сульфаминовой кислоты. Ангидрид Серной кислоты.Скачать

Реакция Оксида Кальция и Серной Кислоты. Реакция CaO и H2SO4.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакция на оксид хрома шестивалентный. Как определяют концентрацию хрома в сварочном аэрозолеСкачать

Качественная реакция ионов хрома(III) со щелочью. Получение и свойства гидроксида хромаСкачать

Серная кислота. Химические свойства. Реакции с металлами.Скачать

Получение угольной пены - Реакция сахара и серной кислоты!Скачать