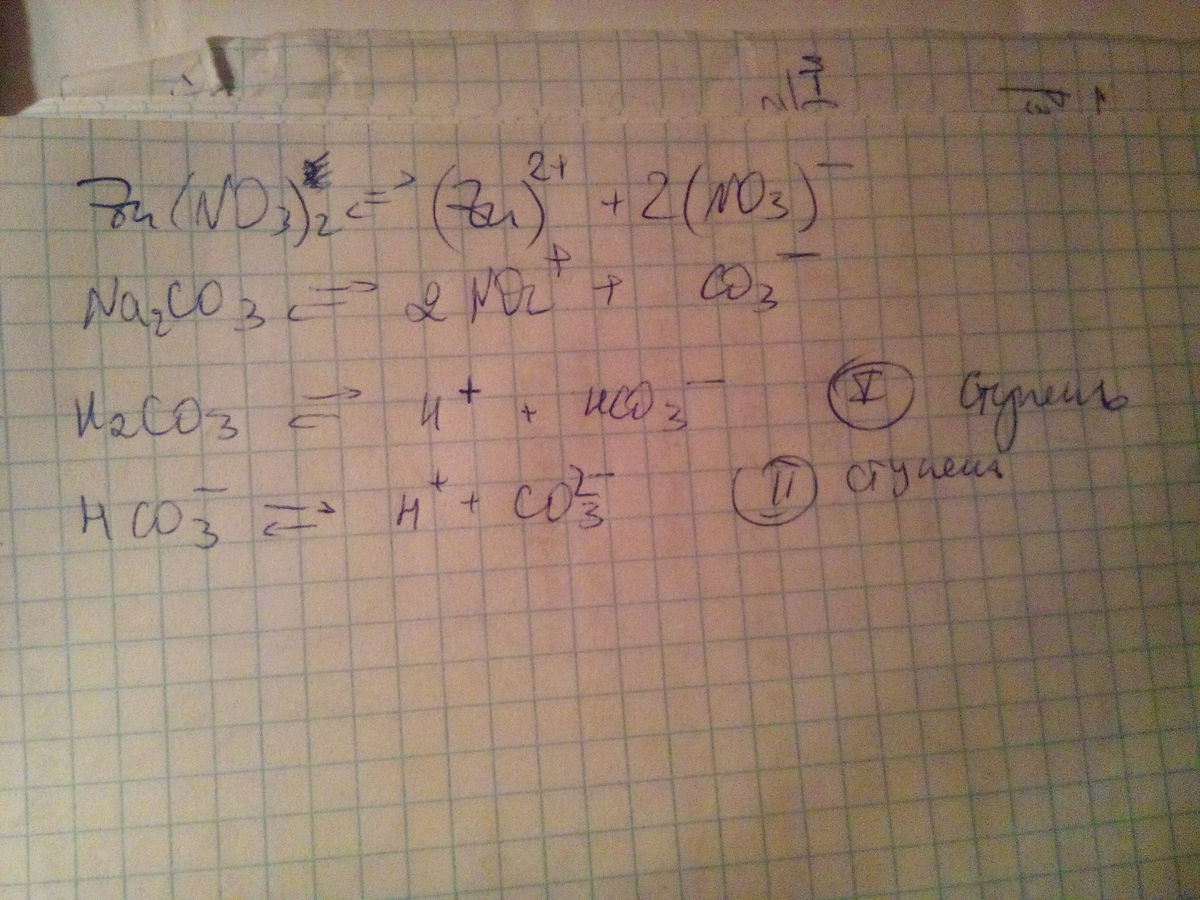Химия | 5 — 9 классы
Составьте уравнения диссоциации следующих электролитов : нитрата цинка, карбоната натрия , угольной кислоты.
Кислота диссоциирует двуступенчато
Соли диссоциируют ступенчато, только если они являются основными или кислотными.
- Написать уравнения реакций диссоциации следующих веществ : нитрат натрия, карбонат калия, гидроксид железа (III), сульфат алюминия ; хлорид бария, оксид цинка, фосфат калия, серная кислота, гидроксид ?
- Напишите формулы и определите силу электролитов :а?
- Написать уравнения диссоциации веществ : карбоната калия, гидроксида кальция, фосфата аммония, бромоводородной кислоты, угольной кислоты, силиката натрия, сульфита натрия?
- Составьте уравнения диссоциации следующих электролитов : иодид бария, серная кислота, гидроксид кальция?
- Напишите уравнения электралитической диссоциации веществ гидроксид натрия карбонат натрия сероводародная кислота гидроксид бария нитрат свинца?
- Составьте формулы следующих солей : нитрата бария, хлорида алюминия?
- СРОЧНО ПОМОГИТЕ С ХИМИЕЙ?
- Срочно помогите с химией?
- Из данного перечня выберите сильные электролиты :А) уксусная кислота ;Б) нитрат натрия ;В) нитрат бария ;Г) сероводородная кислота ;Д) гидроксид бария ;Е) сульфид натрия ;Ж) угольная кислота ;З) карбо?
- Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота?
- УЧЕБНАЯ КНИГА ПО ХИМИИ
- § 7.3. Соли. Гидролиз 2. Соль образована слабой кислотой и сильным основанием, например ацетат натрия NaCH3COO, карбонат натрия (сода) Na2CO3, нитрит натрия NaNO2, сульфит натрия Na2SO3, сульфид натрия Na2S, цианид натрия NaCN. Карбонат натрия диссоциирует: Na2CO3 = 2Na + + . Гидролизу подвергается карбонат-ион. Гидролиз проходит в две ступени: + Н2О = + ОН – , + Н2О = Н2CO3 + ОН – . В водном растворе гидролиз по второй ступени не проходит – из раствора соды углекислый газ не выделяется. Чтобы гидролиз прошел по второй ступени, равновесие следует сместить вправо добавлением в раствор кислоты (ионов водорода). Образующаяся при этом неустойчивая угольная кислота распадается на углекислый газ и воду: Обычно приводимое в учебниках химии уравнение реакции между карбонатом натрия и кислотой с образованием углекислого газа представляет собой смещенную вправо реакцию гидролиза. Кроме того, это не реакция обмена, а реакция гидролиза, проходящая по второй ступени. Как реакция обмена она протекает при действии газообразного хлороводорода на кристаллический карбонат натрия. Пример. Рассчитать рН 0,1М раствора карбоната натрия. Будем считать, что гидролиз проходит только по первой ступени: + Н2О = + ОН – . После преобразований константы гидролиза получаем: В этом выражении Ккисл есть константа диссоциации иона : = + Н + , Обратите внимание, что в расчете используется константа диссоциации кислоты H2CO3 по второй ступени! Для угольной кислоты из справочных данных находим: Н2СО3 = + Н + | | | К1 = 4,31•10 –7 , = + Н + К2 = 5,61•10 –11 . Эти данные подставляем в формулу: рОН = –lg 4,22•10 –3 = 2,4, рН = 14 – рОН = 11,6. При какой концентрации раствора гидроксида натрия в воде достигается то же значение рН? Рассчитайте. Можно дать приблизительный ответ. А как быть, если вас попросят написать уравнение гидролиза кислой соли, например гидрокарбоната натрия NaHCO3? Если вы сразу же напишите уравнение диссоциации соли NaHCO3 = Na + + , то, очевидно, гидролизу подвергается ион и уравнение гидролиза имеет вид: + Н2О = Н2СO3 + ОН – . Образование неустойчивой угольной кислоты приводит к тому, что уже при слабом нагревании начинается выделение из раствора углекислого газа (тесто с добавленным в него пекарским порошком «поднимается»). По теории кислот и оснований И.Н.Брёнстеда кислотный ион может быть и кислотой, и основанием в зависимости от того, записано ли уравнение реакции гидролиза или уравнение взаимодействия с ионом водорода: 3. Соль образована слабым основанием и слабой кислотой, например ацетат аммония NH4CH3COO, гидрокарбонат аммония NH4HCO3, гидросульфит аммония NH4HSO3, нитрит аммония NH4NO2. Гидролиз такой соли рассмотрим на примере ацетата аммония, диссоциирующего в водном растворе по уравнению NH4CH3COO = + CH3COO – . Оба иона этой соли образуют с водой слабые электролиты – гидроксид аммония и уксусную кислоту, поэтому реакцию гидролиза можно описать одним общим уравнением: + CH3COO – + Н2О = NН4ОН + СН3СООН. В связи с тем, что константы диссоциации уксусной кислоты СН3СООН и гидроксида аммония NН4ОН примерно одинаковы, концентрации ионов водорода и гидроксид-ионов также примерно равны, и поэтому раствор ацетата натрия имеет примерно нейтральную среду, рН 7. Гидролиз соли (NH4)2S, диссоциирующей по уравнению (NH4)2S = 2 + S 2– , проходит по двум ступеням: + S 2– + Н2О = NH4ОН + НS – (1-я ступень), + НS – + Н2О = NH4ОН + Н2S (2-я ступень). В отличие от двух предыдущих вариантов гидролиза (соль образована сильной кислотой и слабым основанием или слабой кислотой и сильным основанием) в данном случае рН раствора не зависит от концентрации соли (но зависит от того, какой из одноименных ионов дополнительно введен в раствор). 4. Соль образована сильным основанием и сильной кислотой. Такая соль и ее ионы гидролизу не подвергаются. Примеры таких солей: хлорид натрия NaCl, сульфат натрия Na2SO4, нитрат натрия NaNO3. Растворы таких солей почти нейтральны, рН 7. Среда таких солей может быть слегка кислотной или слегка основной из-за других эффектов, связанных с поведением растворов сильных электролитов. Выражения константы гидролиза включают ионное произведение воды и константы диссоциации образующихся слабых электролитов. При повышении температуры ионное произведение воды в значительно большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований. В связи с этим константа гидролиза должна возрастать, показывая, что равновесие гидролиза смещается вправо, в сторону продуктов (гидролиз сопровождается поглощением теплоты, Н > 0). Нагреванием удается сместить равновесие гидролиза вправо. Часто смещение равновесия гидролиза вправо можно вызвать удалением продуктов реакции. При нагревании раствора сульфида аммония (NH4)2S растворимость аммиака NH3 и сероводорода H2S в воде понижается, они уходят из сферы реакции (в лабораторной практике гидролиз проходит в открытых системах), и равновесие гидролиза резко смещается вправо. Гидролиз, сопровождающийся удалением продуктов из зоны реакции (газ или осадок), часто условно называют необратимым гидролизом (не в термодинамическом смысле!). Сульфид алюминия Al2S3 в водном растворе существовать не может, получить его взаимодействием ионов алюминия и сульфид-ионов не удается. При сливании растворов хлорида алюминия и сульфида натрия выпадает осадок гидроксида алюминия Al(OH)3 и выделяется сероводород H2S. Сульфид алюминия можно получить реакцией между металлическим алюминием (опилки, порошок) и серой (порошок). Если полученное кристаллическое вещество Al2S3 поместить в воду, то протекает реакция гидролиза: При сливании растворов хлорида алюминия и сульфида натрия проходит реакция Примером необратимого гидролиза можно считать реакции карбидов кальция и алюминия с водой при получении ацетилена и метана соответственно: С практической и теоретической точек зрения важно обсудить вопрос о среде фосфатов натрия. Раствор фосфата натрия Na3PO4 (0,1М) имеет основную реакцию с рН 12, что объясняется гидролизом фосфат-иона: + Н2О = + ОН – . Раствор Na2HPO4 (0,1М) также имеет основную среду с рН 9,5, что объясняется одновременным протеканием двух процессов: 1) гидролиз иона: + Н2О = + ОН – ; 2) диссоциация иона как слабой кислоты: = Н + + . Количества ионов Н + и ОН – , образующихся по этим двум реакциям, примерно одинаковы, поэтому среда раствора близка к нейтральной. Раствор NaH2PO4 (0,1М) имеет кислотную среду раствора с рН 4,5, что объясняется преимущественной диссоциацией иона : = Н + +. Следовательно, при объяснении среды таких растворов, как по-разному замещенные фосфаты натрия, необходимо учитывать и гидролиз соли, и ее диссоциацию. Рассмотренный выше сокращенный молекульно-ионный способ написания уравнений гидролиза, например: Al 3+ + H2O = AlOH 2+ + H + , удобен для вычисления константы гидролиза, рН раствора и концентраций ионов. Однако в водном растворе все катионы гидратированы, причем связи шести ближайших молекул воды с катионом довольно прочные, уравнение реакции гидролиза правильнее записывать так: Координационное число иона алюминия, равное шести, в этом процессе сохраняется. Можно записать это уравнение по-другому, если ион гидроксония заменить на ион водорода: Это уравнение отражает не гидролиз, а диссоциацию комплексного иона [Al(H2O)6] 3+ как слабой кислоты. Этот пример ярко показывает, что одно и то же явление может быть объяснено по-разному, в зависимости от уровня наших знаний и целей описания. Напишите уравнения дальнейшей диссоциации иона [Al(H2O)6] 3+ , помня, что гидроксид алюминия Al(ОН)3 выпадает в осадок. Список новых и забытых понятий и слов Напишите уравнения электролитической диссоциации: а) гидроксида натрия; б) азотной кислоты; в) хлорида магния; г) карбоната калия; д) нитрата железа(iii). Ваш ответ решение вопроса Похожие вопросы Все категории экономические 43,401 гуманитарные 33,632 юридические 17,905 школьный раздел 607,977 разное 16,854 Популярное на сайте: Как быстро выучить стихотворение наизусть?Запоминание стихов является стандартным заданием во многих школах. Как научится читать по диагонали?Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте. Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так. Как научится говорить грамотно и правильно?Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Напишите уравнения электролитической диссоциации: а) гидроксида натрия; б) азотной кислоты; в) хлорида магния; г) карбоната калия; д) нитрата железа(iii).
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 🎦 Видео
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Написать уравнения реакций диссоциации следующих веществ : нитрат натрия, карбонат калия, гидроксид железа (III), сульфат алюминия ; хлорид бария, оксид цинка, фосфат калия, серная кислота, гидроксид ?
Написать уравнения реакций диссоциации следующих веществ : нитрат натрия, карбонат калия, гидроксид железа (III), сульфат алюминия ; хлорид бария, оксид цинка, фосфат калия, серная кислота, гидроксид бария.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Напишите формулы и определите силу электролитов :а?
Напишите формулы и определите силу электролитов :
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Написать уравнения диссоциации веществ : карбоната калия, гидроксида кальция, фосфата аммония, бромоводородной кислоты, угольной кислоты, силиката натрия, сульфита натрия?
Написать уравнения диссоциации веществ : карбоната калия, гидроксида кальция, фосфата аммония, бромоводородной кислоты, угольной кислоты, силиката натрия, сульфита натрия.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Составьте уравнения диссоциации следующих электролитов : иодид бария, серная кислота, гидроксид кальция?
Составьте уравнения диссоциации следующих электролитов : иодид бария, серная кислота, гидроксид кальция.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнения электралитической диссоциации веществ гидроксид натрия карбонат натрия сероводародная кислота гидроксид бария нитрат свинца?
Напишите уравнения электралитической диссоциации веществ гидроксид натрия карбонат натрия сероводародная кислота гидроксид бария нитрат свинца.
Видео:Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Составьте формулы следующих солей : нитрата бария, хлорида алюминия?
Составьте формулы следующих солей : нитрата бария, хлорида алюминия.
Карбоната натрия, фосфата калия.
Напишите уравнения диссоциации этих солей.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

СРОЧНО ПОМОГИТЕ С ХИМИЕЙ?
СРОЧНО ПОМОГИТЕ С ХИМИЕЙ!
Запишите уравнения диссоциации следующих электролитов : карбоната натрия, нитрата железа (3), гидроксид бария, азотной кислоты.
Видео:Угольная кислота. Соли угольной кислоты. Карбонаты. Гидрокарбонаты. Получение и свойстваСкачать

Срочно помогите с химией?
Срочно помогите с химией!
Запишите уравнения диссоциации следующих электролитов : карбоната натрия, нитрата железа(3), гидроксида бария, азотная кислоты.
Видео:Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Из данного перечня выберите сильные электролиты :А) уксусная кислота ;Б) нитрат натрия ;В) нитрат бария ;Г) сероводородная кислота ;Д) гидроксид бария ;Е) сульфид натрия ;Ж) угольная кислота ;З) карбо?
Из данного перечня выберите сильные электролиты :
А) уксусная кислота ;
Б) нитрат натрия ;
Г) сероводородная кислота ;
Д) гидроксид бария ;
Е) сульфид натрия ;
Ж) угольная кислота ;
З) карбонат калия.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота?
Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота.
На странице вопроса Составьте уравнения диссоциации следующих электролитов : нитрата цинка, карбоната натрия , угольной кислоты? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Видео:Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7/2004
Видео:Электролитическая диссоциация / Диссоциация кислотСкачать

§ 7.3. Соли. Гидролиз
2. Соль образована слабой кислотой и сильным основанием, например ацетат натрия NaCH3COO, карбонат натрия (сода) Na2CO3, нитрит натрия NaNO2, сульфит натрия Na2SO3, сульфид натрия Na2S, цианид натрия NaCN.
Карбонат натрия диссоциирует:
Na2CO3 = 2Na + + 
Гидролизу подвергается карбонат-ион. Гидролиз проходит в две ступени:



В водном растворе гидролиз по второй ступени не проходит – из раствора соды углекислый газ не выделяется. Чтобы гидролиз прошел по второй ступени, равновесие следует сместить вправо добавлением в раствор кислоты (ионов водорода). Образующаяся при этом неустойчивая угольная кислота распадается на углекислый газ и воду:
Обычно приводимое в учебниках химии уравнение реакции между карбонатом натрия и кислотой с образованием углекислого газа
представляет собой смещенную вправо реакцию гидролиза. Кроме того, это не реакция обмена, а реакция гидролиза, проходящая по второй ступени. Как реакция обмена она протекает при действии газообразного хлороводорода на кристаллический карбонат натрия.
Пример. Рассчитать рН 0,1М раствора карбоната натрия.
Будем считать, что гидролиз проходит только по первой ступени:


После преобразований константы гидролиза получаем:
В этом выражении Ккисл есть константа диссоциации иона 


Обратите внимание, что в расчете используется константа диссоциации кислоты H2CO3 по второй ступени!
Для угольной кислоты из справочных данных находим:
Н2СО3 =  + Н + + Н + | К1 = 4,31•10 –7 , |
 = =  + Н + + Н + | К2 = 5,61•10 –11 . |
Эти данные подставляем в формулу:
рОН = –lg 4,22•10 –3 = 2,4,
рН = 14 – рОН = 11,6.
При какой концентрации раствора гидроксида натрия в воде достигается то же значение рН? Рассчитайте. Можно дать приблизительный ответ.
А как быть, если вас попросят написать уравнение гидролиза кислой соли, например гидрокарбоната натрия NaHCO3? Если вы сразу же напишите уравнение диссоциации соли
NaHCO3 = Na + + 
то, очевидно, гидролизу подвергается ион 

Образование неустойчивой угольной кислоты приводит к тому, что уже при слабом нагревании начинается выделение из раствора углекислого газа (тесто с добавленным в него пекарским порошком «поднимается»).
По теории кислот и оснований И.Н.Брёнстеда кислотный ион может быть и кислотой, и основанием в зависимости от того, записано ли уравнение реакции гидролиза или уравнение взаимодействия с ионом водорода:
3. Соль образована слабым основанием и слабой кислотой, например ацетат аммония NH4CH3COO, гидрокарбонат аммония NH4HCO3, гидросульфит аммония NH4HSO3, нитрит аммония NH4NO2. Гидролиз такой соли рассмотрим на примере ацетата аммония, диссоциирующего в водном растворе по уравнению
NH4CH3COO = 
Оба иона этой соли образуют с водой слабые электролиты – гидроксид аммония и уксусную кислоту, поэтому реакцию гидролиза можно описать одним общим уравнением:

В связи с тем, что константы диссоциации уксусной кислоты СН3СООН и гидроксида аммония NН4ОН примерно одинаковы, концентрации ионов водорода и гидроксид-ионов также примерно равны, и поэтому раствор ацетата натрия имеет примерно нейтральную среду, рН 
Гидролиз соли (NH4)2S, диссоциирующей по уравнению
(NH4)2S = 2 
проходит по двум ступеням:


В отличие от двух предыдущих вариантов гидролиза (соль образована сильной кислотой и слабым основанием или слабой кислотой и сильным основанием) в данном случае рН раствора не зависит от концентрации соли (но зависит от того, какой из одноименных ионов дополнительно введен в раствор).
4. Соль образована сильным основанием и сильной кислотой. Такая соль и ее ионы гидролизу не подвергаются. Примеры таких солей: хлорид натрия NaCl, сульфат натрия Na2SO4,
нитрат натрия NaNO3.
Растворы таких солей почти нейтральны, рН 
Выражения константы гидролиза включают ионное произведение воды и константы диссоциации образующихся слабых электролитов. При повышении температуры ионное произведение воды в значительно большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований. В связи с этим константа гидролиза должна возрастать, показывая, что равновесие гидролиза смещается вправо, в сторону продуктов (гидролиз сопровождается поглощением теплоты, 
Часто смещение равновесия гидролиза вправо можно вызвать удалением продуктов реакции. При нагревании раствора сульфида аммония (NH4)2S растворимость аммиака NH3 и сероводорода H2S в воде понижается, они уходят из сферы реакции (в лабораторной практике гидролиз проходит в открытых системах), и равновесие гидролиза резко смещается вправо.
Гидролиз, сопровождающийся удалением продуктов из зоны реакции (газ или осадок), часто условно называют необратимым гидролизом (не в термодинамическом смысле!).
Сульфид алюминия Al2S3 в водном растворе существовать не может, получить его взаимодействием ионов алюминия и сульфид-ионов не удается. При сливании растворов хлорида алюминия и сульфида натрия выпадает осадок гидроксида алюминия Al(OH)3 и выделяется сероводород H2S. Сульфид алюминия можно получить реакцией между металлическим алюминием (опилки, порошок) и серой (порошок). Если полученное кристаллическое вещество Al2S3 поместить в воду, то протекает реакция гидролиза:
При сливании растворов хлорида алюминия и сульфида натрия проходит реакция
Примером необратимого гидролиза можно считать реакции карбидов кальция и алюминия с водой при получении ацетилена и метана соответственно:
С практической и теоретической точек зрения важно обсудить вопрос о среде фосфатов натрия. Раствор фосфата натрия Na3PO4 (0,1М) имеет основную реакцию с рН 


Раствор Na2HPO4 (0,1М) также имеет основную среду с рН 
1) гидролиз иона:


2) диссоциация иона 


Количества ионов Н + и ОН – , образующихся по этим двум реакциям, примерно одинаковы, поэтому среда раствора близка к нейтральной.
Раствор NaH2PO4 (0,1М) имеет кислотную среду раствора с рН 



Следовательно, при объяснении среды таких растворов, как по-разному замещенные фосфаты натрия, необходимо учитывать и гидролиз соли, и ее диссоциацию.
Рассмотренный выше сокращенный молекульно-ионный способ написания уравнений гидролиза, например:
Al 3+ + H2O = AlOH 2+ + H + ,
удобен для вычисления константы гидролиза, рН раствора и концентраций ионов. Однако в водном растворе все катионы гидратированы, причем связи шести ближайших молекул воды с катионом довольно прочные, уравнение реакции гидролиза правильнее записывать так:
Координационное число иона алюминия, равное шести, в этом процессе сохраняется. Можно записать это уравнение по-другому, если ион гидроксония заменить на ион водорода:
Это уравнение отражает не гидролиз, а диссоциацию комплексного иона [Al(H2O)6] 3+ как слабой кислоты.
Этот пример ярко показывает, что одно и то же явление может быть объяснено по-разному, в зависимости от уровня наших знаний и целей описания.
Напишите уравнения дальнейшей диссоциации иона [Al(H2O)6] 3+ , помня, что гидроксид алюминия Al(ОН)3 выпадает в осадок.
Список новых и забытых понятий и слов
Видео:Электролитическая диссоциация электролитов в водных растворах. Химия ЕГЭСкачать

Напишите уравнения электролитической диссоциации: а) гидроксида натрия; б) азотной кислоты; в) хлорида магния; г) карбоната калия; д) нитрата железа(iii).
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Ваш ответ
Видео:Тема 16. Химические свойства оснований, кислот, солей в свете теории электролитической диссоциацииСкачать

решение вопроса
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Похожие вопросы
- Все категории
- экономические 43,401
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,977
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
🎦 Видео
Электролитическая диссоциацияСкачать

Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

Механизм электролитической диссоциации. 9 класс.Скачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать