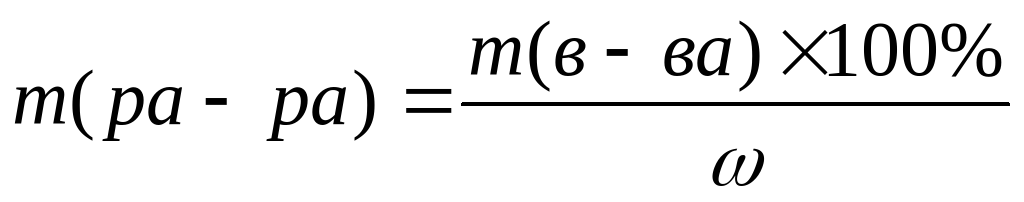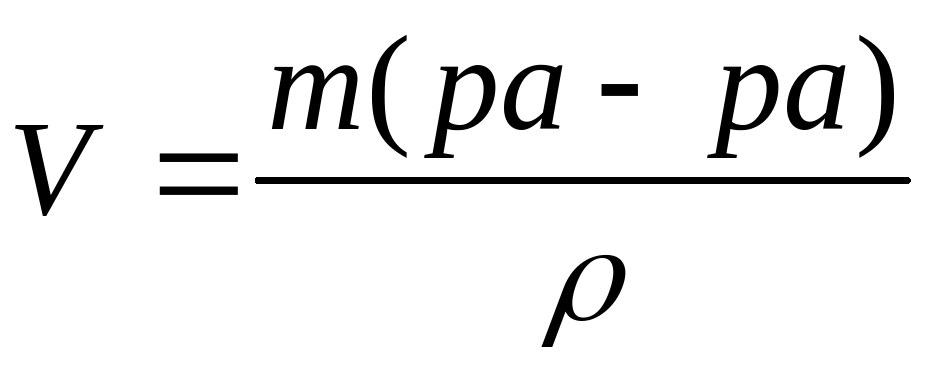По данной теме рассматриваем практически все типы задач на растворы.
Просмотр содержимого документа
«Решение задач на растворы.»
Задачи на растворы.
Задача №1.Смешали 200 г воды и 50 г гидроксида натрия. Определить массовую долю вещества в растворе.
Задача №2.Определить массу соли и объем дистиллированной воды, необходимых для получения 230г 12% поваренной раствора.
Задача №3. 180г 15%-ного раствора хлорида бария выпарили до массы раствора 145г. Какова стала процентная концентрация раствора?
Задача №4. Смешали 250г 30% и 150г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
Задача №5. Определите массу и концентрацию раствора, который нужно добавить к 13г 8% раствора, чтобы получить 40г 14% раствора.
Задача №6. Определить массу 10% раствора карбоната натрия, который нужно добавить к 1020г 2%-ного раствора, чтобы получить 3%-ный раствор.
Задача №7. Определить массу 7%-ного раствора соли, в котором необходимо растворить ещё 20г этой соли, чтобы получить 12 %-ный раствор.
Задача 1. Рассчитайте массы 10 и 50%-ных растворов гидроксида калия, необходимых для приготовления 400г 25%-ного раствора.
Задача 2. Определить массу 20%-ного раствора соли, который нужно добавить к 40г 10%-ного раствора той же соли, чтобы получить 17%-ный раствор.
Рассмотрим несколько способов решения задач на приготовление растворов.
Раствор состоит из двух частей: растворенного вещества и растворителя.
Чаще всего растворителем является вода. Массовая доля растворённого вещества зависит от содержания вещества в растворе и может быть выражена в процентах или долях.
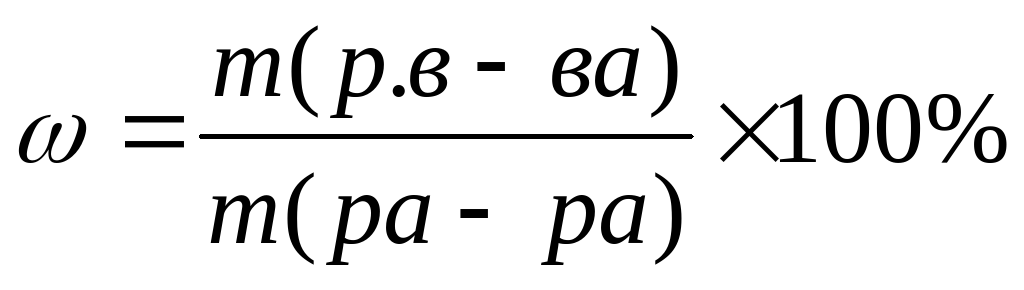
Первый способ последовательный.
Решается с оформлением данных и использованием формул.
1) 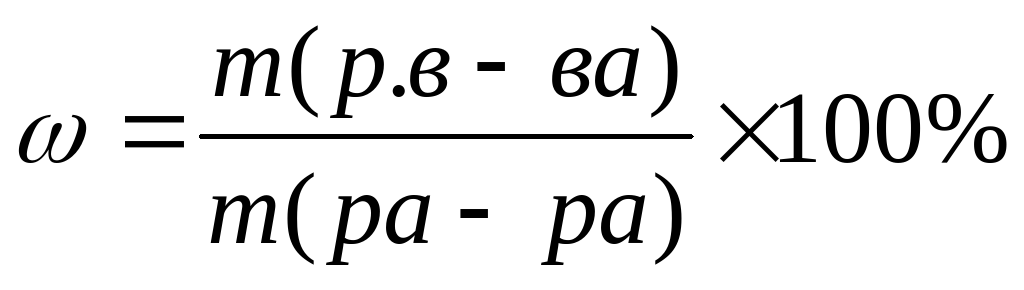
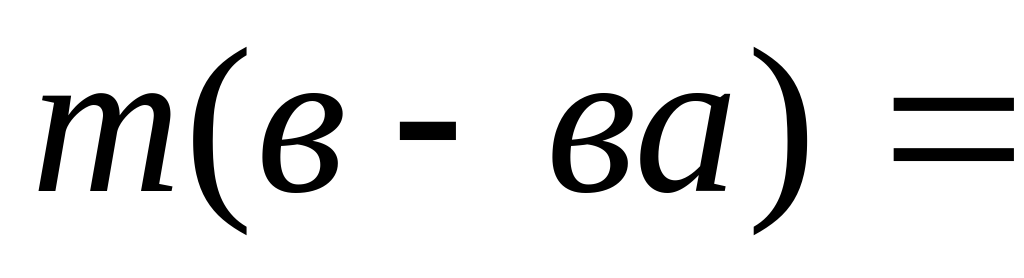

Если дается объем раствора, его надо пересчитать на массу. m(р-ра)= V×ρ.
Если надо рассчитать объем раствора, сначала рассчитывается масса, а затем объем.
Если не известна масса раствора, и масса вещества, но известна массовая доля, (например она = 20%),
тогда масса раствора выражается через X; m(р-ра) = X;====m(в-ва) = m(р-ра) × W в данном случае m (в-ва) = X× 0,2
Второй способ алгебраический.
Исходим из того, что массы веществ исходных растворов равны массе вещества конечного раствора. При этом масса вещества рассматривается как произведение массы раствора и массовой доли вещества в растворе. (W, удобнее выразить от единицы в долях).
m(р-ра)1×w+ m( р-ра)2×w =m(р-ра)3 ×w
Третий способ диагональный или метод креста.
В данном случае массовые доли располагаются следующим образом: слева сверху самая большая из приведённых в условии, под ней самая маленькая, в центре средняя, по диагонали вычитаем от большей массовой доли меньшую, записываем результат. Параллельно массовым долям на расстоянии от диагонали указываем соответствующие массы растворов.
НАПРИМЕР: в правой части диагонали получились три % отношения, мы выбираем наиболее удобное, так как при расчете любого отношения получим одинаковый результат. W берется в процентах.

Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Решение задач по теме «Растворы» (8 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Решение задач на растворы
При решении расчетных задач на растворы учащиеся часто сталкиваются с определенными трудностями в осмыслении текста задачи и выборе способа ее решения. Предлагаю графический метод, который позволяет школьникам перейти от абстрактных понятий «доля», «раствор», «растворенное вещество» к более наглядным и образным графическим объектам.
В самом начале договоримся о терминах и условных обозначениях (схема 1): прямоугольник – это некий «сосуд», в котором готовят раствор; часть раствора – это растворенное вещество. Над прямоугольником записываем массы объектов – то, что можно подержать в руках: масса раствора, масса воды, масса навески вещества и т.д. Под прямоугольником – массовая доля, масса вещества в растворе, абстрактные величины – ибо подержать в руках их нельзя; вычисляются по формуле:
m (в-ва) = 
где 
Попробуем решить графическим методом ряд задач. Начнем с тех, что попроще.
Рассчитайте массовую долю вещества в растворе, полученном при смешивании 200 г воды и 30 г вещества.

Складываем все массы над «сосудами», получаем массу раствора (знаменатель), складываем массы под «сосудами» (числитель) (схема 2).
И далее выполняем расчет:

Ответ. Массовая доля вещества
в растворе равна 13,04%.
Наглядно видно, что масса нового раствора складывается из масс всех «объектов», а масса растворенного вещества – из масс «абстрактного» вещества. Мы сложили все массы над прямоугольниками и все массы под прямоугольниками.
Теперь возьмем задачи посложней.
Какова массовая доля вещества в растворе, полученном при добавлении к 150 г 15%-го раствора серной кислоты 250 г воды?
Выполняем те же операции, что и в предыдущей задаче, находим числитель и знаменатель (cхема 3).
Расчет массовой доли:

Ответ. Массовая доля вещества в растворе равна 5,625%.
Какой будет массовая доля вещества в растворе, полученном при сливании 30 г 24%-го и 75 г 12%-го растворов серной кислоты?

Ответ. Массовая доля серной кислоты в растворе равна 15,43%.
Сколько надо добавить воды к 450 г 23%-го раствора сахара, чтобы получить 18%-й раствор?
Рассуждаем так (cхема 5): поскольку масса «абстрактного» вещества (вещества в растворе) не изменилась, мы можем найти массу полученного раствора:
1) m (р-ра2) = m (в-ва)/ 
Масса воды – разница масс полученного и исходного растворов (на схеме это ясно видно).
2) m (воды) = 575 – 450 = 125 г.
Ответ . Надо добавить 125 г воды.
К 225 г 12%-го раствора соли добавили еще 23 г этой же соли. Какова массовая доля соли в полученном растворе?
Напомню, массовая доля соли в соли равна 1 (cхема 6, см. с. 46 ).

Ответ . Массовая доля соли в растворе
равна 20,16%.
Из 560 г 30%-го раствора выпарили 120 г воды. Какова массовая доля вещества в полученном растворе?
Здесь следует обратить внимание на знак «минус» между прямоугольниками (так наглядно можно показать, что испарилась вода) и в действиях со значениями масс (cхема 7).

Ответ. Массовая доля вещества в растворе равна 38,18%.
Как видим, можно не только складывать массы веществ, но и вычитать их!
Теперь рассмотрим задачу на приготовление раствора из двух растворов с разными массовыми долями.
Из 20%-го и 5%-го растворов серной кислоты надо приготовить 300 г раствора с массовой долей серной кислоты, равной 12%. В каких пропорциях следует смешать исходные растворы?
Пусть масса первого раствора – x г, а второго – y г (cхема 8).
Получим систему из двух уравнений (первое уравнение написано над рисунками, второе – под рисунками – надо только приглядеться):
Ответ . Надо смешать 140 г 20%-го раствора
и 160 г 5%-го раствора.
Графический метод годится и для решения задач с кристаллогидратами. Правда, в этом случае необходимо провести предварительные расчеты массовой доли соли в кристаллогидрате.
20 г пентагидрата сульфата меди(II) растворили в 250 г воды. Какова массовая доля сульфата меди в полученном растворе?
CuSO4•5H2O – пентагидрат сульфата меди(II), или медный купорос. Найдем массовую долю соли в кристаллогидрате (схема 9).

(напомним, что массовая доля – всегда отношение массы части к массе целого).

Ответ. Массовая доля сульфата меди
в полученном растворе равна 4,7%.
Сколько граммов медного купороса надо растворить в воде, чтобы приготовить 200 г 5%-го раствора? Сколько воды потребуется?
Найдем массовую долю соли в кристаллогидрате (см. задачу 8): 
m (воды) = 200 – 15,625 = 184,375 г.
Ответ. Надо взять 15,625 г медного купороса
и 184,375 г воды.
Из 500 г 40%-го раствора сульфата железа(II) при охлаждении выпало 100 г его кристаллогидрата (кристаллизуется с семью молекулами воды). Какова массовая доля вещества в оставшемся растворе?
(См. схему 11 на с. 47.)
Рассчитаем массовую долю соли в кристаллогидрате:

Обратите внимание на знаки!

Ответ. Массовая доля вещества в
оставшемся растворе равна 36,25%.
Используя метод решения расчетных задач при помощи графических схем на уроках и на занятиях элективных курсов, я обнаружила, что учащиеся легко справляются с ними и успевают сделать гораздо больше задач (за то же время), чем учащиеся, решавшие традиционными способами.
В заключение предлагаю несколько задач для самостоятельного решения.
1. Требуется приготовить 1 кг 15%-го раствора аммиака. Сколько нужно взять для этого концентрированного 25%-го раствора и воды?
2. К 80 г раствора соли неизвестной концентрации прибавили 40 г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления она стала равной 18%.
3. Из 400 г 20%-го раствора соли упариванием удалили 100 г воды. Чему стала равна массовая доля соли в полученном растворе?
4. В результате упаривания 450 г 10%-го раствора хлорида кальция его массовая доля увеличилась вдвое. Вычислите массу испарившейся воды.
5. Имеются два раствора аммиака с массовой долей 25% и 5%. Сколько граммов каждого раствора надо взять, чтобы получить 125 г 10%-го раствора аммиака?
6. Сколько воды и английской соли (гептагидрат сульфата магния) надо взять, чтобы приготовить 440 г раствора сульфата магния с массовой долей 8%?
7. Какую массу английской соли (гептагидрат сульфата магния) надо добавить к 225 г 12%-го раствора сульфата магния, чтобы получить 30%-й раствор?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Выполнение заданий высокого уровня сложности
При обучении школьников способам решения задач очень большое значение придаю применению алгоритмов. Я считаю, что вначале нужно уверенно овладеть небольшим числом стандартных приемов, получить представление о возможных типах задач. Это позволит ученику выйти на творческий уровень в своем дальнейшем химическом образовании и самообразовании.
Одно из заданий высокого уровня сложности (оно входит в третью часть экзаменационной работы – задание С4) проверяет умение производить расчеты по уравнениям реакций, происходящих в растворах.
В учебной литературе недостаточно подробно объясняются особенности решения таких задач. Поэтому мы с учениками вначале разбираем все моменты, на которые нужно обратить внимание, записываем алгоритмы в общем виде, рассматриваем решение задач каждого типа, затем отрабатываем умения на самостоятельном решении целого ряда подобных задач.
Прежде всего ученик должен усвоить понятие о массовой доле растворенного вещества, или, иначе, процентной концентрации раствора. Эта величина показывает отношение массы растворенного вещества к массе раствора:

mр.в-во = mр-р•
mр-р = mр.в-во / 
Если в условии задачи указан объем раствора с определенной плотностью, то прежде всего находят массу раствора:
mр-р = Vр-р•
затем – массу растворенного вещества:
mр.в-во = mр-р•
Количество вещества находят по массе растворенного вещества:

Рассмотрим некоторые типы задач с расчетами по уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в растворе после реакции.
При решении таких задач прежде всего нужно найти количества вещества реагентов. Если задача на избыток и недостаток, то количества вещества продуктов реакции находят по веществу, которое дано в недостатке.
Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора, mр-р получ). Если какое-либо вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы вычитают массу вещества, ушедшего из раствора в виде осадка или газа:
При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворенном виде не только продукт реакции, но и вещество, которое было дано в избытке.
Чтобы найти количество вещества, которое не прореагировало – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:



Затем найти его массу и массовую долю в растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл 12%-го раствора серной кислоты (


 р.в-во(MgSO4 ).
р.в-во(MgSO4 ).
mр-р(H2SO4) = Vр-р• 
mр.в-во(H2SO4) = mр-р•

В недостатке – Mg. Следовательно:


mр.в-во(MgSO4) = M• 
m(H2) = M• 

О т в е т. 
Задача 2. Смешали 250 г раствора сульфата железа(III) с концентрацией 8 % и 50 г раствора гидроксида натрия с концентрацией 30 %. Найти концентрацию веществ в получившемся растворе.


 р.в-во получ.
р.в-во получ.mр.в-во(Fe2(SO4)3) = mр-р•

mр.в-во(NaOH) = mр-р•







m(NaOH) = M• 
m(Na2SO4) = M• 
m(Fe(OH)3) = M• 


О т в е т. 

Задача 3. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (
О т в е т. 
Задача 4. 5,6 г железа растворили в 100 мл 10%-го раствора соляной кислоты (
О т в е т. 
Задача 5. 5,6 г железа растворили в 200 мл раствора соляной кислоты (
О т в е т. 
Задача 6. Смешали 110,4 г раствора карбоната калия с концентрацией 25 % и 111 г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
О т в е т. 
Задача 7. Смешали 320 г раствора сульфата меди(II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
О т в е т. 

• Более сложными являются задачи на нахождение массы (или объема) вещества, которое нужно добавить к раствору другого вещества для того, чтобы его концентрация изменилась в результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество добавленного вещества – реагента;
2) выразить через х количества прореагировавшего с реагентом вещества и полученного в результате реакции газа или осадка;
3) найти количество растворенного вещества в исходном растворе и его количество, оставшееся после реакции (


4) выразить через х массу оставшегося в растворе вещества;
5) найти массу раствора, полученного после реакции:
6) все данные подставить в формулу:

7) найти количество вещества реагента, его массу или объем.
Задача 8. Найти массу карбоната кальция, которую следует добавить к 600 г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5 %.





m(CaCO3) = M• 
mр.в-во1(HNO3) = mр-р1•




mоставш(HNO3) = М• 

0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, 
m(CaCO3) = M• 
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O, которую необходимо добавить к 47 мл 25%-го раствора карбоната натрия (



Найти: m(CaCl2•6H2O).




m(CaCl2•6H2O) = M• 
m(CaCO3) = M• 
mр-р1(Na2CO3) = Vр-р1•
mр.в-во1(Na2CO3) = mр-р1•




mоставш(Na2CO3) = M• 
219x + 50,76 – 100x = 50,76 + 119x,

0,1 = 12,69 – 106х / 50,76 + 119х,
m(CaCl2•6H2O) = М• 
Задача 10. Какой объем 30%-го раствора аммиака (

Задача 11. Какой объем углекислого газа нужно добавить к 100 мл 20%-го раствора гидроксида натрия (
Задача 12. Найти объем раствора соляной кислоты (
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество – реагент!
При решении задач на растворы нужно помнить о том, что при обычных условиях с водой реагируют следующие вещества:
1) щелочные и щелочно-земельные металлы, например:
2Na + 2H2O = 2NaOH + H2
2) оксиды щелочных и щелочно-земельных металлов, например:
3) оксиды неметаллов, например:
4) многие бинарные соединения – гидриды, карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет продукт взаимодействия вещества-реагента с водой. Масса раствора будет складываться из массы реагента и массы воды:
Если в результате реакции выделился газ, то
Задача 13. В каком объеме воды нужно растворить 11,2 л оксида серы(IV), чтобы получить раствор сернистой кислоты с массовой долей 1 %?



mр.в-во(H2SO3) = M• 
mр-р(H2SO3) = mр.в-во(H2SO3) / 
m(SO2) = M• 
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ 
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса вещества-реагента, необходимого для образования раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за х моль;
2) согласно уравнению реакции выразить через х количества продуктов реакции;
3) найти через х массы реагента и продуктов реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета массовой доли вещества в растворе:

Задача 14. Найти массу гидрида лития, которую нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида лития 5 %.

Пусть 
тогда 

m(LiH) = M• 
m(LiOH) = M• 
m(H2) = M• 
m(H2O) = V• 

х = 0,21, 
m(LiH) = M• 
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует с водой, которая присутствует в растворе. Масса растворенного вещества во втором растворе складывается из массы вещества в первом растворе и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•

Задача 15. К 200 г 10%-го раствора ортофосфорной кислоты добавили 28,4 г фосфорного ангидрида. Найти массовую долю кислоты в получившемся растворе.

m(P2O5) = 28,4 г.
 р.в-во2(Н3РО4).
р.в-во2(Н3РО4).

mпрод(Н3РО4) = М• 
mр.в-во1(Н3РО4) = mр-р1•

О т в е т: 
Задача 16. Найти массу фосфорного ангидрида, которую необходимо добавить к 70 г 10%-го раствора ортофосфорной кислоты, чтобы получить 40%-й раствор.


Пусть 
тогда 
mпрод(Н3РО4) = М• 
mреаг(Р2О5) = М• 
mр.в-во1(Н3РО4) = mр-р1•

х = 0,15, 
m(P2O5) = M• 
Задача 17. В 240 мл воды опустили 69 г натрия. Найти массовую долю продукта в растворе.
О т в е т. 
Задача 18. Найти массовую долю кислоты в растворе, полученном при растворении 33,6 л сернистого газа в 320 г 5%-го раствора сернистой кислоты.
О т в е т. 
Задача 19. Какую массу оксида серы(VI) нужно растворить в 150 мл воды, чтобы получить 60%-й раствор серной кислоты?
Задача 20. Найти массу оксида серы(VI), которую необходимо растворить в 99 г 40%-й серной кислоты, чтобы получить 80%-й раствор.
Задача 21. Какую массу оксида фосфора(V) нужно растворить в 120 г воды, чтобы получить 40%-й раствор ортофосфорной кислоты?
Задача 22. К 180 г 50%-го раствора ортофосфорной кислоты добавили 42,6 г оксида фосфора(V). Найти массовую долю кислоты в полученном растворе.
О т в е т. 
Задача 23. В 20 г воды растворили 3,5 г оксида натрия. Вычислите массовую долю растворенного вещества.
О т в е т. 
Задача 24. К 120 г 8%-го раствора гидроксида натрия добавили 18,6 г оксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
О т в е т. 
Задача 25. Найти массу оксида серы(VI), которую нужно добавить к 2 л 8%-го раствора серной кислоты (
Задача 26. Какую массу фосфора необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 1000 г раствора ортофосфорной кислоты с массовой долей 50 %, получить раствор этой кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо растворить в 120 мл воды для получения раствора щелочи с массовой долей 18 %?
💡 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Растворы. 8 класс.Скачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

3. Задачи на растворы. Подготовка к олимпиадам 8-9 класс.Скачать

8 класс Химия Решение задач. Массовая доля вещества в растворе.Скачать

Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Молярная масса. 8 класс.Скачать

Решение задач по теме "Растворы" | Химия, онлайн-форумСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать