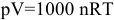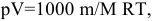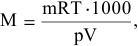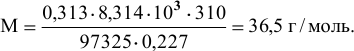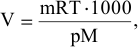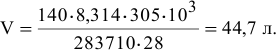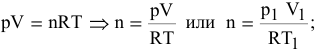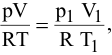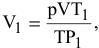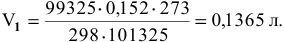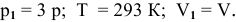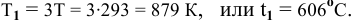Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
ТЕМА: Решение задач по теме «Уравнение состояния идеального газа»
Учебная: Диагностика степени усвоения знаний по теме «Уравнение состояния идеального газа» и формирование практических умений по их применению .
Развивающая: Развивать интерес к физике, развивать практические умения учащихся при решении задач.
Воспитательная : воспитывать сознательное отношение к учебе и заинтересованность в изучении физики.
Тип урока: урок комплексного применения знаний
I. Организационно — мотивационный этап
1) Организация начала урока
2) Проверка домашнего задания
II. Организационно — мотивационный этап
3) Актуализация имеющихся знаний.
4) Закрепление знаний и способов действия
6) Первоначальная проверка понимания
III. Рефлексийна — заключальны этап
7) Подведение итогов занятия. Выставление оценок
8) Домашнее задание
I. Организационно — мотивационный этап
1) Организация начала урока
Приветствие учащихся и учителя. Проверить подготовленность учащихся к уроку, правильную организацию рабочего места. Отметить отсутствующих в журнале.
2) Проверка домашнего задания
Фронтальная проверка выполнения домашнего задания. Обсуждения результатов выполнения
II. Операционно — познавательный этап.
3) Актуализация имеющихся знаний.
А) Фронтальный опрос
— Перечислите макроскопические параметры состояния идеального газа ( Р,V,Т)
— Какое уравнение называют уравнением состояния? (Уравнение, выражающее связь между макроскопическими параметрами состояния вещества)
-В чем заключается основная задача МКТ? ( Установление связи между макроскопическими параметрами, т.е. нахождение уравнения состояния того или иного тела)
-Сформулировать и доказать закон Дальтона (Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов, p=p1 +…рn )
-Записать уравнение Клапейрона. При каких условиях оно справедливо? (PVT=P0V0\T0, m=const, M=const)
— Записать уравнение Менделеева — Клапейрона.
4) Закрепление знаний и способов действия
Задачи решаются на доске:
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
Дано: V = 20 л, р = 830 кПа, t = 17 ° C , М = 2·10-3 кг/моль, R = 8,31 Дж/(моль·К).
Решение 
Ответ: m = 1,38·10 -2 кг.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
Дано: V — const , р1 = 40 МПа, t 1 = 27 °С, t 2 = -33 °С, m 2 = 2/5 m 1
Решение
Ответ: р2 = 12,8 Па.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
6) Первоначальная проверка понимания
Задачи решаются самостоятельно учениками
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
Р е ш е н и е. Согласно уравнению Менделеева—Клапейрона 

2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?

III. Рефлексийно – заключительный этап
7) Подведение итогов занятия. Выставление оценок
8) Домашнее задание упр.3(5-7). Подготовится к проверочной работе
9) Рефлексия: Ребята высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске: Сегодня я узнал… Было интересно… Было трудно… Я понял, что…
Решение задач по теме «Уравнение состояния идеального газа»
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?
Решение задач по теме «Уравнение состояния идеального газа»
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?
Видео:Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Задачи с решениями на расчеты по уравнению состояния идеальных газов
Расчеты по уравнению состояния идеальных газов
Во всех расчетах используется уравнение Клапейрона-Менделеева:
если объем измеряется в литрах, давление — в паскалях, масса — в граммах, молярная масса — в граммах на моль, температура — в кельвинах и R = 8,314 Дж/(моль*К).
Пример 24
Масса 227 мл газа, взятого при температуре 37°С и при давлении 730 мм рт.ст., равна 0,313 г. Определить молярную массу этого газа.
Решение:
где р = 97325 Па; V = 0,227 л; Т = 310К.
Пример 25
Определить объем, занимаемый 140 г азота при температуре 32°С и при давлении 2,8 атм.
Решение:
где 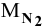
Пример 26
Определенное количество газа занимает объем 152 мл при давлении 745 мм рт.ст. и температуре 25°С. Найти объем того же количества газа при нормальных условиях 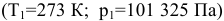
Решение:
где 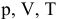
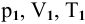
где р = 99 325 Па; Т = 298 К; V = 0,152 л;
Пример 27
В закрытом металлическом сосуде находится газ при температуре 20°С. До какой температуры необходимо нагреть этот газ, чтобы увеличить его давление в 3 раза?
Решение:
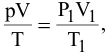
где
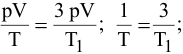
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Решение задач на основное уравнение МКТ идеального газа | Физика 10 класс #29 | ИнфоурокСкачать

Задачи на уравнение идеальных газов
1. Задача — приведение объёма газа к н.у.
Какой объём при н.у. займут 0,4*10 -3 м 3 газа, находящегося при 50°С и давлении 0,954*105 Па?
Решение задачи. Используем формулу: 

Т = 50°С + 273 = 323°К; 
2. Задача — Расчёт относительной плотности газа по другому газу.
Вычислить плотность этана С2Н6 по водороду и воздуху.
Решение задачи. Используем формулу:
3. Задача — расчёты с применением уравнения состояния идеального газа.
Определить молярную массу газа, если его масса при 13°С и давлении 1,04*10 2 кПа равна 0,828*10 -3 кг, а объём равен 0,327*10 -3 м 3 .
Решение. Используем формулу:
Универсальная газовая постоянная (R) равна 8,3 кДж/кмоль*К ; Т = 13°С + 273 = 286°К;

4. Задача — определение объёма газа при н.у.
Рассчитать объём (н.у.) фосгена COCl2 массой 3*10 -3 кг.
Решение: Используем формулу: 
М (фосгена) = 98,92 г/моль или 98,92 кг/кмоль

5. Задача — расчёты с использованием числа Авогадро (NA).
Рассчитать массу молекулы газа, если масса газа объёмом 10 -3 м 3 (н.у.) равна 0,1785*10 -3 кг.
Решение. Используем формулу и значение NA = 6,02*10 26 кмоль -1 . Для нахождения массы одной молекулы необходимо знать число молекул газа (N) в данной массе газа:
® 
6. Задачи — Расчёты с использованием газовых смесей.
Задача. В сосуде объёмом 0,05 м 3 смешали 0,02 м 3 этилена С2Н4 при исходном давлении 83,950 кПа и 0,015 м 3 метана СН4 при исходном давлении 95,940 кПа. Рассчитать давление газовой смеси.
Решение. Используем формулы
Р = РС2Н4 + РСН4; РС2Н4 = 
РСН4 = 
Р = 33,580 + 28,782 = 62,362 кПа.
Задача. В баллоне объёмом 10 -2 м 3 при 18°С находится 14*10 -3 кг кислорода и 12*10 -3 кг аммиака. Определить парциальные давления газов в смеси.
Решение. Используем формулу
Т = 18°С + 273 = 291°К.


Задача. В сухом воздухе объёмные доли газов (j) равны соответственно: азота (N2) 78,09%; кислорода (О2) 20,95%; аргона (Ar) 0,93%; углекислого газа (CO2) 0,03%. Вычислить парциальные давления этих газов, если давление смеси газов равно 101,325 кПа.
Решение. Используем формулу:

РN2 = j * Р = 0,7809 * 101,325 = 79,125 кПа;
РО2 = j * Р = 0,2095 * 101,325 = 212,28 кПа;
РAr = j * Р = 0,0093 * 101,325 = 0,942 кПа;
РCO2 = 0,0003 * 101,325 = 0,03 кПа.
Задача. Водород объёмом 0,2 * 10 -3 м 3 собран над водой при 33°С и давлении 96 кПа. Давление (упругость) насыщенного водяного пара при 33°С равно 5,21 кПа. Определить объём сухого водорода при н.у.
Решение задачи. Находим давление сухого водорода по формуле:
Р сухого газа = Р влажного газа – Р водяного пара;
Р сухого водорода = 96 – 5,21 = 90,79 кПа; Т°К = 33°С + 273 = 306.
Используем формулу 


💡 Видео
Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнение состояния идеального газа. 10 класс.Скачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Решение графических задач на тему Газовые законыСкачать

Физика 10 Идеальный газ Основное уравнение МКТ идеального газа Решение задачСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

Эта тема ВСЕГДА встречается на экзамене ЦТ — Изопроцессы (Физика для чайников)Скачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Тема 5. Уравнение состояния идеального газа. Давление смеси газов. Решение задач по темеСкачать

график идеальный газСкачать

Физика, 11-й класс, Решение задач на применение уравнения состояния идеального газаСкачать

Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать