О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
- Диссоциация
- Разложение
- Взаимодействие кислот с металлами
- Таблица: химические свойства кислот-окислителей
- Взаимодействие кислот с основаниями
- Взаимодействие кислот с солями
- Взаимодействие кислот с основными и амфотерными оксидами
- Восстановительные свойства бескислородных кислот
- Способность окрашивать индикаторы
- Вопросы для самоконтроля
- Взаимодействие кислот с оксидами металлов
- Все химические реакции, которые необходимы для успешной сдачи ОГЭ
- Правило 9. Химические свойства оксидов
- Взаимодействие оксидов с водой
- Взаимодействие оксидов друг с другом
- Взаимодействие оксидов с кислотами
- Взаимодействие оксидов с основаниями
- Взаимодействие оксидов с солями
- Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
- 📽️ Видео
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Видео:Взаимодействие металлов с соляной кислотойСкачать

Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Видео:Взаимодействие оксидов металлов с кислотамиСкачать

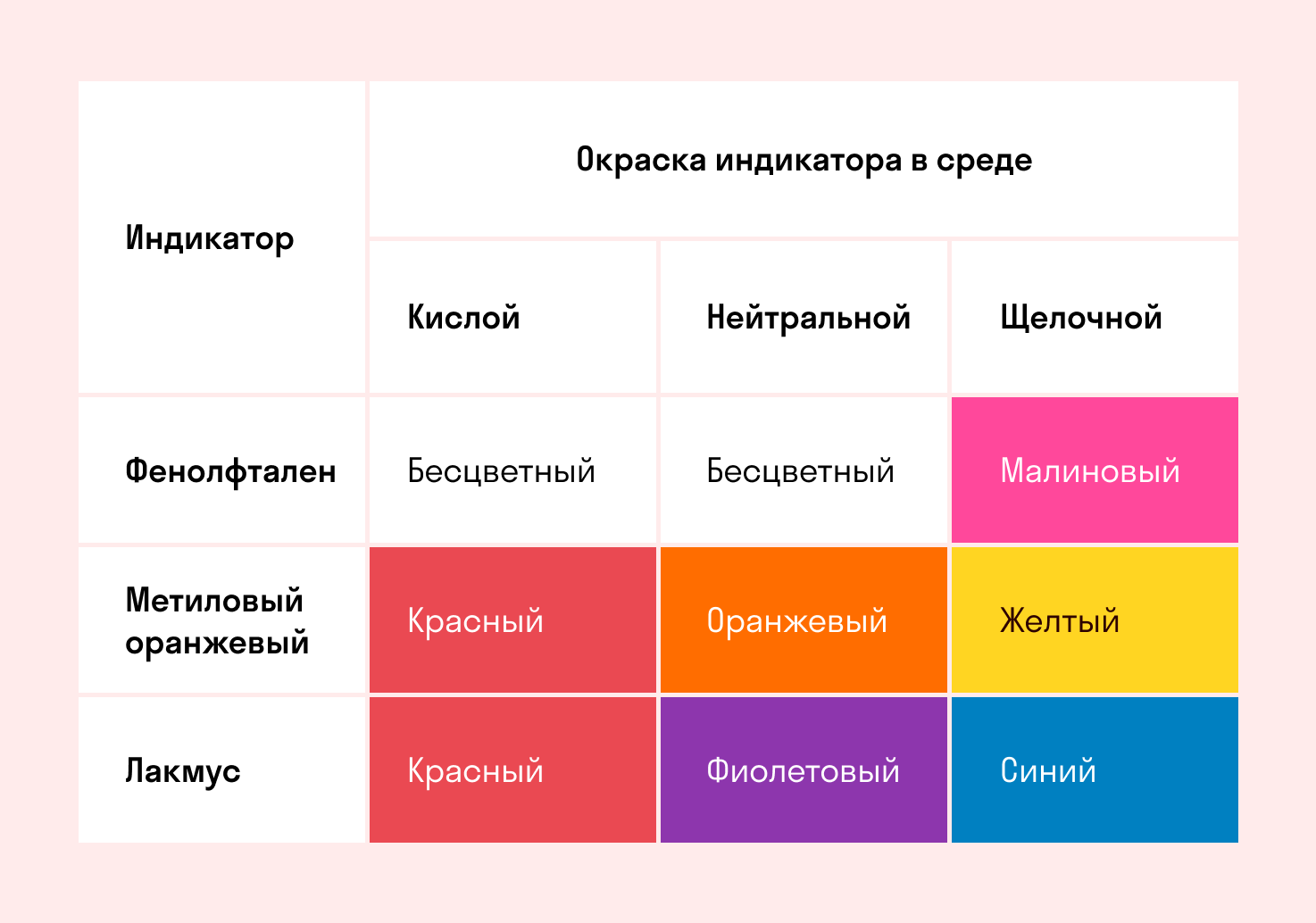
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Видео:Задание №8 в ЕГЭ по химии | Саша Сильвер | ЕГЭ 2024 | SMITUPСкачать

Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Взаимодействие кислот с оксидами металлов
Разделы: Химия
Цель урока:
- Знакомство учащихся еще с одним свойством кислот — взаимодействие их с оксидами металлов:
а) значение реакции обмена между кислотами и оксидами
б) очистка поверхности металла от ржавчины - Проверить и закрепить полученные знания и умения:
а) типы химических реакций
б) свойства кислот - Обобщение полученных знаний.
- Закрепление знаний учащихся .
- Подготовка к практической работе.
Методы работы:
Беседа. Демонстрация опыта: взаимодействие серной кислоты с оксидом меди(II) . Лабораторные опыты. Взаимодействие соляной кислоты с оксидом магния. Демонстрация опыта. Пропускание оксида углерода (IV) через раствор серной кислоты. Обобщение и наблюдение.
- Какие известные вам кислоты?
- Сравните свойства серной и соляной кислот.
- Какое правило нужно соблюдать при использовании серной кислоты в воде?
- Назовите общие свойства кислот. Ответ поясните примерами.
- Перед вами две кислоты:
а) обратите внимание на их признаки;
б) по этим признакам назовите каждую;
в) запишите их формулы. - Приводятся формулы различных веществ:
а) выпишите из них формулы кислот и назовите их.
б) подчеркните формулы бескислородных кислот: Cu (OH)₂‚ HCl‚ CO₂‚ P₂O₅‚ H₃PO₄‚ KOH‚ H₂SO₄‚H₂S‚ Al₂O₃‚ H₂SO₃‚ CuSO₄‚ HNO₃.
в) определите валентность кислотных остатков. - Пойдут ли реакции:
а) между медью и соляной кислотой;
б) между цинком и соляной кислотой;
в) между железом и разбавленной серной кислотой?
Какой этот тип химической реакции? - Какие известны еще типы химических реакции? Приведите примеры.
Урок начинается с постановки «проблем».
- Взаимодействуют ли кислоты с оксидами металлов, неметаллов?
- Как получить соль металла, не вытесняющего водород из кислоты? Объяснить на примере получения сульфата меди (II).
Решаем первый вопрос: будут ли реагировать кислоты с оксидами металлов? Демонстрация опыта. Взаимодействие оксида меди с серной кислотой.
Показать оксид меди, серную кислоту и предложить учащимся описать их свойства. Затем учитель наливает в стакан объемом 150-200мл. 20-25мл. серной кислоты(1:5), высыпает ложку оксида меди (II), перемешивает. Происходят ли какие изменения? Заметных изменений нет. Нагреваем. Что наблюдаем?
Раствор становится голубым, черный порошок на дне стакана растворился. Добавляем еще немного оксида и перемешиваем до полного его растворения. Добавление оксида меди прекращаем до того, когда новая порция не остается на дне стакана не растворившейся. И только тогда приливаем немного воды.
Что представляет собой раствор голубого цвета? Как выделить образовавшееся вещество из раствора?
- Показать фильтрование горячего раствора:
а) приготовление фильтра.
б) правила фильтрования. - Выпаривание филтрата в фарфоровой чашке.
Обратить внимание на некоторые трудности выпаривания – соль разлетается, чтобы этого избежать, нужно особенно подчеркивать, что раствор надо перемешивать и выпаривать только до появления первых кристаллов, а не досуха.
На доске записываем уравнение реакции:
CuO+H₂SO₄= CuSO₄ + H₂O
Можно ли отнести эту реакцию к одному из известных вам типов?
Атомы меди и водорода поменялись местами. Это реакция обмена. Реакцией обмена называются реакции между двумя сложными веществами, при которых они обмениваются своими составными частями.
Вывод учащихся: при взаимодействии серной кислоты с оксидом меди, получается соль и вода.
Могут ли другие кислоты реагировать с оксидами?
Учащиеся выполняют лабораторные опыты:
- Взаимодействие соляной кислоты с оксидом железа (III).(оксид железа должен быть в виде буро-красного порошка. Темно-серая кристаллическая модификация почти не растворятся в кислотах).
- Взаимодействие оксида магния с соляной кислотой.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Правило 9. Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Основание | |
| Амфотерный оксид + H2O → реакция не идет | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |