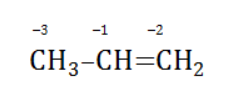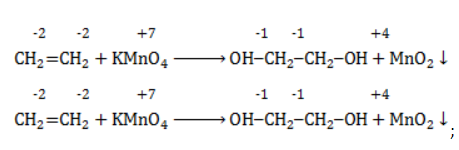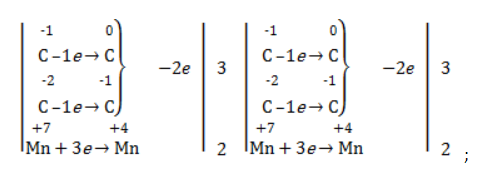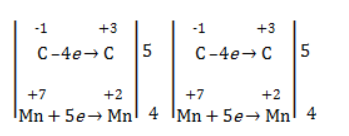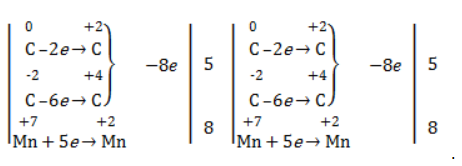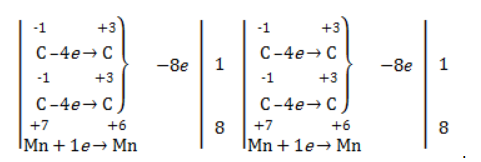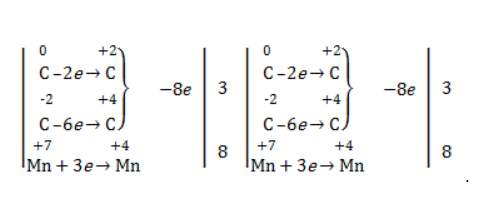| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
5 С 4 H8+ 10KMnO4 + 15H2SO4 à 5CO2 + 5C3H6O2 + 10MnSO4+ 5 K2SO4 + 20H2O
Рассмотрим окисление бутена -2 перманганатом калия в щелочной среде.
Щелочное окисление алкенов протекает также энергично, как и при кислотном их окислении, расщепляя не только π-, но и σ- связи, образуя соли карбоновых кислот. Степень окисления марганца, как окислителя, понижается до +6, образуя соль манганат калия
 |
СН 3 — CH = CH–CH3 +KMnO4 + КОН à CH3–COO К + K2MnO4+ H2O
Запишем уравнение реакции в молекулярной форме, расставим степень окисления у окислителя и восстановителя (можно у каждого элемента) и подберём коэффициенты методом электронного баланса:
С4-2 H 8 + KMn +7 O 4 + КОН à C 2 0 H 3 O 2 К + K 2 Mn +6 O 4 + H 2 O
Составим электронный баланс:
 |  |
восстановитель 4С -2 -8 e à 4 C 0 8 1
окислитель Mn +7 + 1 e à Mn +6 1 8
4 C -2 + 8 Mn +7 à 4 C 0 + 8 Mn +6
Запишем уравнение реакции с учётом коэффициентов:
С4 H 8 + 8 KMnO 4 + 10 КОН à 2 C 2 H 3 O 2 К + 8 K 2 MnO 4 + 6 H 2 O
Запишем уравнение реакции в ионной форме и подберём коэффициенты методом электронного- ионного баланса:
С 4 H80 + K+ + MnO4- + K+ + OH — à C2H3O2- + K+ + 2K++ MnO42- + H2O0


Окислитель MnO 4 — +1 e à MnO 4 2- 1 8
С 4 H80 + 10 OH — +8 MnO4- à 2C2H3O2- +6H2O0 + 8MnO42-
Добавим противоположные ионы: к перманганат — иону — катионы калия, к гидроксианионам – катионы калия, ацетат — иону – ионы калия, к манганат-иону — катионы калия
С4 H 8 0 + +8 MnO 4 — + 10 О H — à 2 C 2 H 3 O 2 — + 6 H 2 O 0 +8 MnO 4 2-
8 K + + 10 К+ à 2К+ 16 K +
Запишем уравнение реакции с учётом коэффициентов:
С4 H 8 + 8 KMnO 4 + 10 КОН à 2 C 2 H 3 O 2 К + 8 K 2 MnO 4 + 6 H 2 O
Задания с решениями.
Решение заданий части С1 ЕГЭ 2009 года
С1. Задание. Используя метод электронного баланса, составьте уравнение реакции:
определите окислитель и восстановитель.
1) Определим степень окисления у каждого элемента в веществах
H 2 + S -2 + Cl 2 0 +… à … + H + Cl –
2) Сера в сероводороде является восстановителем, следовательно, степень окисления у восстановителя должна повыситься до максимальной +6, так как окислитель хлор сильный; у хлора, как окислителя степень окисления должна понизиться до -1, что имеем в продуктах реакции ( H + Cl – )
3) Реагирующее вещество сероводород – кислота, следовательно, в продуктах реакции должна быть кислота, где степень окисления +6,- это серная кислота.

Восстановитель: S -2 -8 e à S +6 1
Окислитель : Cl20 +2e à 2Cl — 4
S -2 + 4 Cl 2 0 à S +6 + 8 Cl —
Или электронно — ионный баланс:

Окислитель : Cl20 +2e à 2Cl — 4
S2- + 4Cl20 + 4H2O à 8Cl- + 8H++ SO42-
(Добавляем противоионы: к сульфид-иону – 2 катионы водорода, к сульфат — иону — 2 катионы водорода)
5) Записываем уравнение реакции с учётом коэффициентов:
H 2 S + 4 Cl 2 + 4 H 2 O à H 2 SO 4 + 8 HCl
Окислительные свойства пероксида водорода.
2. Нейтральная среда.
1. 2 KI + H 2 O 2 à I 2 + 2 KOH
H2O2 + 2 ē à 2OH — 1
2I — + H2O2 à I2+ 2OH —
Практическая часть. Задания ЕГЭ — 2007 г.
1) Обе частицы содержат атом азота в одинаковой степени окисления:
10) С12 + КОН t à
11) Н2 O 2 + АиС1з +. à Аи+.
12) К I + КМп O 4 + Н2 SO 4 à М nSO4 + .
13) КМ nO 4 + . + КОН à К2Мп O 4 + К NO3 +.
14) Н2 SO 4 + FeS2 à
15) Н NO 2 + Н I à N О + I 2 +.
16) Н NO 2 + С12 +. à Н NO 3 + НС lO4
17) К NO2 + FeSO4 + Н 2 SO4 à NO + F е 2 (SO4)3 + К 2 SO4 + .
18) NaNO 2 + КМп O 4 + . à N а N Оз + М nSO 4 + К2 SO 4
Окисление органических веществ.
1 . A лкенов.
1) СН2=СН2 + КМп O 4 + Н2 O à . + СН2 O Н-СН2 O Н + .
2) СН2 = СН2 + КМп O 4 + Н2 SO 4 à С O 2 +. + . + Н2 O
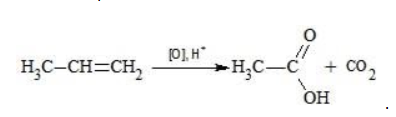
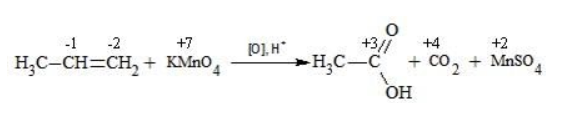
3) Н3С — СН = СН2 + КМп O 4 + ….. à К2 SO 4 +. + С O 2 + . + СН3СООН
1) НС≡ СН + КМ nO 4 + Н2 O à . + КОН + НООС-СООН
2) CH3 — C≡CH + КМ nO4 +….. à CH3COOK + K2CO3 + ….+….
1) СНз — СН2ОН + КМп O 4 à М nO 2 + КОН + СН3 СОН + ….
2) СН3ОН + КМп O 4 + Н2 SO 4 à H СНО + . + Мп S 04 +.
1) С6Н12 O 6 + КМп O 4 + Н2 SO 4 à С O 2 +. + Н2О +.
5.Аренов.
1) С7Н8 + КМп O 4 + Н2 SO 4 à С7Н6 O 2 +. + Н2 O +.
2) С8Н10 + К2Мп O 4 + Н2 SO 4 à С6Н5СООН +….. + Н2 O + . + С02
3) С7Н8 + КМп O 4 + …. à С6Н5СОО K +……. Н2 O + . .
Видео:Окисление органических соединений перманганатом калияСкачать

Окисление алкенов перманганатом калия
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
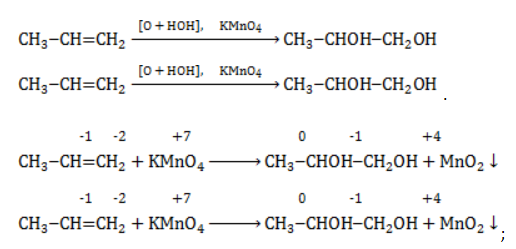
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Задание №32 в ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

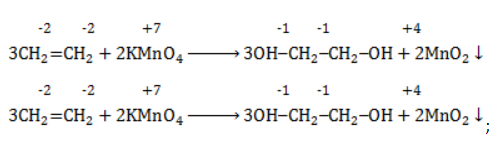
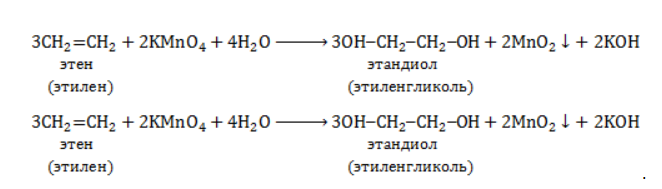
Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 
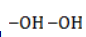
- кислород из перманганат-иона;
- вода.
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
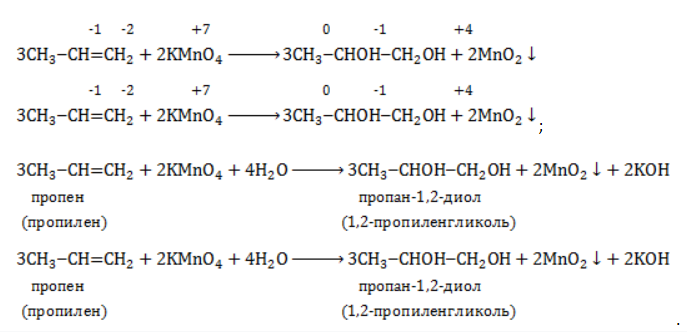
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 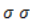
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

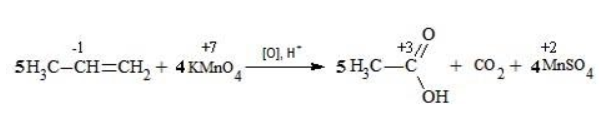
Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
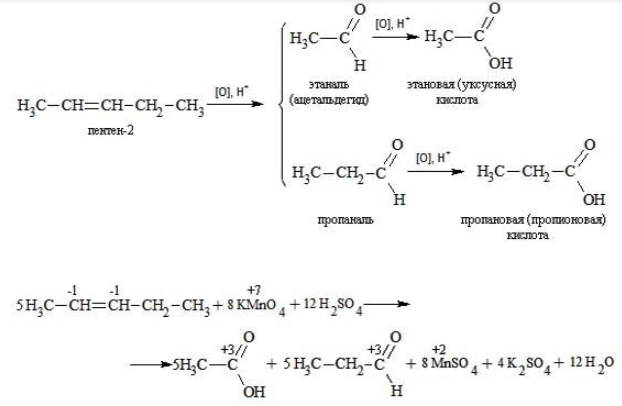
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
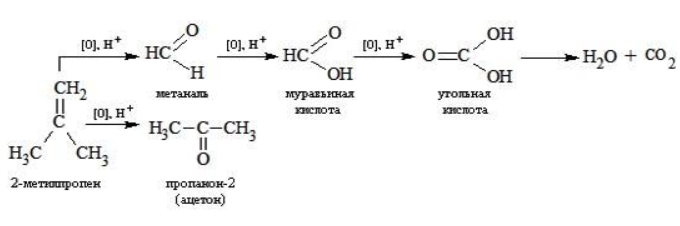
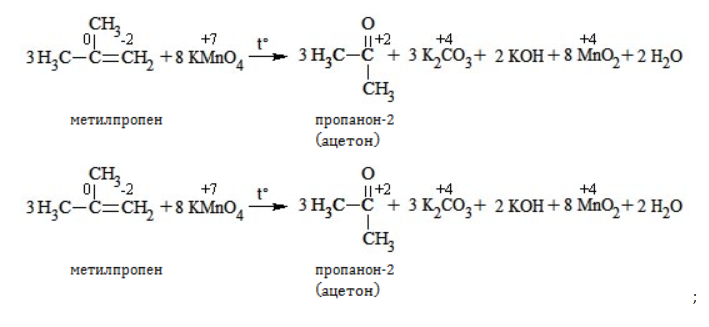
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




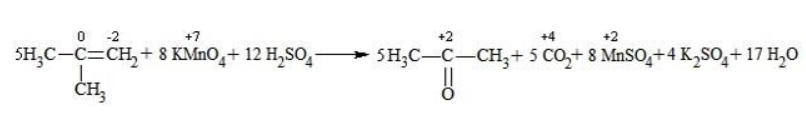
Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Жёсткое окисление алкенов, алкинов, алкадиеновСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💥 ВидеоВсе ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Алкены.Окисление алкенов с KMnO4 и K2Cr2O7. Все 14 реакций ЕГЭ.Скачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Составление уравнений реакций. 1 часть. 10 класс.Скачать  248. Химические свойства алкинов на примере бутина.Скачать  Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать  Химия ЕГЭ 2022 / Задание 32Скачать  ОВР 5 занятие Окисление алкеновСкачать  Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | УмскулСкачать  окисление бутина-1 в кислой среде, c4h6+kmo4+h2so4Скачать  Химия с нуля — Химические свойства АлкеновСкачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  |






 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей