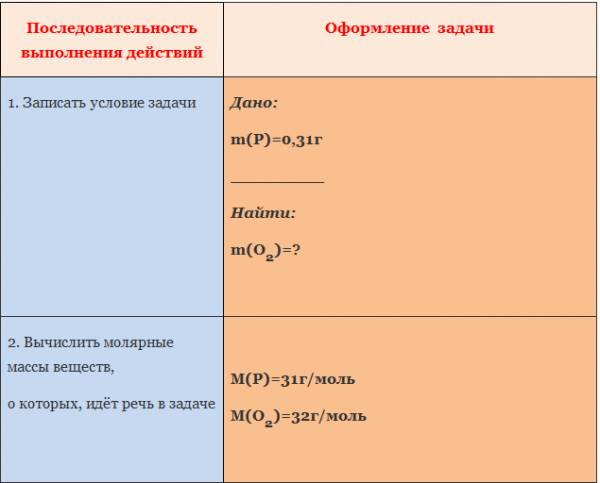
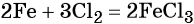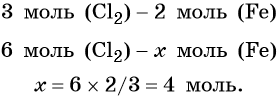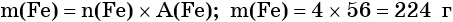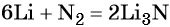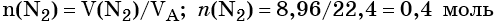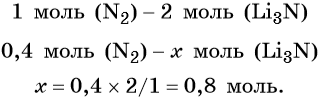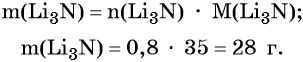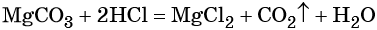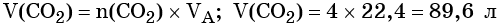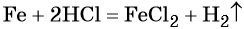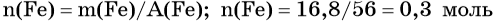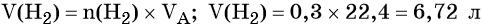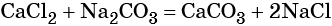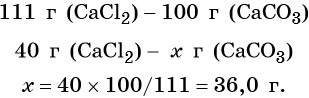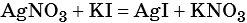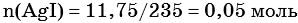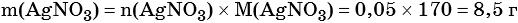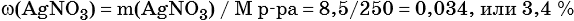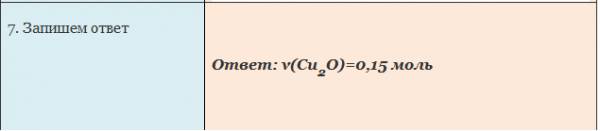Алгоритм 1
Вычисление массы вещества по известной массе другого
вещества, участвующего в реакции
Пример. Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Последовательность выполнения действий
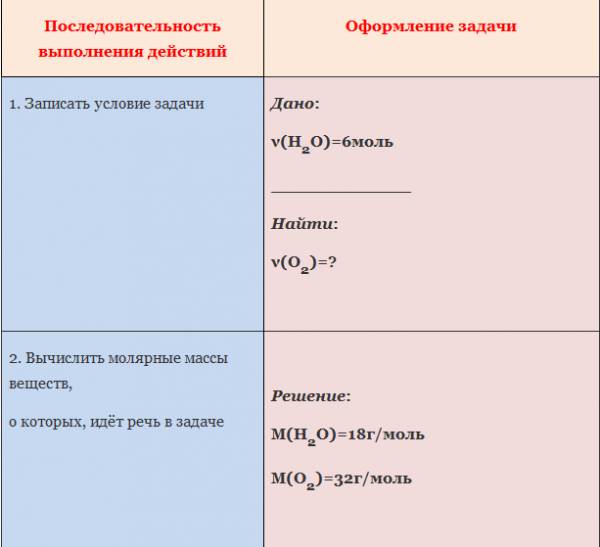
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи
Найдем количество вещества, масса которого дана в условии задачи
n=
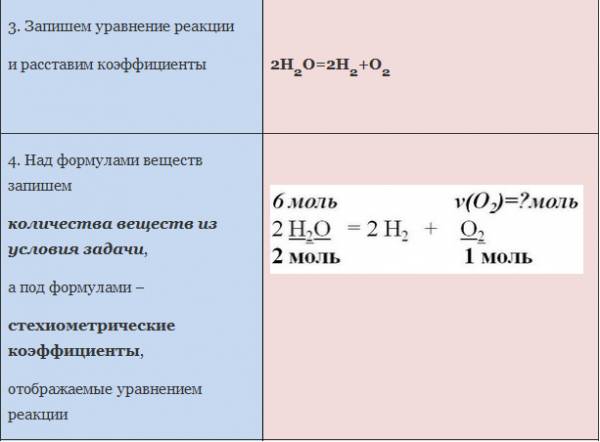
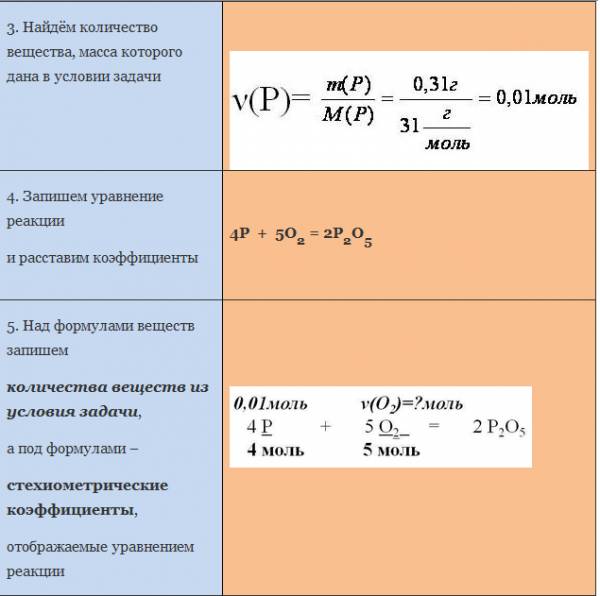
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
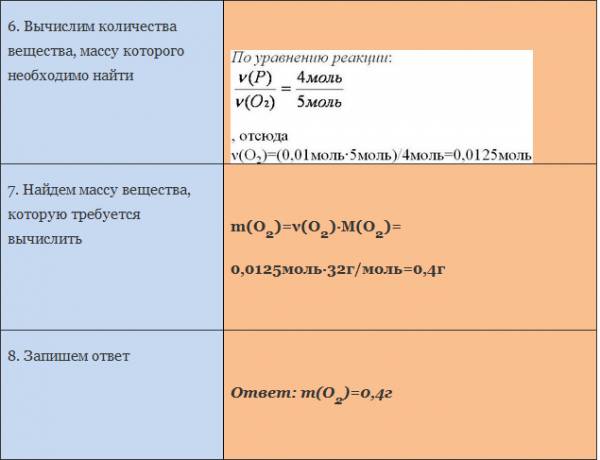
Вычислим количество вещества, массу которого требуется найти. Для этого составляем пропорцию


Следовательно, n(O2) = 0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Запишем ответ
Ответ: m(О2) = 8 г
- Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
- Тренировочные задания
- Урок по химии 9 класс. Тема:Вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего примеси
- Краткое описание документа:
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Педагогическая поддержка ребенка в образовательной среде
- Актуальные вопросы преподавания химии в школе в условиях реализации ФГОС
- «Домашнее обучение. Лайфхаки для родителей»
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- 8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Вопросы
- Поделись с друзьями
- Комментарии преподавателя
- Файлы
- 📸 Видео
Видео:Вычисление массы продукта реакции по изв-ной массе исходного вещ-ва, сод-го примеси. 10 класс. 1ч.Скачать

Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Видео:Химия. 9 класс. Вычисление массы вещества по уравнению реакции, если известна масса другого веществаСкачать

Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Видео:9 класс. Решение задач «Вычисление массы, если известна масса другого вещества, содержащего примеси»Скачать

Урок по химии 9 класс. Тема:Вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего примеси
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Видеолекции для
профессионалов
- Свидетельства для портфолио
- Вечный доступ за 120 рублей
- 311 видеолекции для каждого
Средняя школа № 28
Городской семинар на тему :
Использование новых технологий на уроках естественного цикла.
Открытый урок по химии
« Вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего примеси».
подготовила учитель химии и биологии
г.Актобе, 2009 год
Тема: « Вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего примеси».
— ознакомить учащихся с новым типом решения задач;
-развивать и вырабатывать у учащихся умения и навыки пользоваться формулами, производить расчеты по химическим уравнениям;
-формировать умение сравнивать, анализировать, устанавливать причинно –следственные связи, делать выводы;
— закрепить изученный материал по теме «Металлы»;
— совершенствовать у учащихся культуру общения, умение слушать.
Тип урока: комбинированный
Оборудование: интерактивная доска
Опрос домашнего задания (фронтально, письменно)
Изучение нового материала
Закрепление изученного материала
1. Организационный момент ( Тема урока – слайд 1)
2. Опрос домашнего задания (фронтально, письменно)
Ответьте на вопросы, изученные на прошлом уроке (слайд 2)
Дайте определение чугуна? (сплав железа и углерода, где массовая доля углерода 2-4%)
Какими свойствами обладает чугун? (хрупкий, не ковок, не поддается прокатке)
Какие виды чугуна известны и как они отличаются? ( белый чугун- Fe 3 C , серый чугун – графит – называют литейным)
Дайте определение, что такое сталь? (сплав железа и углерода, где массовая доля углерода менее 2%)
Качественными реакциями на ионы железа Fe 2+ и Fe 3+ ( с гидроксидом натрия — Fe 2+ зеленый осадок, Fe 3+ бурый осадок)
Письменно у доски – Fe 2 O 3 = Fe = FeCl 2
3. Изучение нового материала
В природе не существует чистых веществ. Минералы и горные породы помимо основного компонента содержат примеси. Для правильного расчета нужно знать массу чистого вещества, участвующего в реакции.
Для расчета используется формула:
m общая * 100% (слайд 3)
W – массовая доля чистого вещества в минерале или смеси
m чист.вещ-ва – масса чистого вещества
m общая — общая масса минерала или смеси
Дополнительно формулы (слайд 4)
m общая = m чист. вещ____
W чист. вещ * 100%
Давайте разберем решение задачи на конкретном примере: вычислите массу негашеной извести ( CaO ), которая получается при обжиге 300 кг известняка с массовой долей примесей 18 %. (слайд 5)
m известняка = 300 кг
W примесей = 18% ( слайд 6)
1) найдем массовую долю чистого вещества (слайд 7)
W чист. вещ. = 100 % — W примесей
W чист. вещ = 100 % — 18 % = 82%
2) определим массу чистого вещества CaCO 3 (слайд 8)
3) Составляем уравнения реакций (слайд 9,10)
100 кг/моль 56 кг/моль
246 кг CaCO 3 — х кг CaO
100 кг CaCO 3 — 56 кг CaO
х= 246 кг *_56 кг = 137,76 ( кг) – масса CaO
Ответ: m ( CaO ) = 137,76 кг
4. Закрепление изученного материала
Задача: какой объем водорода ( н.у.) потребуется для полного восстановления 40г технического оксида меди ( II ), массовая доля примесей в котором составляет 20% (слайд 11)
m техн.( CuO ) = 40 г
1) найдем массовую долю чистого вещества
W чист. вещ. = 100 % — W примесей
W чист. вещ = 100 % — 20 % = 80%
2) определим массу чистого вещества CuO
3) Составляем уравнения реакций
80 г/моль 22,4 л/моль
32 г CuO — х л H 2
80 г CuO — 22,4 л H 2
х= 32г *_22,4 л = 8,96 (л) – объем H 2
Ответ: V ( H 2) = 8,96 л
5. Домашнее задание
В учебнике разбор задач на странице 142-143
Решить задачу на странице 137 № 6
Краткое описание документа:
Тема: « Вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего примеси». Цели и задачи: — ознакомить учащихся с новым типом решения задач; -развивать и вырабатывать у учащихся умения и навыки пользоваться формулами, производить расчеты по химическим уравнениям; -формировать умение сравнивать, анализировать, устанавливать причинно –следственные связи, делать выводы; — закрепить изученный материал по теме «Металлы»; — совершенствовать у учащихся культуру общения, умение слушать. Тип урока: комбинированный Оборудование: интерактивная доска
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
- Сейчас обучается 109 человек из 47 регионов
Курс повышения квалификации
Педагогическая поддержка ребенка в образовательной среде
Курс повышения квалификации
Актуальные вопросы преподавания химии в школе в условиях реализации ФГОС
«Домашнее обучение. Лайфхаки для родителей»
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Видео:вычисление массы вещества по известной массе другогоСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 859 031 материал в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 05.04.2014
- 1014
- 0
- 05.04.2014
- 1322
- 2
- 05.04.2014
- 3569
- 11
- 05.04.2014
- 2588
- 6
- 05.04.2014
- 833
- 0
- 05.04.2014
- 10238
- 16
- 05.04.2014
- 7881
- 4
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 05.04.2014 6844
- DOCX 47 кбайт
- 98 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Михайловская Зоя Ивановна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 10 месяцев
- Подписчики: 0
- Всего просмотров: 6908
- Всего материалов: 1
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Задачи на примеси. 1 часть. 9 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
«Творческая работа с детьми (3-10 лет) по теме Космос»
«Ребенок с ОВЗ в семье: помощь в учебе»
«Развитие памяти и внимания при скорочтении»
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тысячи учителей в Австралии вышли на забастовку
Время чтения: 2 минуты
В школах России пройдет урок, посвященный Великой Отечественной войне
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
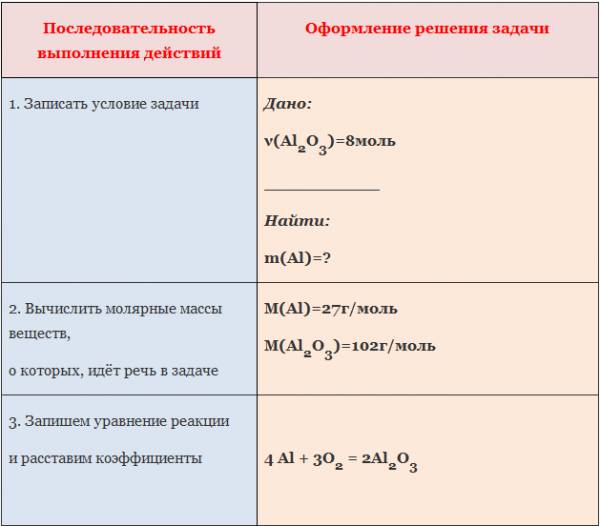
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
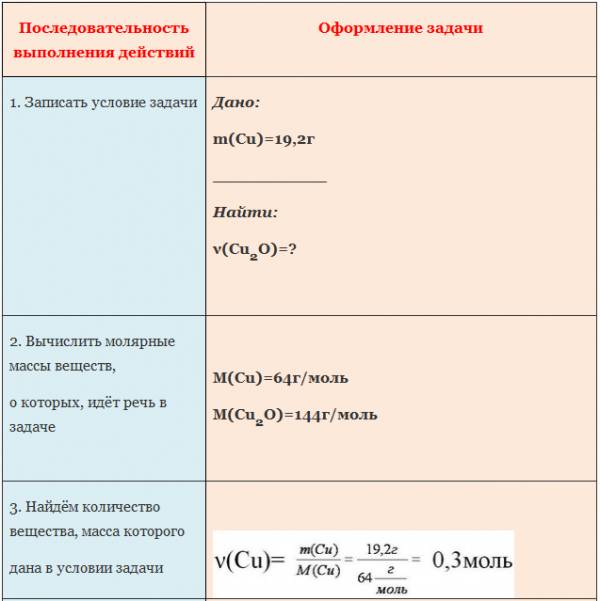
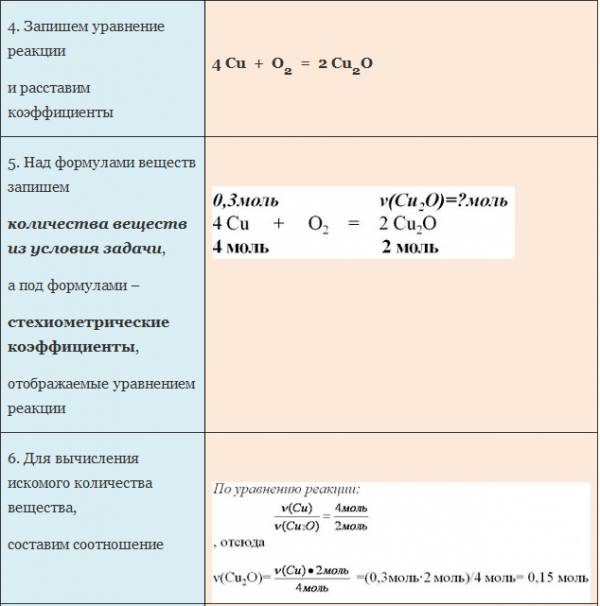
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео — http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео — http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео — http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео — http://www.youtube.com/watch?v=Gv-jZX0wZxE
Файлы
Нет дополнительных материалов для этого занятия.
📸 Видео
Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

9 класс. Определение массы вещества по известной массе вещества, содержащего примесиСкачать

Молярная масса. 8 класс.Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

9 класс. Решение задач (с использованием примесей)Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

вычисление объёма ващества по известной массе другого вещества, участвующего в реакцииСкачать

Вычисление массы продукта реакции по изв-ной массе исходного вещ-ва, сод-го примеси. 10 класс. 5ч.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Вычисление массы продукта реакции по изв-ной массе исходного вещ-ва, сод-го примеси. 10 класс. 6ч.Скачать