Читайте также:
|
NaI + AgNO 3 → AgI ↓ + NaNO 3 .
Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска:
В точке эквивалентности коллоидная частица становится электронейтральной , в КТТ начинает адсорбировать Ag + ; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется:
< m ( AgI )∙ n I – ( n – x ) K + > x – ∙ x Ag + + Ind 2– → ( x /2) Ag 2 Ind + < m ( AgI )∙ n I – ( n – x ) K + > x – .
f экв ( NaI )=1, 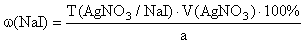
Метод Фольдгарда . Обратная аргентометрия .
Титранты – 1) AgNO 3 , 2) NH 4 SCN ;
Среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , точный избыточный объем AgNO 3 и индикатор:
KBr + AgNO 3 → AgBr ↓ + KNO 3 ,
В КТТ индикатор взаимодействует с титрантом :
f экв ( KI )=1, 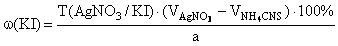
Преимущества пред другими методами:
1. Сильнокислая среда,
2. Не мешают друг ие ио ны;
1. Меньшая точность (обратный метод),
Особенности титрования хлоридов:
1. Низкая скорость титрования [ Ks ( AgCl )> Ks ( AgCNS )],
2. Очень слабое перемешивание,
3. Добавление толуола или бензола для экстракции AgCl .
Особенности титрования йодидов:
После добавления нитрата серебра ждут полного осаждения AgI , второй индикатор добавляют перед самым титрованием:
Метод Кальтгофа – Стенглера . /Только для Br – /
Титранты – 1) AgNO 3 , 2) NH 4 SCN , индикатор – NH 4 Fe ( SO 4 )2, среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , индикатор и точный избыточный объем NH 4 SCN (0,1 мл):
Титруют нитратом серебра до исчезновения красного окрашивания:
KBr + AgNO 3 → AgBr ↓ + KNO 3,
f экв ( KBr )=1, 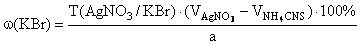
Метод Кальтгофа (Йодкрахмальный). / Для I – в присутствии Cl – и Br – /
Титрант – AgNO 3 , индикатор – крахмал, среда – H 2 SO 4 .
К ратсвору навески препарата прибавляют 1 каплю KIO 3 (0,1 моль/л), раствор крахмала и H 2 SO 4 (1:5) до появления синего окрашивания:
Титруют AgNO 3 (0,1 моль/л) до исчезновения синего окрашивания (после удаления йодида):
f экв ( KI )=1, 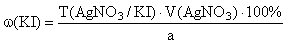
Аргентометрия с внешним индикатором. /Для I – /
Титрант – AgNO 3 , индикатор – нитриткрахмальная бумага, среда – H 2 SO 4 .
К раствору навески препарата добавляют H 2 SO 4 (1:5), титруют AgNO 3 . Вблизи точки эквивалентности после каждого раза прибавления титранта наносят каплю раствора на нитриткрахмальную бумагу. Титрование заканчивают, когда синего окрашивания на бумаге от прибавления раствора не будет:
f экв ( NaI )=1, 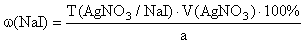
Видео:Анализ и контроль качества на фарм. про-ве. ТитриметрияСкачать

Вариант мора титрант среда индикатор переход окраски основное уравнение реакции
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ. КЛАССИФИКАЦИЯ МЕТОДОВ, ТРЕБОВАНИЯ К РЕАКЦИЯМ. АРГЕНТОМЕТРИЯ. МЕРКУРИМЕТРИЯ
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, раствори-мых солей серебра, среди которых NaCl, КВг, К I , AgNО3 и др. входят в состав лекарственных форм. Эти методы также применяют для определения лекарственных препаратов: димедрола гидрохло-рида, бромкамфоры, новокаина гидрохлорида и других. Титриметрические методы осаждения основаны на применении при титровании реакций, сопровождающихся образованием малораст-воримых соединений. От гравиметрического метода осаждения они отличаются тем, что при титровании к определяемому веществу прибавляют эквивалентное количество осадителя в виде стандарт-ного раствора. Содержание определяемого компонента (вещества) рассчитывают по величине объема титранта, израсходованного на осаждение определяемого вещества.
В аналитической химии известно много реакций, которые сопровождаются образованием малорастворимых соединений. Из них в количественном анализе могут быть использованы только те, которые отвечают следующим требованиям:
1. Реакция между определяемым веществом и стандартным раст-вором (титрантом) должна протекать в условиях, обеспе-чивающих образование осадка с минимальной растворимостью ( S ≤ 10 -5 моль/дм 3 ).
2. Реакция образования осадка должна протекать быстро, количест-венно, стехиометрично. При этом не должно наблюдаться образование пересыщенных растворов.
3. Должна быть возможность выбора индикатора для фиксирования конечной точки титрования.
4. Явления адсорбции и соосаждения не должны влиять на резуль-таты определения.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами:
— серебра Аg + + В r — ↔ AgВr↓
Наиболее широко применяют методы, основанные на реакциях осаждения малорастворимых солей серебра:
Аg + + На l — ↔ AgНаl↓
где На l — являются Сl, Br — , I — и др. Эти методы объединены в раздел титриметрического анализа, называемый аргентометрией.
В титриметрии применяют также метод меркурометрии, основанный на осаждении малорастворимых солей ртути ( I ), таких как Hg2C12, Hg2Br2, Hg2 I 2
Hg2 2+ + 2Сl — ↔ Hg2Cl2↓
АРГЕНТОМЕТРИЯ
Аргентометрический титриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата:
Аg + + На l — ↔ АgНа l ↓
Стандартный раствор 0,1 моль/дм 3 серебра нитрата может быть приготовлен:
— как первичный стандартный раствор;
— вторичный стандартный раствор.
Для приготовления первичного стандартного 0,1 моль/дм 3 раствора AgNО3 рассчитанную навеску химически чистой соли AgNО3 взвешивают на аналитических весах, переносят в мерную колбу, растворяют в дистиллированной воде, доводят объем раство-ра до метки, тщательно перемешивают и переносят в склянку из темного стекла.
При приготовлении вторичного стандартного раствора АgNО3 рассчитанную навеску соли взвешивают на технических весах, переносят через воронку в склянку из темного стекла, добавляют цилиндром необходимый объем дистиллированной воды и тща-тельно перемешивают. Полученный вторичный стандартный раствор AgNО3 стандартизуют по химически чистым стандартным веществам KCl или NaCl или же по их растворам.
Концентрация стандартных растворов серебра нитрата изменяется при длительном хранении. Причиной нестойкости растворов серебра нитрата является их светочувствительность, потому эти растворы следует хранить в склянках из темного стекла либо в посуде, обернутой черной бумагой или покрытой черным лаком, и в защищенном от света месте. Их концентрацию необхо-димо периодически проверять.
СПОСОБЫ ОПРЕДЕЛЕНИЯ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ
В методе аргентометрии используют как безындикаторные, так и индикаторные способы фиксирования конечной точки титро-вания.
Безындикаторные способы
Хлорид — ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). При этом анализиру-емый раствор титруют стандартным раствором серебра нитрата, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора серебра нитрата, в другую – каплю стандартного раствора натрия хлорида такой же концентрации. В недотитрованном растворе появляется помутне-ние в пробирке с серебра нитратом, в перетитрованном — в пробирке с натрия хлоридом. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
Бромид- и йодид- ионы определяют безындикаторным способом просветления. Суть его состоит в том, что при добавлении к анализируемому раствору из бюретки небольшими порциями стандартного раствора серебра нитрата в начале образуется колло-идный раствор серебра бромида, а в момент эквивалентности происходят коагуляция коллоидных частиц и осаждение их в виде творожистых хлопьев, раствор при этом осветляется. Этот метод достаточно точен, но в настоящее время применяется редко.
Из современных безындикаторных методов в аргентометрии чаще всего применяется потенциометрическое определение точки эквивалентности с использованием серебряных или галогенид-селективных электродов.
Подбор индикаторов в аргентометрии очень сложен. Для его выполнения, как и в кислотно-основном методе титрования, используют кривую титрования (рис. 1), представляющую собой графическое изображение изменения концентрации определяемых ионов в конце титрования, то есть когда недотитровано 10 % определяемого вещества и когда раствор перетитрован стандар-тным раствором на 10 %.
На кривой титрования видно, что вначале рСl изменяется медленно и лишь вблизи точки эквивалентности — скачкообразно. Резкое изменение pCl вблизи точки эквивалентности называется скачком титрования. Скачок титрования начинается, когда недотитровано 0,1 % NaCl, и заканчивается, когда раствор перетитрован на 0,1 %. Общая величина скачка титрования —
2 ед. рСl. Кривая титрования симметрична относительно точки эквивалентности ТЭКВ.
На величину скачка титрования влияют следующие факторы:
1. Концентрация реагирующих веществ: чем выше концентрация,
тем больше скачок титрования. Для растворов 1 моль/дм 3 NaCl и AgNO3скачок титрования составляет 4 ед. рСl; для раствора 0,1 моль/дм 3 (рассматриваемый нами случай) — 2 ед. рСl, а при концентрации 0,01 моль/дм 3 — 0,3 ед. рСl;
2. Растворимость осадка: чем ниже растворимость и чем меньше произведение растворимости (ПР), тем больше скачок титрования. Например, при Ks(AgCl) = 1,78 ∙ 10 -10 , Ks(AgBr) = 5,3 ∙ 10 -13 и Ks(AgI) = 8,3 ∙ 10 -17 скачок титрования для АgСl занимает 2 ед. рСl, AgBr — 4 ед. рВ и для АgI — 8 ед.соответственно.
Выбор индикатора по кривой титрования. При выборе индика-тора выбирают такой ион, который образует окрашенное соедине-ние с ионом серебра в пределах скачка титрования, то есть при рАg = 4. 6 ед. наиболее пригодным оказывается K2CrО4, т. к. Ks = 2,1 * 10 -12 и анион CrO4 2- образуют окрашенный осадок с ионами серебра при концентрации последних, отвечающих значениям в пределах скачка на кривой титрования.
Произведем расчет концентрации хромат-ионов, при которой произойдет образование осадка Ag2CrО4 в конечной точке титрования:
Концентрация ионов серебра в этот момент равна: [Аg + ] = √Ks(AgCl) = √1,78 * 10 -10 = 1,33*10 -5 моль/ дм 3 .
Подставив в эту формулу значение равновесной концентрации ионов серебра, получаем:
[СrО4 2- ] = К S / [Ag + ] 2 = 2,1 ∙ 10 -12 / (1,33 ∙ 10 -5 ) 2 = 2,1 ∙ 10 -12 / 1,78 ∙ 10 -10 ≈ 1 ∙ 10 -2 моль/дм 3
Таким образом, если концентрация хромат-ионов в растворе будет не менее 1∙10 -2 моль/дм 3 , то после полного осаждения Сl — ионов образуется кирпично-красный осадок серебра хромата, что укажет на конец титрования.
В зависимости от применяемого индикатора в аргентометрии различают следующие методы:
· метод Мора , основанный на реакции между ионами серебра и галогенид — ионами в присутствии индикатора — раствора калия хромата;
· метод Фольгарда (тиоцианатометрия), основанный на реакции между ионами серебра и тиоцианат-ионами в присутствии ионов железа ( III ) в качестве индикатора;
· метод Фаянса — Ходакова основан на применении адсорбци-онных индикаторов.
Титрантом метода является раствор 0,1 (или 0,05; 0,02; 0,01) моль/дм 3 серебра нитрата. В качестве индикатора используют раствор 0,01 моль/дм 3 калия хромата, применение которого основа-но на дробном осаждении. Суть метода заключается в том, что при титровании галогенид-ионов в присутствии хромат-ионов в первую очередь осаждаются галогенид-ионы:
Hal — + Ag + ↔ AgHal ↓
Когда определяемые галогенид-ионы практически полностью осаждаются в виде AgHal , только тогда начинает выпадать кирпично-красный осадок Ag 2 СrО4:
Это обусловлено различной растворимостью солей АgНа l и Ag2CrO4↓. Рассмотрим это на примере титрования раствора 0,1 моль/дм 3 КСI раствором 0,1 моль/дм 3 AgNО3 в присутствии индикатора — раствора 0,01 моль/дм 3 K2CrО4. В растворе АgСl величина Ks(AgCl) = 1,78 ∙ 10 -10 достигается при концентрации ионов Ag + , равной:
[Ag + ] = Ks(AgCl) / [ Cl — ] = 1,78 ∙ 10 -10 / 10 -1 = 1,78 ∙ 10 -9 моль/дм 3 .
Осаждение Ag2CrО4 с величиной Ks= 1,1 ∙ 10 -12 начнется при концентрации ионов серебра, равной:
[Ag + ] = √ Ks(Ag2C rO 4 )/ 10 -2 = √ 1,1 ∙ 10 -12 / 10 -2 =1,05 ∙ 10 -5
Так как Ks(AgCl) достигается при меньшей концентрации ионов серебра (1,78 ∙ 10 -9 моль/дм 3 ), чем KS(Ag2CrО4) ( [Ag + ] = 1,05 ∙ 10 -5 моль/дм 3 ), то первым осаждается АgСl.
По мере прибавления титранта концентрация ионов серебра в растворе возрастает, и при [ Ag + ] = 1,05 ∙ 10 -5 моль/дм 3 наряду с Ag С l образуется осадок AgCrO 4 . Титрование заканчивают, когда взмученный в жидкости осадок от одной капли титранта (раствора серебра нитрата) приобретает красно-оранжевую окраску (начало выпадения осадка AgCrO 4 ).
В этот момент концентрация хлорид-ионов в растворе будет равна:
[ Cl — ] = KS ( AgCl ) / [ Ag + ] = 1,78 ∙ 10 -10 / 1,05 ∙ 10 -5 = 1,7 ∙ 10 -5 моль/дм 3 .
Следовательно, в данных условиях выпадение осадка серебра хро-мата начинается только после практически полного осаждения С l -ионов.
Условия титрования по методу Мора:
1. Титрование следует проводить в нейтральной или слабоще-лочной среде (6,5≤ рН≤ 10). Метод нельзя применять:
а) в кислой среде из-за растворяемости осадка Ag2CrО4:
б) в щелочной среде из-за разложения титранта с образованием осадка Аg2О:
2Ag + + 2ОН — ↔ 2AgOH↓ → Аg2О↓ + Н2О
2. В растворе должны отсутствовать:
а) катионы Р b 2 + , Ва2 + , Hg2 + и другие, образующие с анионами индикатора осадки хроматов:
б) анионы PO4 3- , CO3 2- , C2О4 2- , AsО4 3- и другие, образующие осадки
с ионами серебра:
3. Вблизи конечной точки титрования раствор необходимо титро-вать медленно, при энергичном перемешивании, чтобы уменьшить ошибку за счет адсорбции.
4.Нельзя титровать окрашенные растворы, так как они будут маскировать окраску AgC r O4, что затруднит фиксирование конечной точки титрования.
Метод Мора применим для определения хлоридов и бромидов, в том числе фармацевтических препаратов, в состав которых входят хлорид- и бромид- ионы.
Метод Мора нельзя использовать для определения:
— йодид- и роданид-ионов из-за их сильной адсорбции на поверхности осадка;
— солей галоидоводородных кислот и слабых оснований, так как в peзультате гидролиза в их растворах образуется кислая среда:
Метод Фольгарда основан на титровании раствора, содержащего ионы серебра, стандартными растворами NH4NCS или KNCS:
Ag + + NCS — ↔ AgNCS↓
Индикатором в этом методе являются ионы Fe 3+ . После осаждения ионов серебра в виде белого осадка AgNCS избыточная капля титранта реагирует с индикатором — раствором железоаммонийных квасцов NH4[Fe(SO4)2] ∙12Н2О с образованием растворимого красного комплекса:
Ионы Fe 3+ образуют с NCS — -ионами окрашенные комплексы различного состава: [Fe(NCS)] 2+ , [Fe(NCS)2] + ∙ [Fе(NСS)6] 3- и другие, но образование комплексов различного состава не влияет на результаты титрования, так как все комплексы окрашены.
При определении по методу Фольгарда применяют прямое и обратное титрование. В качестве стандартных растворов используют:
а) в методе прямого титрования — растворы аммония тиоцианата или калия тиоцианата;
б) в методе обратного титрования — растворы серебра нитрата и аммония или калия тиоцианата.
Приготовление раствора NH4NCS. Аммония тиоцианат не являя-ется стандapтным веществом, так как соль гигроскопична. Поэтому из нее готовят раствор требуемой концентрации — приблизительно 0,1 или 0,05 моль/дм 3 , а затем его стандартизуют по стандартному веществу AgNО3 или по стандартному раствору АgNО3.
Условия титрования по методу Фольгарда:
1. Титрование следует выполнять в кислой среде для предотвра-щения гидролиза индикатора — ионов Fe 3+ :
2. При титровании раствор необходимо энергично перемешивать для уменьшения ошибки за счет адсорбции ионов на поверхности осадка.
3. В анализируемом растворе должны отсутствовать:
а) соли ртути (1) и (II), реагирующие с NCS — -ионами:
б) окислители КвrО3, КМ nO 4 и другие, окисляющие NСS-ионы;
в) анионы F — , PO4 3- , C2О4 2- и другие, образующие прочные комплексы с индикатором:
Определение ионов Ag + по методу Фольгарда (прямое титрование)
Концентрацию ионов серебра определяют прямым титрованием стандартным раствором аммония тиоцианата (или калия тиоциа-ната) в присутствии ионов Fe 3+ .
Стандартный раствор аммония тиоцианата реагирует в первую очередь с ионами серебра, образуя малорастворимое соединение:
Ag + + NCS — ↔ AgNCS KS(AgNCS) = 1,1 ∙ 10 -12
В конечной точке титрования избыточная капля титранта реагирует с ионами Fе 3+ и окрашивает раствор в красный цвет:
Fe 3+ + 3NCS — ↔ [Fе(NСS)3] Кнест = 4 ∙10 -2
Метод Фольгарда (прямое титрование) применяют для опред-ния:
а) содержания серебра в сплавах (предварительно растворив его точную навеску в азотной кислоте);
б) катионов серебра в коллоидных растворах (колларголе и протар-голе);
в) концентрации солей ртути (I I ).
Определение анионов по методу Фольгарда (обратное титрование)
Для определения анионов используется обратное титрование. Суть определения состоит в том, что к анализируемому раствору прибавляют удвоенный минимальный, точно отмеренный объем (35,00 или 40,00 см 3 ) стандартного раствора серебра нитрата ( l-й титрант), который реагирует с определяемыми анионами, например хлорид-ионами:
Непрореагировавший остаток серебра нитрата оттитровывают вторым стандартным раствором аммония тиоцианата в присут-ствии индикатораионов Fe 3+ :
Ag + + NCS — ↔ AgNCS↓
в конце титрования избыточная капля раствора NH4NCS реагирует с ионами Fe 3+ :
и раствор окрашивается в красный цвет.
При определении хлоридов возникает ошибка за счет нечеткого установления конечной точки титрования. Это связано с протеканием обменной реакции между осадком серебра хлорида и тиоцианат-ионами в растворе, так как осадок серебра тиоцианата менее растворим, чем осадок AgCl:
AgCl + NCS — ↔ AgNCS + Сl —
Это приводит к значительному перерасходу титранта NH4NCS, и результаты определения будут завышены. Для устранения этой методической ошибки осадок АgСl отфильтро-вывают и в полученном фильтрате определяют избыток серебра нитрата. Этот способ усложняет работу.
Чаще для устранения этой ошибки к анализируемому раствору прибавляют органический растворитель, не смешивающийся с водой (тетрахлорметан CC l 4 , бензол С6Н6 и др.). Определение момента эквивалентности в присутствии органических раствори-телей происходит достаточно четко. Это обусловлено тем, что органические растворители покрывают поверхность осадка, изолируют его от раствора, поэтому реакция между осадком AgCl и NCS — — ионами практически не протекает.
При определении бромидов ошибка подобного рода не возникает, так как произведение растворимости серебра бромида меньше, чем серебра роданида: K S (AgBr) = 5,6 ∙ 10 -13 -12
При определении йодидов по методу Фольгарда возникает ошибка за счет протекания окислительно-восстановительной реакции:
2Fe 3+ + 2I — ↔ 2F е 2+ + I2
Эту ошибку исключают, прибавляя индикатор в конце титрования, только после того как будет введен избыток AgNО3, и йодид-ионы свяжутся в малорастворимое соединение AgI↓:
По методу Фольгарда можно определить:
а) катионы Ag + — прямым титрованием;
б) анионы Сl, Вr — , I , NCS — — обратным титрованием.
По сравнению с методом Мора метод Фольгарда имеет ряд преимуществ:
— определение Ag + , Сl, Вr — , I — , NCS — выполняют в кислой среде;
— катионы Ва 2+ , Pb 2+ и другие, мешающие определению анионов по методу Мора, не мешают их определению по Фольгарду.
МЕТОД ФАЯНСА — ХОДАКОВА
Метод Фаянса — Ходакова основан на прямом титровании анионов (галогенидов, цианидов, тиоцианатов) стандартным раствором серебра нитрата в присутствии адсорбционных индикаторов.
Адсорбционные индикаторы представляют собой слабые органи-ческие кислоты, диссоциирующие на ионы:
H I nd ↔ H + + Ind —
Анионы этих кислот вблизи точки эквивалентности адсорбируются поверхностью образующихся осадков, что приводит к изменению окраски осадка и позволяет фиксировать конечную точку титрования.
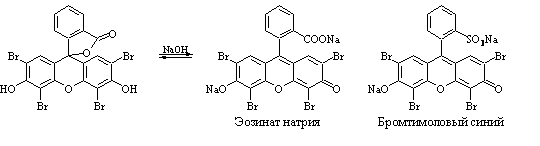
В качестве адсорбционных индикаторов в аналитической практике чаще всего используют флуоресцеин, дихлорфлуоресцеин, эозин и другие соединения
При титровании, например, хлорид-ионов ионами серебра образуется осадок серебра хлорида, склонный к образованию коллоидных растворов:
Ag + + Сl — ↔ AgCl
Осадки с ионной кристаллической решеткой адсорбируют на своей поверхности одноименные ионы, как правило, находящиеся в избытке. До конечной точки титрования на поверхности осадка AgCl адсорбируются находящиеся в избытке хлорид-ионы, и коллоидные частицы при обретают отрицательный заряд, то есть имеют следующее строение: [mАgСl] n Cl — .
Эти заряженные частицы притягивают из раствора в качестве против оионов ионы K + (вторичный адсорбционный слой):
Поскольку коллоидные частицы имеют отрицательный заряд, то адсорбция анионов индикатора невозможна.
В конечной точке титрования коллоидные частицы теряют заряд, и выпадает осадок хлорида серебра. Первая избыточная капля раствора AgNО3 создает в растворе избыток ионов Ag + , которые адсорбируются поверхностью осадка AgCl и придают ей положительный заряд: [mАgСl] n Ag + , то есть происходит изменение знака заряда частицы. В качестве противоионов теперь адсорбируются нитрат-ионы (вторичный адсорбционный слой — мицеллы): <[ m А g С l ] n А g + ( n — x ) NO 3 — > x +
Нитрат-ионы NО3 — не образуют труднорастворимого соединения с ионами коллоидной частицы, поэтому легко замещаются окрашенными анионами индикатора, что приводит к изменению окраски поверхности осадка и указывает на конечную точку титрования.
Условия титрования по методу Фаянса-Ходакова:
1. Титрование следует выполнять при определенном значении рН, так как это существенно влияет на ионизацию индикатора. Титрование с флуоресцеином необходимо проводить в нейтральной или слабощелочной среде (рН = 7. 10); в кислой среде ионизация флуоресцеина будет подавляться, при этом концентрация его анионов понизится настолько, что не сможет образовываться окрашенный адсорбционный слой. Дихлорфлуоресцеин — кислота более сильная, чем флуоресцеин, поэтому титрование можно проводить в слабокислой среде. Эозинболее сильная кислота, поэтому его можно применять как индикатор в кислой среде при рН ≤ 2.
2. Титрование с адсорбционным индикатором следует проводить при большой поверхности осадка. Это достигается, когда осадок присутствует в виде коллоидных частиц. С этой целью к титруемому раствору прибавляют защитные коллоиды — декстрин, крахмал и др.
3. Необходимо, чтобы ионы индикатора адсорбировались осадком значительно слабее, чем определяемые ионы, иначе ионы индикатора будут адсорбироваться значительно раньше момента эквивалентности, что приведет к заниженным результатам анализа.
Метод Фаянса — Ходакова применим для определения Сl — , Br — , I — , CN — и NСS — -ионов.
МЕРКУРОМЕТРИЯ
Меркурометрический метод анализа основан на образовании малорастворимых солей ртути (I) с хлоридами, бромидами, йодидами:
Титрант метода меркурометрии — раствор 0,1 моль/дм 3 ртути (I) нитрата.
Приготовление стандартного раствора Нg2(NО3)2. Ртути (I) нитрат не является стандартным веществом, так как соль гигроскопична, неустойчива и содержит примеси Нg 2+ — ионов. Поэтому из нее готовят вторичный стандартный раствор. Рассчитанную навеску Нg2(NО3)2 ∙ 2Н2О взвешивают на технических весах, переносят в мерный стакан, прибавляют раствор 2 моль/дм 3 азотной кислоты и нагревают до полного растворения навески. К полученному раст — вору прибавляют 4-5 капель металлической ртути. Приготовленный раствор выдерживают над металлической ртутью не менее суток, что приводит к восстановлению Hg 2+ -ионов:
Только после этого полученный раствор стандартизуют по стандартным веществам — химически чистому NaCl или КСl или же по их стандартным растворам. Концентрация раствора ртути (1) нитрата не изменяется в течение нескольких месяцев.
В методе меркурометрии в качестве индикаторов используют:
а) раствор железа ( III ) тиоцианата [Fе(NСS)3];
б) 1 %-ный раствор дифенилкарбазона в 95 %-ном спирте.
При применении раствора [Fе(NСS)3] точку конца титрования фиксируют по исчезновению красной окраски индикатора. Изменение окраски происходит при взаимодействии одной избыточной капли титранта с раствором индикатора:
При титровании с данным индикатором необходимо проводить контрольный опыт для установления объема титранта, израсход-ованного на реакцию с индикатором. Для этого к 20-25 см 3 дистиллированной воды прибавляют все реагенты в тех же количествах, что и при анализе пробы, и титруют стандартным раствором ртути ( I ) нитрата. Полученный объем титранта вычитают из объема, израсходованного на титрование пробы.
Дифенилкарбазон относится к группе адсорбционных индикаторов. Его применение основано на том, что после полного осаждения галогенид-ионов избыточная капля титранта реагирует с дифенилкарбазоном и образует в нейтральной или слабокислой среде осадок синего цвета, а в сильнокислой среде раствор синего цвета, в конечной точке титрования окраска становится синефиолетовой. При титровании с дифенилкарбазоном вначале проводят грубое титрование с точностью до 1,0 см 3 , а затем при повторном, точном титровании (чтобы уменьшить ошибку за счет адсорбции) индикатор вводят в раствор, когда остается добавить 1,0-2,0 см 3 титранта. Поправка на индикатор в этом случае не нужна. Перед железа (II I ) тиоцианатом индикатор дифенилкарбазон имеет ряд преимушеств: с ним можно титровать в сильнокислых растворах, окрашенных и мутных растворах (благодаря тому, что окраска осадка или раствора в конечной точке титрования очень яркая), в присутствии пептизирующих веществ.
1.Среда анализируемого раствора должна быть кислая, для этого раств подкисляют азотной кислотой, чтобы предотвратить гидролиз титранта.
2. Титрование следует проводить при энергичном перемешивании раствора для уменьшения ошибки за счет адсорбции.
По методу меркурометрии можно определить хлорид- и бромид-ионы. Определению не мешают катионы аммония, щелочных и щелочно-земельных металлов, Fe 2+ , Mn 2+ , Cr 3+ , Co 2+ , Ni 2+ , Zn 2+ , A l3+ , Pb 2+ , Сu 2+ т. п.
а) сульфат-ионы — их следует устранять, осаждая избытком бария нитрата;
б) ионы железа (III) — их связывают в прочные комплексы, добавляя избыток F — — или PO4 3- -ионов;
в) дихромат- и перманганат-ионы — их необходимо восстанавливать водорода пероксидом;
г) сульфит- и сульфид-ионы следует предварительно окислять пероксидом водорода.
Методом меркурометрии нельзя определить йодид-ионы, так как образующийся осадок Hg2 I 2 разлагается. Меркурометрический метод анализа имеет преимущества перед аргентометрическим методом:
— галогениды ртути ( I ) менее растворимы, чем соответствующие соли серебра, поэтому конечная точка титрования в методе меркурометрии фиксируется более четко;
— он исключает использование дорогостоящих солей серебра.
Основной недостаток меркурометрического метода — соли ртути (I) ядовиты! При работе с ними необходимо соблюдать правила работы с ядовитыми веществами.
📽️ Видео
Шеховцова Т.Н. - Аналитическая химия - Кислотно-основное титрованиеСкачать

Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Шеховцова Т.Н. - Аналитическая химия - Химическое равновесие. Титриметрические методы анализаСкачать

Кислоты и основания. Кислотно-основное титрование.Скачать

Получение аморфных осадков на примере определения железа в соединениях. Кузьмич Е.ССкачать

Лабораторная работа №4. Окислительно-восстановительные реакции. Основные окислители и восстановителиСкачать

Кузьмич Е.С. Классификация методов осаждения.Скачать

Кузьмич Е.С.Приготовление рабочего раствора бихромата калия Бихроматометрическое определение желез.Скачать

Кислотно-основное титрование многоосновных кислот и их солей. Часть 1.Скачать












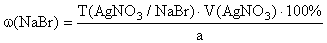 .
.