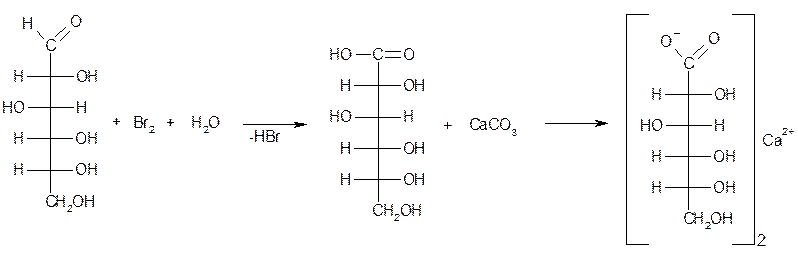Карбоновые кислоты алифатического ряда представляют собой производные углеводородов, у которых один атом водорода замещен карбоксильной группой. Эту группу соединений можно также рассматривать как конечный продукт процесса окисления спиртов, не связанного с разрушением углеродной цепи:
В медицинской практике используют соли карбоновых кислот: калия ацетат, кальция лактат, натрия цитрат для инъекций, кальция глюконат, натрия вальпроат.
Калия ацетат получают нейтрализацией уксусной кислоты эквивалентным количеством карбоната калия:
Для получения натрия цитрата нейтрализуют (до слабощелочной реакции) раствор лимонной кислоты:
Для очистки от примесей натрия цитрат перекристаллизовывают из этанола.
Кальциевые соли молочной и глюконовой кислот получают окислением глюкозы в присутствии соединений кальция. Молочная кислота образуется в результате брожения глюкозы (или других сахаристых веществ). Процесс происходит под влиянием культур молочнокислых бактерий при 35–45°C. Образующуюся молочную кислоту нейтрализуют, добавляя карбонат кальция:
Кальция глюконат получают электрохимическим окислением глюкозы в присутствии бромида кальция и карбоната кальция. При электролизе бромида кальция на аноде выделяется свободный бром, который окисляет глюкозу до глюконовой кислоты. Глюконовая и бромоводородная кислоты нейтрализуются карбонатом кальция. Образующийся бромид кальция вновь подвергают электролизу. Общая схема происходящего процесса может быть выражена в виде следующих уравнений химических реакций:
23.1. Свойства солей карбоновых кислот
| Лекарственное вещество | Химическая структура | Описание |
| Potassium Acetate (Kalii acetas)— калия ацетат | CH3COOK | Белый кристаллический порошок со слабым запахом уксусной кислоты. Гигроскопичен. На воздухе расплывается |
| Valproic Acid Sodium Salt— натрия вальпроат |  | Белый или почти белый кристаллический порошок без запаха или почти без запаха |
| Calcium Lactate— кальция лактат |  | Белый аморфный порошок почти без запаха, выветривающийся на воздухе |
| Sodium Citrate (Natrii citras pro injectionibus)— натрия цитрат для инъекций |  тринатриевая соль лимонной кислоты тринатриевая соль лимонной кислоты | Бесцветные кристаллы или белый кристаллический порошок без запаха, выветривающийся на воздухе |
| Calcium Gluconate— кальция глюконат |  | Белый зернистый или кристаллический порошок без запаха |
Сравнительные данные о физических свойствах солей карбоновых кислот (табл. 23.1) указывают на то, что они представляют собой белые кристаллические вещества, гигроскопичные (калия ацетат) или выветривающиеся на воздухе (кальция лактат, натрия цитрат) ввиду наличия кристаллизационной воды. Соли уксусной и лимонной кислот имеют солоноватый вкус, а калия ацетат — слабый запах уксусной кислоты. Соли щелочных металлов (калия ацетат, натрия вальпроат и натрия цитрат) легко растворимы в воде.
Кальциевые соли медленно растворимы в воде, но в кипящей воде их растворимость значительно улучшается (кроме цитрата кальция). В этаноле растворим калия ацетат, легко растворим натрия вальпроат. Остальные соли в этаноле практически нерастворимы.
Для испытания подлинности ФС рекомендуют использовать ИК-спектры лекарственных веществ, которые должны полностью совпадать с полосами поглощения прилагаемых к ФС рисунков спектров.
С помощью соответствующих аналитических реакций устанавливают в растворах солей карбоновых кислот наличие ионов калия, натрия и кальция.
Ацетат-ион в калия ацетате обнаруживают реакцией образования сложного эфира при взаимодействии с этиловым спиртом и концентрированной серной кислотой. Этилацетат имеет характерный фруктовый запах:
Ацетат-ион в нейтральных растворах образует с хлоридом железа (III) соединения, окрашенные в интенсивно-красный или буро-красный цвет:
Анион глюконовой кислоты приобретает в тех же условиях светло-зеленое окрашивание.
Натрия вальпроат, взаимодействуя с раствором нитрата кобальта, образует пурпурный осадок вальпроата кобальта, растворимый в тетрахлорметане (четырёххлористом углероде):
Для обнаружения глюконат-иона используют также реакцию образования фенилгидразида глюконовой кислоты, температура плавления которого около 200°C. Испытание выполняют, нагревая кальция глюконат на водяной бане в течение 30 мин со свежеперегнанным фенилгидразином и ледяной уксусной кислотой. Для более быстрой кристаллизации потирают стеклянной палочкой внутреннюю часть пробирки. Кальция глюконат восстанавливает нитрат серебра при нагревании в нейтральном растворе. В кислой среде и в присутствии аммиака восстановления не происходит.
Лактат-ион идентифицируют разложением перманганатом калия в кислой среде. Образуется ацетальдегид, имеющий характерный запах:
Образовавшийся ацетальдегид можно также обнаружить в парах по почернению полоски фильтровальной бумаги, смоченной реактивом Несслера, или по образованию синего пятна на полоске бумаги, смоченной смесью раствора нитропруссида натрия и пиперидина.
Испытание подлинности цитрат-иона основано на образовании цитрата кальция. Характерное свойство этой соли — уменьшение растворимости при нагревании раствора. Поэтому после добавления хлорида кальция раствор остается прозрачным, а при последующем кипячении выпадает белый осадок:
Выпавший осадок растворим в хлороводородной кислоте. Цитрат (гидроцитрат)-ион можно обнаружить действием раствора ванилина в концентрированной серной кислоте. После нагревания на водяной бане в течение 5 мин и последующего добавления воды возникает зеленое окрашивание.
При нагревании натрия цитрата с уксусным ангидридом и пиридином или несколькими кристаллами никотиновой кислоты появляется карминово-красное окрашивание. Винная кислота и ее соли в этих условиях приобретают зеленую окраску.
При сплавлении цитратов с мочевиной или резорцином образуются флуоресцирующие продукты.
Прибавление к натрия цитрату бромной воды и нескольких капель разведенной азотной кислоты приводит к образованию белого кристаллического осадка пентабромацетона:
Эту химическую реакцию используют для гравиметрического определения натрия цитрата.
Учитывая, что способы получения солей карбоновых кислот основаны на взаимодействии карбоновых кислот с карбонатами, при испытании на чистоту устанавливают пределы кислотности или щелочности. Для выполнения испытаний используют определение рН растворов, титрование со специально подобранными индикаторами.
Количественно соли щелочных металлов можно определить методом кислотно-основного титрования. Калия ацетат, представляющий собой соль сильного основания и слабой кислоты, титруют в водной среде раствором хлороводородной кислоты:
Индикатором служит раствор тропеолина 00 (pH перехода 1,3–3,2).
ФС рекомендует проводить титрование калия ацетата в неводной среде. Навеску растворяют в ледяной уксусной кислоте и титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый):
Аналогично в неводной среде определяют количественное содержание натрия цитрата и натрия вальпроата, используя в качестве индикатора 1-нафтолбензеин или кристаллический фиолетовый. Определить содержание натрия вальпроата можно в водной среде, титруя 0,5 М раствором хлороводородной кислоты (индикатор метиловый оранжевый).
Натрия цитрат определяют, используя ионообменную хроматографию в сочетании с алкалиметрией. Навеску натрия цитрата растворяют и пропускают через колонку с катионитом КУ-2 в Н-форме. Происходит обмен ионов:
Затем колонку промывают и фильтрат с промывными водами, содержащими лимонную кислоту, титруют 0,05 М раствором щелочи.
Метод обратного аргентометрического титрования натрия цитрата основан на образовании трудно растворимой трехзамещенной соли серебра:
К навеске натрия цитрата прибавляют в мерной колбе двойной избыток 0,1 М раствора нитрата серебра. Для уменьшения растворимости соли серебра в реакционную смесь добавляют этанол. Осадок отфильтровывают и избыток нитрата серебра титруют 0,1 М раствором тиоцианата аммония (индикатор железоаммониевые квасцы).
Известен также куприметрический метод определения натрия цитрата, основанный на образовании медноцитратного комплексного соединения с сульфатом меди (II). Анализ выполняют в слабощелочной среде, которую создают с помощью гидрокарбоната натрия или оксида магния. Титруют 0,05 М раствором сульфата меди в присутствии индикаторной смеси мурексида до исчезновения фиолетового и появления зеленого окрашивания.
Кальциевые соли карбоновых кислот (кальция лактат и кальция глюконат) количественно определяют комплексонометрическим методом. Методика идентична определению неорганических лекарственных веществ кальция (см. ч. II, гл. 16).
Соли карбоновых кислот следует хранить в сухом месте в хорошо укупоренной таре, учитывая их гигроскопичность (калия ацетат) или возможность потери кристаллизационной воды (кальция лактат, кальция глюконат, натрия цитрат). Натрия вальпроат хранят в сухом, прохладном, защищенном от света месте при температуре до 25 °C в хорошо укупоренной таре (расплывается на воздухе).
Соли карбоновых кислот применяют в медицине для различных целей. Калия ацетат используют в качестве источников ионов калия (при гипокалиемии) и диуретического средства. Кислота вальпроевая и её натриевая соль составляют новую группу противоэпилептических средств широкого спектра действия. Натрия цитрат применяют для консервации (предупреждения свертывания) крови в виде 4–5%-ного раствора. Кальция лактат и кальция глюконат используют как источники ионов кальция и в качестве антиаллергического средства.
ГЛАВА 24.
ПРОСТЫЕ ЭФИРЫ
Простые эфиры (этеры) представляют собой кислородсодержащие органические соединения с общей формулой R–O–R1.
В медицинской практике применяют лекарственные препараты диэтилового эфира: эфир медицинский и эфир для наркоза. Впервые диэтиловый эфир был получен в 1540 г. В.Кордусом, но затем это открытие было забыто и в XIX в. его «открыли» вновь (Сессюр в 1807 г. и Гей-Люссак в 1815 г.). Современный промышленный синтез диэтилового эфира проводят путём дегидратации при 135 °C этилового спирта под действием концентрированной серной кислоты в специальных аппаратах — эфиризаторах. Процесс идет в несколько стадий. Вначале образуется этилсерная кислота (этилсульфат):
Этилсерная кислота взаимодействует с избытком этилового спирта, образуя диэтиловый эфир:
Полученный эфир отгоняют в приемник. Для получения максимального выхода необходимо поддерживать оптимальный температурный режим (130–140 °C).
Более экономичным является получение диэтилового эфира из этилена одновременно с получением этилового спирта:
Гидратация этилена до этилсульфатов происходит в присутствии 96-98%-ной серной кислоты при температуре 65-75 °C и давлении 2,5 МПа. Затем в результате гидролиза этилсульфатов (при 95-100 °C и 0,2 МПа) образуется диэтиловый эфир:
При несоблюдении технологического режима синтеза происходит образование побочных продуктов по схеме:
Примерная схема образования побочных продуктов
при получении диэтилового эфира
Образующиеся при получении эфира побочные продукты по химическим свойствам можно разделить на четыре группы: кислоты (уксусная, сернистая и непрореагировавшая серная); пероксиды (пероксид водорода, пероксид диоксиэтила, гидропероксид ацетила, гидропероксид оксиэтила, пероксид этилидена); непредельные соединения (этилен, виниловый спирт) и альдегиды (уксусный альдегид).
При хранении диэтилового эфира (особенно при несоблюдении условий хранения) под влиянием солнечного света, кислорода воздуха происходит образование аналогичных побочных продуктов:
Примерная схема образования побочных продуктов
при хранении диэтилового эфира
Кроме того, эфир может содержать примеси воды и этилового спирта.
Для очистки от кислот и других примесей эфир промывают водой, высушивают безводным хлоридом кальция и подвергают фракционной перегонке над кристаллическим гидроксидом натрия, удаляя остатки влаги и спирта. Поскольку пероксиды могут служить причиной сильных взрывов, особую осторожность следует соблюдать при перегонке долго хранившегося диэтилового эфира. Из пероксидов самый взрывоопасный — пероксид этилидена. Для очистки от пероксидов перед фракционной перегонкой к эфиру добавляют сульфат железа (II), который восстанавливает пероксид, окисляясь до сульфата железа (III).
Дополнительную очистку эфира для наркоза проводят с помощью гидросульфита натрия и щелочного раствора перманганата калия, которые взаимодействуют с примесями непредельных соединений и альдегидов. Затем вновь промывают, сушат эфир и подвергают ректификации, отделяя фракцию, кипящую при 34–35°C.
24.1. Свойства лекарственных препаратов диэтилового эфира
| Лекарственный препарат | Химическая структура | Описание | Т. кип.,°C | Плотность, г/см 3 |
| Aether medicinalis— эфир медицинский | H5C2–O–C2H5 | Бесцветная, прозрачная, подвижная, легко воспламеняющаяся, летучая жидкость своеобразного запаха, жгучего вкуса | 34–36 | 0,714–0,717 |
| Aether pro narcosi— эфир для наркоза | H5C2–O–C2H5 | То же | 34–35 | 0,713–0,715 |
Физические свойства лекарственных препаратов диэтилового эфира очень сходны. Они различаются по температуре кипения и по плотности (табл. 24.1), т.е. степенью чистоты. Оба лекарственных препарата растворимы в 12 ч. воды, смешиваются во всех соотношениях с этанолом, бензолом, петролейным эфиром, хлороформом, жирными и эфирными маслами.
При выполнении испытаний на лекарственные препараты диэтилового эфира, при хранении и работе с ними необходимо соблюдать правила техники безопасности. Особенно следует помнить об огнеопасности (не должно быть поблизости источников огня) и взрывоопасности паров эфира.
Прежде чем выполнять фармакопейный анализ, проводят испытание на наличие пероксидов в испытуемом лекарственном препарате диэтилового эфира. Если эти соединения обнаружены, то определение температуры кипения и нелетучего остатка проводить нельзя.
Наличие пероксидов в эфире медицинском и эфире для наркоза устанавливают по реакции с иодидами:
При визуальном наблюдении не должно быть пожелтения ни эфирного, ни водного слоев.
Подлинность лекарственных препаратов диэтилового эфира подтверждают по физическим константам: температуре кипения и плотности (см. табл. 24.1).
При испытании на чистоту в обоих лекарственных препаратах устанавливают отсутствие или допустимые пределы примесей, образующихся при производстве и хранении. Примесь кислот определяют нейтрализацией водного извлечения. Примесь посторонних пахучих органических веществ (виниловый спирт и др.) устанавливают, выпаривая 10 мл эфира, который постепенно приливают на фильтровальную бумагу (не должно оставаться постороннего запаха). Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100–105 °C) 50 мл лекарственного препарата. Остаток не должен превышать 0,001 г. Примесь воды определяют методом Фишера. В эфире медицинском её допускается 0,5 г/100 мл, а в эфире для наркоза — не более 0,2%.
Примесь альдегидов определяют по реакции с реактивом Несслера:
 |
У эфира медицинского не допускается образования осадка. Может быть только помутнение нижнего слоя и желто-бурая окраска раствора. У эфира для наркоза допускается лишь слабая опалесценция, изменения окраски и помутнения реактива быть не должно.
Эфир для наркоза ввиду высокой степени чистоты должен иметь более узкие интервалы значений плотности и температуры кипения (см. табл. 24.1).
Оба лекарственных препарата относятся к списку Б. Эфир медицинский хранят в хорошо укупоренных склянках оранжевого стекла в защищенном от света месте, вдали от огня. Склянки закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой, нерастворимой в эфире, т. к. резиновые пробки разбухают от паров эфира, а стеклянные не создают должной герметичности.
Эфир для наркоза хранят в условиях, исключающих воздействие кислорода воздуха и образование пероксидных соединений, которые могут стать причиной его самовоспламенения при комнатной температуре. Сразу же после получения и очистки эфир расфасовывают во флаконы оранжевого стекла вместимостью 150 мл. Закупоривают флаконы корковой пробкой, под которую подкладывают металлическую фольгу, а поверх заливают специальной мастикой. Фольга (обычно цинковая) не только предохраняет корковую пробку от растворения, но и восстанавливает образующиеся примеси пероксидов и альдегидов:
 |
По истечении каждых 6 мес. хранения эфир для наркоза подвергают контролю в соответствии с требованиями ФС.
Эфир медицинский применяют как растворитель для приготовления настоек, экстрактов, некоторых лекарственных форм для наружного применения, а также в фармацевтическом анализе. Эфир для наркоза используют очень ограниченно, так как в настоящее время для ингаляционного наркоза применяют менее токсичные вещества (азота закись, циклопропан, галотан).
В последние годы выпускается эфир для наркоза стабилизированный (Aether pro narcosi stabilisatum). Он представляет собой эфир для наркоза, стабилизированный антиоксидантом п-фенилендиамином. Содержание п-фенилендиамина определяют методом УФ-спектрофотометрии при длине волны 309 нм (не более 0,00015%). Упаковывают эфир для наркоза стабилизированный по 140 мл во флаконы из оранжевого стекла с винтовым горлом, которые герметично закрывают металлической кронен-пробкой, а затем завинчивают колпачком из полиэтилена. Срок годности три года.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Please wait.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

We are checking your browser. gufo.me
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701e46012c7f00b4 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
📺 Видео
КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать

Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Теории кислот, оснований и растворов. Теория Брёнстеда-Лоури. 11 класс.Скачать

распознавание растворов соляной, азотной и серной кислотСкачать

25. Схема реакции и химическое уравнениеСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

С.Аррениус. Определение кислоты как вещества (видео 1) | Кислоты и Основания | ХимияСкачать