При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Уроки по неорганической химии для подготовки к ЕГЭ
- Реакции разложения
- 1) термическое разложение нерастворимых оснований (а также LiOH и Ca(OH)2):
- 2) термическое разложение нерастворимых карбонатов:
- 3) термическое разложение гидрокарбонатов:
- 4) термическое разложение некоторых кислот:
- 5) термическое разложение нитратов:
- 6) термическое разложение солей аммония:
- 7) некоторые примеры термического разложения с изменением степени окисления (разложение нитратов также идет с изменением степени окисления):
- 8) термическое разложение солей кислот хлора:
- 9) термическое разложение гидроксокомплексов:
- Что такое реакция разложения в химии? Примеры реакции разложения
- Что называется реакциями в химии, какие виды их бывают и от чего они зависят
- Что такое реакция разложения (расщепления)
- Как выглядит уравнение рассматриваемой реакции
- Виды реакций расщепления
- Реакция разложения перманганата калия (KMnO4)
- Термолиз хлората калия (KClO3)
- Электролиз и радиолиз воды (Н20)
- Расщепление алканов: метан
- Разложение этана
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Разложение солей
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Реакции разложения. Как понять?Скачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Реакции разложенияСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Химия 8 класс: Реакции разложенияСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Разложение перманганата калия
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:25. Схема реакции и химическое уравнениеСкачать

Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Видео:8 класс - Химия - Реакции разложенияСкачать

Реакции разложения
1) термическое разложение нерастворимых оснований (а также LiOH и Ca(OH)2):
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O;
2) термическое разложение нерастворимых карбонатов:
CaCO3 → CaO + CO2
FeCO3 → FeO + CO2
MgCO3 → MgO + CO2;
3) термическое разложение гидрокарбонатов:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O;
4) термическое разложение некоторых кислот:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
H2SiO3 → SiO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
5) термическое разложение нитратов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду напряжений металлов правее Cu. |
6) термическое разложение солей аммония:
NH4Cl → NH3 + HCl
(NH4)3PO4 → H3PO4 + 3NH3
(NH4)2CO3 → 2NH3 + CO2+ H2O
NH4HCO3 → NH3 + CO2+ H2O
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O
NH4NO2 → N2 + H2O
7) некоторые примеры термического разложения с изменением степени окисления (разложение нитратов также идет с изменением степени окисления):
2H2O2 → 2H2O + O2
2KMnO4 → K2MnO4 + MnO2 + O2
8) термическое разложение солей кислот хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
9) термическое разложение гидроксокомплексов:
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
Видео:Реакции разложенияСкачать

Что такое реакция разложения в химии? Примеры реакции разложения
Реакции разложения играют большую роль в жизни планеты. Ведь именно они способствуют уничтожению отходов жизнедеятельности всех биологических организмов. Кроме того, этот процесс ежедневно помогает человеческому телу усваивать различные сложные соединения путем расщепления их на простые (катаболизм). Помимо всего перечисленного, данная реакция способствует образованию простых органических и неорганических веществ из сложных. Давайте узнаем больше об этом процессе, а также рассмотрим практические примеры химической реакции разложения.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Что называется реакциями в химии, какие виды их бывают и от чего они зависят
Прежде чем изучить информацию о разложении, стоит узнать о химических процессах в целом. Под этим названием подразумевается способность молекул одних веществ взаимодействовать с другими и образовывать таким способом новые соединения.
К примеру, если между собою провзаимодействуют кислород и две молекулы водорода, в результате получится две молекулы оксида гидрогена, который мы все знаем под названием вода. Данный процесс можно записать с помощью такого химического уравнения: 2Н2↑ + О2↑ → 2Н2О.
Хотя существуют разные критерии, по которым различают химические реакции (тепловой эффект, катализаторы, наличие/отсутствие границ раздела фаз, изменение степеней окисления реагентов, обратимость/необратимость), чаще всего их классифицируют по типу превращения взаимодействующих веществ.
Таким образом, выделяется четыре вида химических процессов.
Все вышеперечисленные реакции графически записываются с помощью уравнений. Общая их схема выглядит таким образом: А → Б.
В левой части этой формулы находятся исходные реагенты, а в правой – вещества, образующиеся вследствие реакции. Как правило, для ее начала необходимо воздействие температурой, электричеством или использование катализирующих добавок. Их наличие также должно указываться в химическом уравнении.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Что такое реакция разложения (расщепления)
Для этого вида химического процесса характерно образование двух и больше новых соединений из молекул одного вещества.
Говоря более простым языком, реакцию разложения можно сравнить с домиком из конструктора. Решив построить машинку и кораблик, ребенок разбирает начальное строение и из его деталей сооружает желаемое. При этом структура самих элементов конструктора не меняется, так же как это происходит с атомами вещества, участвующего в расщеплении.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как выглядит уравнение рассматриваемой реакции
Несмотря на то, что на разъединение сложного вещества на более простые составляющие способны сотни соединений, все подобные процессы происходят по одному принципу. Изобразить его можно с помощью схематической формулы: АБВ → А+Б+В.
В ней АБВ – это начальное соединение, подвергшееся расщеплению. А, Б и В – это вещества, образованные из атомов АБВ в процессе реакции разложения.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Виды реакций расщепления
Как уже было сказано выше, чтобы начать какой-то химический процесс, часто необходимо оказать определенное воздействие на реагенты. В зависимости от типа подобной стимуляции, выделяют несколько видов разложения:
- Биорасщепление (биологическое разложение). Его суть — в распаде более сложных соединений на простые под воздействием живых организмов (микроорганизмов). Иллюстрацией данного процесса может быть гниение или разложение мусора.
Термолизом называется расщепление веществ под воздействием высоких температур. У этого вида есть подвид – пиролиз. При реакции разложения такого вида для ее проведения вещества не только подогревают, но и лишают доступа кислорода и других окислителей к ним.
Электролизом именуется расщепление соединений с помощью электрического тока.
Радиолиз – распад вещества под воздействием ионизирующего излучения. Кстати, этот процесс активно используется в лучевой терапии.
Реакция разложения перманганата калия (KMnO4)
Разобравшись с теорией, стоит рассмотреть практические примеры процесса расщепления веществ.
Первым из них станет распад KMnO4 (в простонародье именуется марганцовкой) вследствие нагревания. Уравнение реакции разложения перманганата калия выглядит таким образом: 2KMnO4 (t 200°С) → K2MnO4 + MnO2 + O2↑.
Из представленной химической формулы видно, что для активации процесса необходимо нагреть исходный реагент до 200 градусов по Цельсию. Для лучшего протекания реакции марганцовку помещают в вакуумный сосуд. Из этого можно сделать вывод, что данный процесс является пиролизом.
В лабораториях и на производстве он проводится для получения чистого и контролируемого кислорода.
Термолиз хлората калия (KClO3)
Реакция разложения бертолетовой соли — это еще один пример классического термолиза в чистом виде.
Проходит упоминаемый процесс в два этапа и выглядит таким образом:
Также термолиз хлората калия можно провести и при более низких температурах (до 200 °С) в один этап, но для этого нужно, чтобы в реакции приняли участие катализирующие вещества – оксиды различных металлов (купрум, ферум, манган и т. п.).
Уравнение такого рода будет выглядеть таким образом: 2KClO3 (t 150 °С , MnO2) → KCl + 2О2.
Как и перманганат калия, бертолетова соль используется в лабораториях и промышленности для получения чистого кислорода.
Электролиз и радиолиз воды (Н20)
Еще одним интересным практическим примером рассматриваемой реакции будет разложение воды. Его можно произвести двумя способами:
- Под воздействием на оксид гидрогена электрического тока: Н2О → Н2↑ + О2↑. Рассматриваемый способ получения кислорода используют подводники на своих субмаринах. Также в будущем его планируют употреблять для получения водорода в больших количествах. Главным препятствием для этого сегодня являются огромные энергетические затраты, необходимые для стимуляции реакции. Когда будет найден способ их минимизировать, электролиз воды станет основным способом производства не только водорода, но и кислорода.
- Расщепить воду можно и при воздействии на нее альфа-излучением: Н2О → Н2О + +е — . В результате этого молекула оксида гидрогена теряет один электрон, ионизируясь. В таком виде Н2О + снова вступает в реакцию с другими нейтральными молекулами воды, образуя высокореактивный гидроксид-радикал: Н2О+ Н2О + → Н2О + ОН. Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н2О + е — → Н + ОН.
Расщепление алканов: метан
Рассматривая различные способы разъединения сложных веществ, стоит уделить особое внимание реакции разложения алканов.
Под этим названием скрываются предельные углеводороды с общей формулой СХН2Х+2. В молекулах рассматриваемых веществ все атомы карбона соединены одинарными связями.
Представители этого ряда встречаются в природе во всех трех агрегатных состояниях (газ, жидкость, твердое тело).
Все алканы (реакция разложения представителей этого ряда — ниже) легче воды и не растворяются в ней. При этом они сами являются отличными растворителями для других соединений.
Среди основных химических свойств таких веществ (горение, замещение, галогенирование, дегидрирование) — и способность расщепляться. Однако данный процесс может происходить как полностью, так и частично.
Вышеупомянутое свойство можно рассмотреть на примере реакции разложения метана (первый член алканового ряда). Этот термолиз происходит при 1000 °С: СН4↑ → С+2Н2↑.
Однако если проводить реакцию разложения метана при более высокой температуре (1500 °С), а потом резко снизить ее, этот газ расщепится не полностью, образуя этилен и водород: 2СН4↑ → C2H4↑ + 3H2↑.
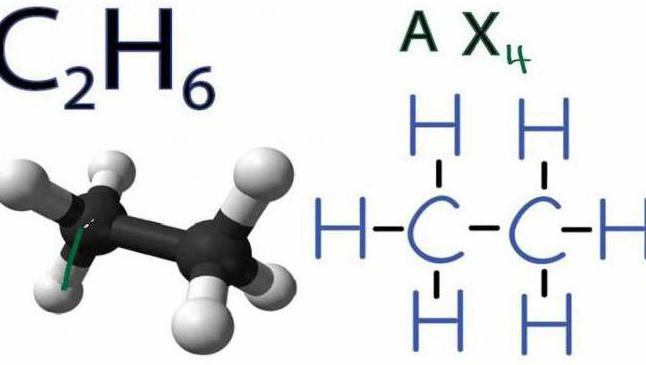
Разложение этана
Второй член рассматриваемого алканового ряда — это С2Н4 (этан). Реакция разложения его происходит также под воздействием высокой температуры (50 °С) и при полном отсутствии кислорода или других окислителей. Выглядит она следующим образом: C2H6↑ → C2H4↑ + H2↑.
Представленное выше уравнение реакции разложения этана до водорода и этилена нельзя считать пиролизом в чистом виде. Дело в том, что данный процесс происходит с присутствием катализатора (например, металла никеля Ni или водяного пара), а это противоречит определению пиролиза. Поэтому о представленном выше примере расщепления корректно говорить как о процессе разложения, происходящем при пиролизе.
Стоит отметить, что рассмотренная реакция в промышленности широко используется для получения самого производимого органического соединение в мире – газа этилена. Однако из-за взрывоопасности C2H6 чаще этот простейший алкен синтезируют из других веществ.
Рассмотрев определения, уравнение, виды и различные примеры реакции разложения, можно сделать вывод, что она играет очень большую роль не только для человеческого организма и природы, но и для промышленности. Также с ее помощью в лабораториях удается синтезировать многие полезные вещества, что помогает ученым проводить важных химические исследования.