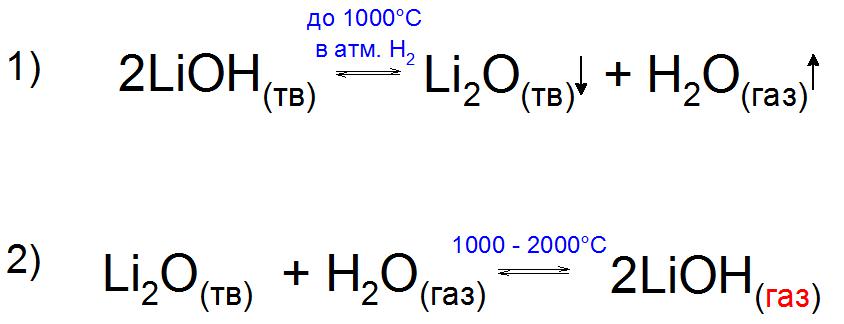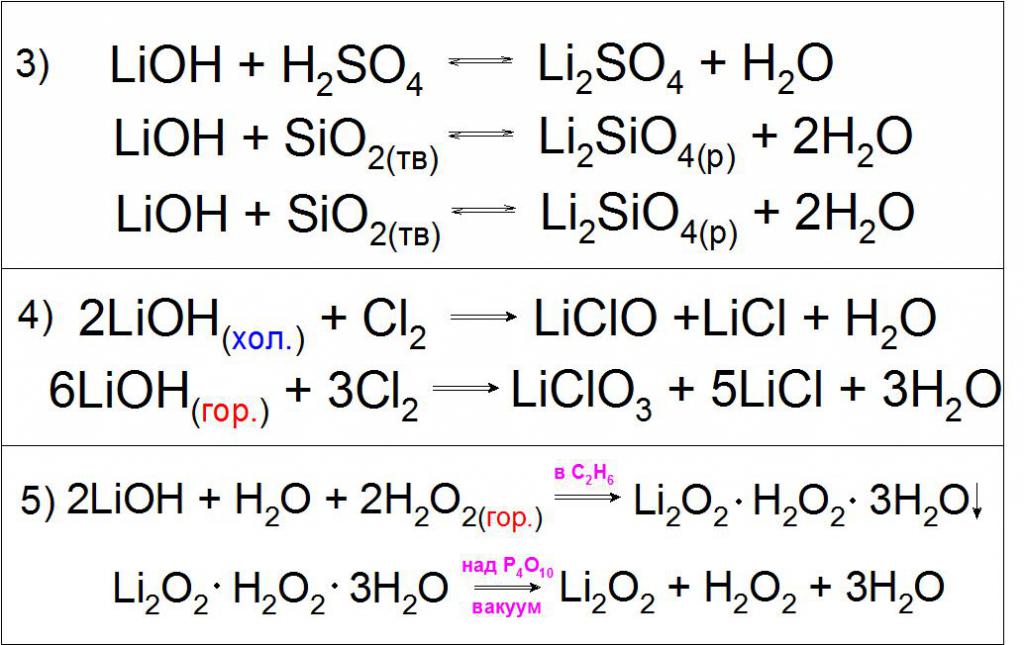Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
- Способы получения
- Качественная реакция
- Химические свойства
- 1)Напишите уравнение реакции диссоциации гидроксида лития 2)Напишите молекулярные и ионные уравнения взаимодействия раствора гидроксида лития с веществами : а) серная кислота б) оксид фосфора(V)в) гид?
- Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития?
- Высший гидроксид, его характер?
- Помогите?
- Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов а) хлорида железа и гидроксида натрия, б) серно кислоты и гидроксида лития, в ) азотной кислоты и карбоната натрия?
- Гидроксид лития и соляная кислота , Сульфат натрия и соляная кислота , Гидроксид магния и сульфит лития , Написать уравнение реакции полное ионное уравнение и сокращённое ионное уравнение?
- Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития, ребят, срочно?
- С какими из перечисленных веществ — гидроксид калия, алюминий, оксид серы (IV), оксид железа (III), нитрат бария, медь, гидроксид цинка — будет реагировать раствор серной кислоты?
- Составьте молекулярные и ионные уравнения реакций, характерезующих химические свойства гидроксида лития?
- Запишите молекулярное и ионное уравнение реакций между карбонатом лития — гидроксидом калия?
- Напишите молекулярные и ионные уравнения реакций раствора серной кислоты : а) алюминием б) оксидом цинка в) раствором гидроксида кальция, г) раствором хлорида бария?
- Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
- Особенности строения атома лития
- Физические свойства
- Химические свойства
- Получение
- Применение
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Видео:Получение гидроксида лития | Preparation of lithium hydroxideСкачать

Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет .
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид лития реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
6. Гидроксид лития взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li + + OH —
10. Гидроксид лития в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

1)Напишите уравнение реакции диссоциации гидроксида лития 2)Напишите молекулярные и ионные уравнения взаимодействия раствора гидроксида лития с веществами : а) серная кислота б) оксид фосфора(V)в) гид?
Химия | 10 — 11 классы
1)Напишите уравнение реакции диссоциации гидроксида лития 2)Напишите молекулярные и ионные уравнения взаимодействия раствора гидроксида лития с веществами : а) серная кислота б) оксид фосфора(V)в) гидроксид цинка г) нитрат серебра.
3)Сравните записнные вами ионные уравнения с ионными уравнениями, которые записал ваш сосед по парте.
4)Сформулируйте вывод о причинах общности химических свойств разных щелочей и запишите его в тетрадь.
1. LiOH (стрелочка диссоциации) Li( + ) + OH( — )
A) 2LiOH + H2SO4 = (Li)2SO4 + 2H2O
б) 6LiOH + P2O5 = 2(Li)3PO4 + 3H2O
в) не идет реакция
г) LiOH + AgNO3 = LiNO3 + AgOH.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития?
Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития.
Видео:Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Высший гидроксид, его характер?
Высший гидроксид, его характер.
Гидроксид лития — это основание, растворимое в воде, — щёлочь.
Это соединение образованно за счёт ионной химической связи между — — — — — — — (7 клеток) ионом Li + и — — — — — — — (7 клеток) ионом OH — .
Гидроксид лития взаимодействует с солью(напишите молекулярное и ионное уравнение реакции).
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Помогите?
Напишите уравнения реакции в молекулярном и ионном виде между а) фосфорной кислотой с гидроксидом калия ; б) серной кислотой с оксидом цинка.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов а) хлорида железа и гидроксида натрия, б) серно кислоты и гидроксида лития, в ) азотной кислоты и карбоната натрия?
Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов а) хлорида железа и гидроксида натрия, б) серно кислоты и гидроксида лития, в ) азотной кислоты и карбоната натрия.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Гидроксид лития и соляная кислота , Сульфат натрия и соляная кислота , Гидроксид магния и сульфит лития , Написать уравнение реакции полное ионное уравнение и сокращённое ионное уравнение?
Гидроксид лития и соляная кислота , Сульфат натрия и соляная кислота , Гидроксид магния и сульфит лития , Написать уравнение реакции полное ионное уравнение и сокращённое ионное уравнение.
Видео:Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития, ребят, срочно?
Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития, ребят, срочно!
Видео:Электролиз. 10 класс.Скачать

С какими из перечисленных веществ — гидроксид калия, алюминий, оксид серы (IV), оксид железа (III), нитрат бария, медь, гидроксид цинка — будет реагировать раствор серной кислоты?
С какими из перечисленных веществ — гидроксид калия, алюминий, оксид серы (IV), оксид железа (III), нитрат бария, медь, гидроксид цинка — будет реагировать раствор серной кислоты?
Напишите уравнения возможных реакций, для реакций ионного обмена напишите сокращенные ионные уравнения.
Видео:Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Составьте молекулярные и ионные уравнения реакций, характерезующих химические свойства гидроксида лития?
Составьте молекулярные и ионные уравнения реакций, характерезующих химические свойства гидроксида лития.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Запишите молекулярное и ионное уравнение реакций между карбонатом лития — гидроксидом калия?
Запишите молекулярное и ионное уравнение реакций между карбонатом лития — гидроксидом калия.
Видео:Основания, их классификация | Химия 8 класс #45 | ИнфоурокСкачать

Напишите молекулярные и ионные уравнения реакций раствора серной кислоты : а) алюминием б) оксидом цинка в) раствором гидроксида кальция, г) раствором хлорида бария?
Напишите молекулярные и ионные уравнения реакций раствора серной кислоты : а) алюминием б) оксидом цинка в) раствором гидроксида кальция, г) раствором хлорида бария.
На этой странице сайта, в категории Химия размещен ответ на вопрос 1)Напишите уравнение реакции диссоциации гидроксида лития 2)Напишите молекулярные и ионные уравнения взаимодействия раствора гидроксида лития с веществами : а) серная кислота б) оксид фосфора(V)в) гид?. По уровню сложности вопрос рассчитан на учащихся 10 — 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
4)HCl + Fe(OH)2 = FeCl2 + H2O.
Метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан. Каждый раз на один углерод больше. Изомеры : сначала находите главную цепь (в той, которой больше углеродов), для удобства ее можно обвести, затем смотрите какие есть ответвле..
Вещества в природе огромное количество. В основном это руды металлов с неметаллами. Газы в воздухе. Физические явления явления меняющие агрегатные состояния, массы. Химические которые из одного вещества, получают существенно другое вещество.
А — 4 W(O2) = ((16×2) / 58) * 100% = 55. 2% Б — 3 W(O2) = ((16×7) / 183) * 100% = 61. 2%.
Решение есть на фото #####.
Решение задачи находится на фото.
9 — 2 10 = 2 11 = 4 12 = 3 13 = 2 14 = 2 15 = 1 16 = 4.
Наверное SiH4 — гидрид кремния PCL3 — хлорид фосфора (3).
1. HI (Йодоводородная кислота) 2. SiO₂ (Оксид кремния) 3. PbO₂ (Оксид свинца) 1. HI + KOH = KI + H₂O H⁺ + I⁻ + K⁺ + OH⁻ = K⁺ + I⁻ + H₂O H⁺ + OH⁻ = H₂O 2. SiO + KOH = К₂SiO₃ + H₂O 3. PbO + KOH = K₂PbO₂ + H₂O.
Космохимия — изучает состав небесных тел ( планет, звезд), законы распространенности и распределения элементов во Вселенной ; Биохимия — изучает химический состав живых клеток и организмов, а также о лежащих в основе их жизнедеятельности химических п..
Видео:Решение цепочек превращений по химииСкачать

Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
Что такое гидроксид лития? Это соединение является одним из важнейших термоустойчивых соединений, используемых в производстве для получения различных солей лития. Ионы этого элемента обладают рядом характерных особенностей, которые нашли свое широкое применение в химическом производстве.
Видео:Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Особенности строения атома лития
Литий (Li) является элементом I группы основной подгруппы 2-го периода, и относится к группе щелочных металлов. Его часто называют переходным к щелочноземельным элементам, поскольку он имеет немного меньшую активность, чем следующие представители этой группы, например, натрий (Na) или калий (K).
Атом лития обладает самым маленьким радиусом среди всех щелочных металлов, что обуславливает его химическую активность. Также особую роль играет предшествующая валентному электрону 2s 1 устойчивая электронная оболочка 1s 2 типа гелия, которая создает высокую поляризуемость частицы.
Это свойство лития характеризует возникновение электромагнитных или дипольных полей вокруг атома, что позволяет создавать прочные комплексные ионы вроде [Li(NH3)n] + . Стоит отметить, что при таких свойствах сам атом не подвержен поляризации, что объясняет термическую неустойчивость некоторых его солей, в особенности с комплексными анионами.
Все вышеперечисленные факты объясняют некоторые особенности в физических и химических свойствах гидроксида лития (LiOH).
Видео:Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Физические свойства
Чистый LiOH – очень едкое вещество, способное разрушить стекло и фарфор, поэтому его хранят в парафинированных сосудах. В расплавленном состоянии его можно получить только в никелевых или серебряных сосудах, так как он окисляет большинство металлов и сплавов. Золото является одним из немногих веществ, устойчивых к влиянию подобного соединения.
Само основание, по сравнению с окисью Li2O, химически неустойчиво и уже ближе к 1000 °C в атмосфере водорода H2 разлагается на составляющие (пример 1).
Оксид лития и гидроксид лития в химически чистом состоянии являются твердыми веществами, относительно растворимы в воде, но менее (почти в 5 раз), чем аналогичные соединения следующих представителей группы. Высшая точка растворения у описываемого основания приходится при 100 °C – 17,5 г/100 г растворителя, тогда как, например, у гидроксида натрия (NaOH) — 337 г/100 г и продолжает расти с повышением температуры. В то же время растворимость гидроксида лития практически в 100 раз больше растворимости гашеной извести (Ca(OH)2), у которой такая способность снижается с повышением температуры.
Интересно, что экспериментально удалось получить газообразный LiOH в присутствии паров воды. Его получают путем нагревания оксида Li до 2000 °C, когда после рубежа в 1000 °C давление пара этого соединения увеличивается за счет образования устойчивого родственного основания (пример 2).
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

Химические свойства
Гидроксид лития кислотой не считается, так как не является амфотерным элементом и не проявляет способности к распаду по типу MeOH ↔ MeO — + H + (где, Me — любой металл I или II группы основной подгруппы), как и другие представители щелочных металлов. Про такие соединения говорят, что они являются очень сильными основаниями, так как константа их диссоциации по принципу MeOH ↔ Me + + OH — очень высокая (Кb, LiOH = 6,75 · 10 -1 ).
Поскольку подобное соединение проявляет сильные основные свойства, оно может вступать в реакции нейтрализации с кислотами, кислотными оксидами и обмена с различными солями (пример 3).
Также характерной реакцией является взаимодействие холодных и горячих концентрированных растворов гидроксида лития с газообразным хлором с образованием гипохлоритов и хлоратов лития (пример 4).
Особенностью данного основания является взаимодействие с горячим раствором перекиси водорода H2O2 с образованием кристаллогидрата перекисного лития Li2O2 в среде этанола, разделяемый в вакууме (пример 5).
Видео:Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Получение
LiOH получают различными способами, одним из которых является непосредственное взаимодействие металла или его оксида с водой по схеме литий → оксид лития → гидроксид лития.
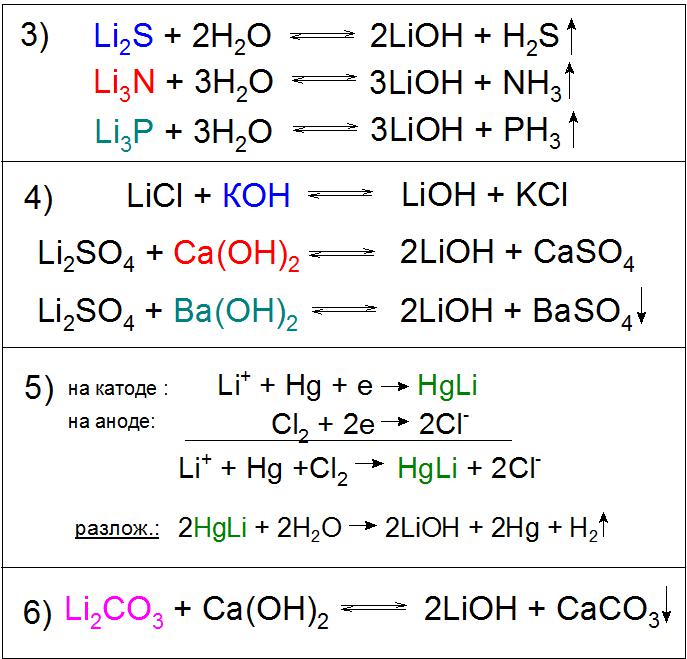
Также применяется гидролиз сульфида, нитрида, фосфидов и других соединений (пример 3).
Реакции обмена растворов солей лития возможны практически с любыми основаниями, например гидроксидом калия (KOH), кальция (Ca(OH)2) и бария (Ba(OH)2), причем с последним реагентом химическое взаимодействие идет практически до конца с сульфатом Li. В первом и втором случае реакция будет оправдана за счет плохой растворимости получаемых солей в растворе LiOH (пример 4), а в третьем — к этому прибавится нерастворимое в воде BaSO4 (пример 4). Стоит отметить, что последний вариант не используется на производстве по экономическим соображениям.
Еще одним примечательным методом получения данного соединения является электролиз раствора хлорида лития LiCl на ртутном катоде. При этом образуется амальгама HgLi, интересная тем, что температура ее плавления гораздо выше (609 °C), чем любого ее компонента. В процессе разложения водой полученного соединения образуется необходимое основание (пример 5).
Особенное промышленное значение имеет реакция разложения карбоната лития гашеной известью, в ходе которого химическое равновесие искусственно сдвигается в правую сторону для более высокого выхода основного продукта (пример 6).
Видео:Химия 11 класс Теория электролитической диссоциацииСкачать

Применение
Гидроксид лития используется при получении стеаратов этого металла для производства водоупорных морозо- и термостойких смазочных материалов. Также применяется в качестве катализатора при изготовлении полимерных материалов и как компонент электролита в различных аккумуляторах.
В пожарной и военной практике гидроксид лития используется как поглотитель углекислого газа (CO2) в противогазах.