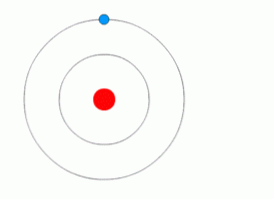
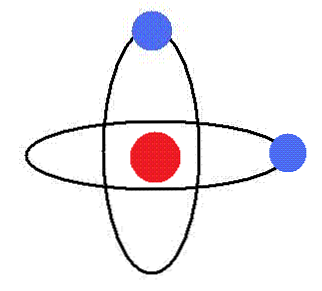
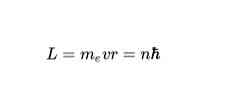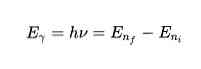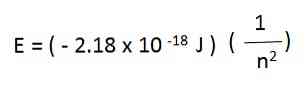Самым простым химическим элементом с точки зрения строения атома является водород. Его ядро содержит всего лишь один протон, вокруг которого вращается один электрон. Такая модель атома водорода получила название модель Бора (см. рис.1).
Электрон притягивается к ядру за счет электростатических сил взаимодействия. Однако электрон не падает на ядро, поскольку вращается вокруг него на большой скорости. На вращающийся электрон действует центробежная сила. Центростремительная (электростатическая) сила Fцс, связывающая заряженные частицы, и центробежная сила Fцб, стремящаяся оторвать электрон от ядра, на определенном расстоянии между заряженными частицами уравновешивают друг друга.
Это уравнение выражает условие устойчивости орбиты электрона в атоме.
Подставим в формулу (2.1) выражения для этих сил, получим
| = |
|
| (2.2) |
где me, V и R — инерционная масса электрона, скорость движения электрона по орбите и радиус орбиты атома водорода, а ε0, q и Z — электрическая постоянная, заряд электрона и протона, соответственно.
Для расчета радиуса орбиты электрона в атоме водорода, который получил название Боровского радиуса, из этого равенства, необходимо знать скорость электрона. Однако, этот параметр непосредственно измерить не представляется возможным.
Рис. 1 Боровская модель атома водорода
Зато можно измерить энергию ионизации или потенциал ионизации (ПИ) — минимальную энергию, что необходима для отрыва электрона от ядра атома. Так, если поместить атомы водорода в электростатическое поле и сообщить им количество энергии, необходимое для отрыва электрона от ядра, то в системе возникнет направленное движение электронов, т.е. электрический ток, который зафиксируется приборами.
Поскольку все атомы, кроме атома водорода, имеют более одного электрона, то различают первый, второй и т.д. потенциалы ионизации. Ясно, что второй потенциал ионизации для одного и того же атома будет несравненно больше первого, так как электрон приходится отрывать от положительно заряженного иона. Таким образом, первый потенциал ионизации (ППИ) действительно соответствует минимальной энергии.
Потенциальная энергия электрона Е в атоме водорода, согласно теореме вириала равна удвоенному потенциалу ионизации:
Измеренное значение для атомов водорода Е = 2·1311,6 ≈ 2623 кДж/моль, или в расчете на один атом
Е = 2623: (6,02 ·10 23 )= 435 ·10 -23 кДж/моль
Зная потенциал ионизации, и используя формулу для электростатической энергии электрона, находящегося на расстоянии R от протона
| Ea= |
| · |
мы получаем выражение для расчета орбиты электрона в атоме:
где ε 0 = 8,85·10 -12 Ф/м — электрическая постоянная; 10 3 — переход от кДж к Дж; заряд в квадрате, так как протон и электрон имеют одинаковые абсолютные значения заряда. В наших расчетах мы не прибегали ни к каким предположениям относительно особых свойств электрона, а исходили исключительно из уравнений, описывающих энергетические взаимодействия в системе. Размер атомного ядра составляет примерно 10 -4 нм. Представить себе соотношение размеров ядра и атома можно, если предположить, что ядро имеет размер шарика для пинг-понга (примерно 5 см в диаметре), тогда атом будет иметь размеры, близкие к размерам стадиона в Лужниках. Теперь давайте посмотрим, какова зависимость между зарядом ядра и энергией системы для водородоподобных атомов (имеющих только один электрон), найденная экспериментально и теоретически (расчетным путем). Эти данные приведены в табл. 1. Таблица 1. Энергия ионизации водородоподобных атомов Энергия ионизации, кДж/моль Расхождение между расчетным и экспериментальным значениями Экспериментально найденная зависимость энергии ионизации атома от заряда ядра хорошо описывается уравнением: где Ez — энергия ионизации водородоподобного атома с зарядом ядра Z; Ен — энергия ионизации атома водорода. Как следует из данных табл. 1, расхождение между расчетным и найденным экспериментально значениями энергии ионизации, не превышает 0,1%. Таким образом, энергия ионизации водородоподобных атомов пропорциональна квадрату заряда ядра. Из теоремы вириала следует, что энергия системы пропорциональна произведению зарядов ядра и электрона, а в соответствии с уравнением (2.6) мы можем записать, что т.е. энергия системы пропорциональна заряду ядра атома в первой степени. Поскольку речь идет об одной и той же энергии системы, то из кажущего несоответствия — пропорциональности энергии квадрату заряда ядра (эксперимент; уравнение (2.6)) и первой степени этого же заряда (терема вириала; уравнение (2.7)) — можно сделать вывод, что при увеличении заряда ядра пропорционально уменьшается радиус атома. Теорема вириала была выведена из предположения о том, что в атоме действуют только известные механические (центробежная) и электростатическая силы. Тот факт, что энергия атома зависит только от взаимодействующих зарядов (от заряда ядра, в частности), свидетельствует о том, что в атоме действительно действуют только электрические, кулоновские силы. Квадратичная зависимость очевидна. Известно, что энергия притяжения (потенциальная энергия) между двумя зарядами пропорциональна произведению этих зарядов (или квадрату заряда в случае их идентичности) и обратно пропорциональна расстоянию между ними. В атомных системах при увеличении заряда ядра расстояния между ядрами и электронами пропорционально уменьшаются. Такая зависимость приводит к непропорциональному увеличению потенциальной энергии при увеличении заряда ядра. Содержание
Видео:Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать  Уравнение условия устойчивости орбиты электрона в атоме |
| Элементарная теория Бора |   |
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
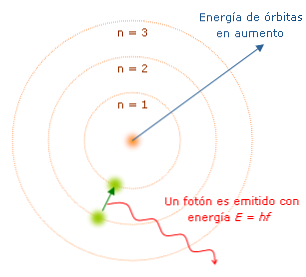
Бор высказал предположения, которые были названы постулатами Бора. · Первый постулат(постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию. · Второй постулат(правило частот): излучение и поглощение энергии в виде кванта света (hn) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона: Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка:
где n = 1, 2, 3,… – главное квантовое число. Получим выражение для энергии электрона в атоме. Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью
Уравнение движения электрона имеет вид:
Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
Радиус первой орбиты водородного атома называют боровским радиусом. При n =1, Z = 1 для водорода имеем: Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром: Из уравнения движения электрона следует, что Подставим сюда выражение для радиуса первой орбиты и получим:
Здесь учтено, что постоянная Планка Для атома водорода при Z = 1 имеем:
Из формулы (6.3.6) видно, что Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7. При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией: Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга: Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8). Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика. Видео:94. Теория Бора водородоподобных атомовСкачать  Атомная модель характеристик Бора, постулаты, ограниченияАтомная модель Бора Это изображение атома, предложенное датским физиком Нилсом Бором (1885-1962). Модель утверждает, что электрон движется по орбите на фиксированном расстоянии вокруг атомного ядра, описывая равномерное круговое движение. Орбиты — или энергетические уровни, как он их назвал — имеют разную энергию. Каждый раз, когда электрон меняет орбиту, он испускает или поглощает энергию в фиксированных количествах, называемых «квантами». Бор объяснил спектр света, испускаемого (или поглощаемого) атомом водорода. Когда электрон движется от одной орбиты к другой в направлении ядра, происходит потеря энергии, и излучается свет с длиной волны и энергетическими характеристиками.. Бор пронумеровал энергетические уровни электрона, считая, что чем ближе электрон к ядру, тем ниже его энергетическое состояние. Таким образом, чем дальше электрон находится от ядра, тем выше будет уровень энергетического уровня и, следовательно, энергетическое состояние будет выше..
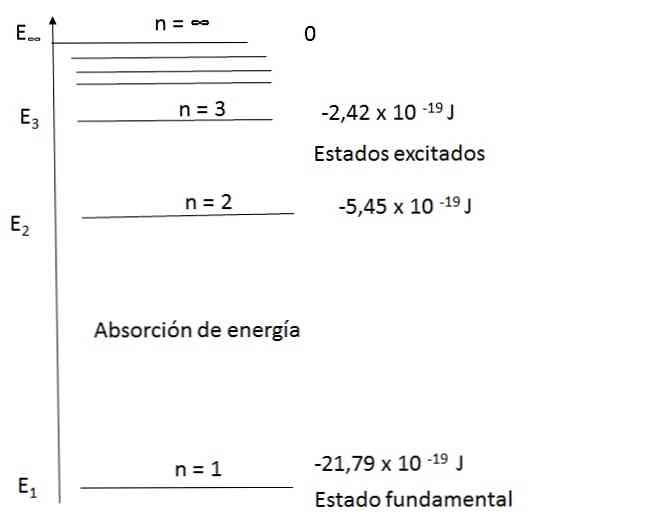
Видео:Движение электронов в атоме. 1 часть. 8 класс.Скачать  Основные характеристикиХарактеристики модели Бора важны, потому что они определили путь к разработке более полной атомной модели. Основными из них являются: Он основан на других моделях и теориях того времениМодель Бора была первой, в которой использовалась квантовая теория, поддерживаемая атомной моделью Резерфорда, и идеи, взятые из фотоэлектрического эффекта Альберта Эйнштейна. На самом деле Эйнштейн и Бор были друзьями. Экспериментальные доказательстваСогласно этой модели, атомы поглощают или испускают излучение только тогда, когда электроны прыгают между разрешенными орбитами. Немецкие физики Джеймс Франк и Густав Герц получили экспериментальные доказательства этих состояний в 1914 году. Электроны существуют на энергетических уровняхЭлектроны окружают ядро и существуют на определенных энергетических уровнях, которые являются дискретными и которые описаны в квантовых числах. Энергетическое значение этих уровней существует как функция от числа n, называемого основным квантовым числом, которое можно рассчитать с помощью уравнений, которые будут подробно описаны ниже.. Без энергии нет движения электронаНа рисунке выше показан электрон, который совершает квантовые скачки. Согласно этой модели, без энергии нет движения электрона с одного уровня на другой, так же как без энергии невозможно поднять предмет, который упал, или отделить два магнита.. Бор предложил квант как энергию, необходимую электрону для перехода с одного уровня на другой. Он также заявил, что самый низкий энергетический уровень, занимаемый электроном, называется «основным состоянием». «Возбужденное состояние» является более нестабильным состоянием, возникающим в результате перехода электрона на орбиту с более высокой энергией.. Количество электронов в каждом слоеЭлектроны, которые помещаются в каждый слой, рассчитываются с 2n 2 Химические элементы, которые являются частью периодической таблицы и находятся в одном столбце, имеют одинаковые электроны в последнем слое. Количество электронов в первых четырех слоях будет 2, 8, 18 и 32. Электроны вращаются по круговым орбитам без излучающей энергии.Согласно Первому Постулату Бора, электроны описывают круговые орбиты вокруг ядра атома без излучения энергии. Разрешены орбитыСогласно второму постулату Бора, единственными допустимыми орбитами для электрона являются те, для которых угловой момент L электрона является целым кратным постоянной Планка. Математически это выражается так: Энергия, испускаемая или поглощаемая в прыжкахСогласно Третьему Постулату, электроны будут излучать или поглощать энергию при прыжках с одной орбиты на другую. При скачке орбиты испускается или поглощается фотон, энергия которого представлена математически: Видео:Волновая функция (видео 5) | Квантовая физика | ФизикаСкачать  Постулаты атомной модели БораБор дал преемственность планетарной модели атома, согласно которой электроны вращались вокруг положительно заряженного ядра, а также планет вокруг Солнца.. Однако эта модель бросает вызов одному из постулатов классической физики. В соответствии с этим частица с электрическим зарядом (подобно электрону), которая движется по круговому пути, должна непрерывно терять энергию за счет излучения электромагнитного излучения. Потеряв энергию, электрон должен будет следовать по спирали, пока не упадет в ядро.. Затем Бор предположил, что законы классической физики не являются наиболее подходящими для описания устойчивости, наблюдаемой в атомах, и представил следующие три постулата: Первый постулатЭлектрон вращается вокруг ядра по круговым орбитам, не излучая энергию. На этих орбитах орбитальный момент импульса постоянен. Для электронов атома разрешены только орбиты определенных радиусов, соответствующих определенным энергетическим уровням. Второй постулатНе все орбиты возможны. Но как только электрон находится на разрешенной орбите, он находится в состоянии удельной и постоянной энергии и не излучает энергию (стационарная энергетическая орбита). Например, в атоме водорода допустимые энергии для электрона определяются следующим уравнением: Энергии электронов атома водорода, которые генерируются из вышеприведенного уравнения, являются отрицательными для каждого из значений n. При увеличении n энергия становится менее отрицательной и, следовательно, увеличивается. Когда n достаточно велико, например, n = ∞, энергия равна нулю и представляет, что электрон освобожден и ионизирован атом. Это состояние с нулевой энергией питает большую энергию, чем состояния с отрицательными энергиями.. Третий постулатЭлектрон может переходить со стационарной энергетической орбиты на другую, излучая или поглощая энергию. Энергия, излучаемая или поглощаемая, будет равна разности энергий между двумя состояниями. Эта энергия E находится в форме фотона и задается следующим уравнением: В этом уравнении E — энергия (поглощенная или излучаемая), h — постоянная Планка (ее значение составляет 6,63 x 10). -34 джоул-секунды [Дж-с]) и ν — частота света, единица измерения которой равна 1 / с.. Видео:Квантовые числа (видео 14) | Квантовая физика | ФизикаСкачать  Диаграмма энергетических уровней для атомов водородаМодель Бора смогла удовлетворительно объяснить спектр атома водорода. Например, в диапазоне длин волн видимого света спектр излучения атома водорода имеет следующий вид: Посмотрим, как можно рассчитать частоту некоторых наблюдаемых световых полос; например, красный цвет. Используя первое уравнение и подставив n для 2 и 3, вы получите результаты, которые отображаются на диаграмме. Для n = 2, E2 = -5,45 х 10 -19 J Для n = 3, E3 = -2,42 х 10 -19 J Затем можно рассчитать разницу энергии для двух уровней: ΔE = E3 — Е2 = (-2,42 — (- 5,45)) х 10 — 19 = 3,43 х 10 — 19 J Согласно уравнению, объясненному в третьем постулате, ΔE = h ν. Затем вы можете рассчитать ν (частоту света): = 3,43 х 10 -19 J / 6,63 x 10 -34 J-ы = 4,56 х 10 14 s -1 или 4,56 х 10 14 Гц Будучи λ = c / ν, а скорость света c = 3 x 10 8 м / с, длина волны определяется как: λ = 6565 х 10 — 7 м (656,5 нм) Это значение длины волны красной полосы, наблюдаемой в спектре водородных линий. Видео:Спектр излучения водорода (видео 12) | Квантовая физика | ФизикаСкачать 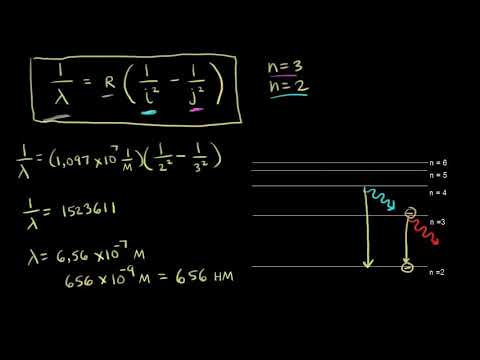 3 основных ограничения модели Бора1- он адаптируется к спектру атома водорода, но не к спектрам других атомов. 2. Волнообразные свойства электрона не представлены в описании этого как маленькая частица, которая вращается вокруг атомного ядра.. 3. Бор не может объяснить, почему классический электромагнетизм не применим к его модели. Именно поэтому электроны не испускают электромагнитное излучение, когда они находятся на стационарной орбите. 🔥 ВидеоСТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать  Урок 459. Обзор квантовой теории атома водородаСкачать  Квантовые постулаты Бора. Модель атома | Физика 11 класс #43 | ИнфоурокСкачать  11. Строение атома. Квантовые числаСкачать  Теория Бора. Гипотеза де Бройля. Принцип неопределенности. Уравнение Шрёдингера.Скачать  Строение атома. Как составить электронную и электронно-графическую формулы?Скачать  Атом:Загадка Электронов. Квантовая механика.Скачать  ПОСТУЛАТЫ БОРА. Атомная физика. Подготовка к ЕГЭ по физике. ТехноскулСкачать  Возбужденное состояние атома | Химия ЕГЭ | УмскулСкачать  ХИМИЯ ПРОСТО — Электронная конфигурация атомаСкачать  Физика 11 класс (Урок№25 - Квантовые постулаты Бора.)Скачать  Строение атома и электронные орбиталиСкачать  Урок 455. Уравнение ШрёдингераСкачать  |


 .
. или
или  .
. ,
, в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).
в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).

 .
. .
. .
. Å = 0,529·10 –10 м.
Å = 0,529·10 –10 м. .
. , т.е. кинетическая энергия равна потенциальной. Тогда можно записать:
, т.е. кинетическая энергия равна потенциальной. Тогда можно записать: .
. .
. , т.е.
, т.е.  .
. .
. принимает только дискретные значения энергии, т.к. n = 1, 2, 3….
принимает только дискретные значения энергии, т.к. n = 1, 2, 3….

 .
. .
. .
. , что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
, что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.