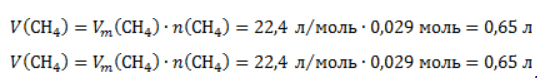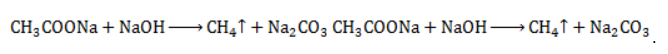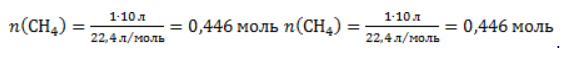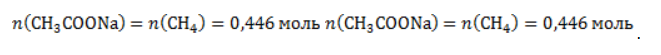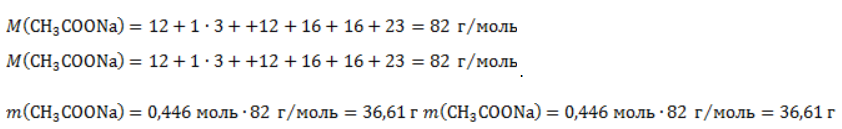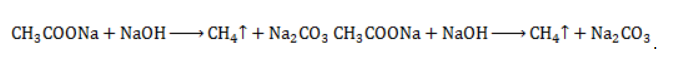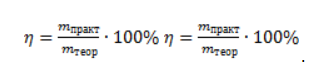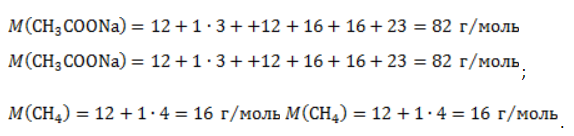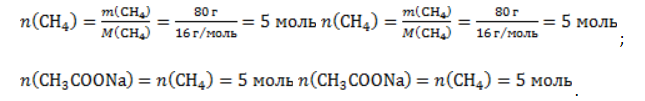Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Опыты по химии. Предельные углеводороды
- Получение метана в лаборатории и промышленности
- Общая характеристика метана
- Физические свойства
- Получение метана
- Промышленные методы получения метана
- Очистка и переработка природного газа
- Переработка нефти и попутного газа
- Переработка каменного угля
- Лабораторный синтез метана
- Взаимодействие карбида алюминия с водой (метод Муассана)
- Взаимодействие ацетата натрия с щелочью (метод Дюма)
- Получение метана в домашних условиях
- Получение из органических отходов животноводства
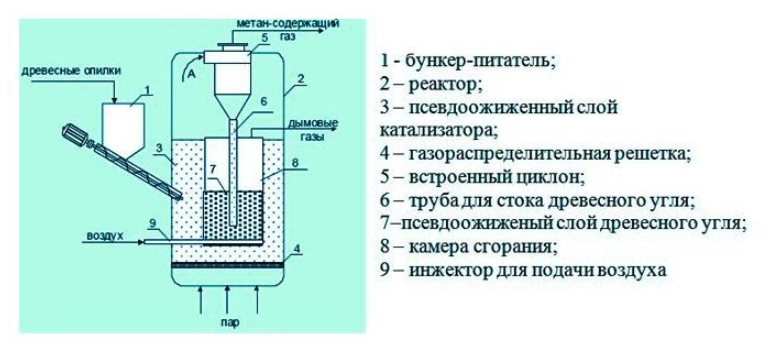
- Получение из древесины
- Эффективность синтеза биометана
- Метан в органическом синтезе
- Получение ацетилена из метана
- Получение метанола из метана
- Получение анилина из метана
- Заключение
- Примеры решения задач
Видео:Получение метанаСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Реакция Дюма. Получение метанаСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Решение задач на термохимические уравнения. 8 класс.Скачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
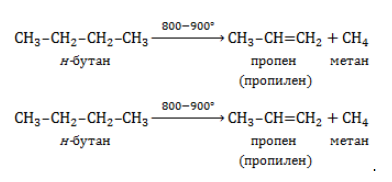
Продукт реакции – так называемый «синтез-газ». Видео:Уравнивание реакций горения углеводородовСкачать  Получение метанаВидео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать  Опыты по химии. Предельные углеводородыПостановка опытов и текст – к.п.н. Павел Беспалов. Получение метана Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Тщательно перемешаем натронную известь с ацетатом натрия и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан CH3COONa + NaOH = CH4 + Na2CO3 Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив. Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу. Горение метана и изучение его физических свойств Заполним метаном цилиндр. Метан представляет собой бесцветный газ, мало растворимый в воде. Он легче воздуха, поэтому легко улетучивается из открытого цилиндра. При поджигании метан загорается. При сгорании метана образуются углекислый газ и водяные пары. CH4 + 2О2 = СО2 + 2 Н2О Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив. Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Не допускать попадания натронной извести на кожу. Взрыв метана с кислородом Для полного сгорания метана на один объем метана нужно взять два объема кислорода (см. уравнение реакции). Пластиковую бутылку, разделенную метками на три равные части, заполним способом вытеснения воды одной частью метана и двумя частями кислорода. При поджигании смеси происходит взрыв — полное сгорание метана в кислороде. CH4 + 2О2 = СО2 + 2 Н2О Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив. Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Отношение метана к раствору перманганата калия и бромной воде Получаем метан прокаливанием безводного ацетата натрия с натронной известью. Пропустим метан через раствор перманганата калия. Никаких видимых изменений не наблюдаем. Бромная вода также не изменяет своей окраски. Метан стоек к окислителям и не вступает в реакцию с бромом при данных условиях. Оборудование: пробирка, газоотводная трубка, промывалка, кристаллизатор, цилиндр, горелка, штатив. Техника безопасности. Соблюдать правила работы с горючими газами и нагревательными приборами. Горение жидких углеводородов Возьмем для опыта гексан и керосин. Молекула гексана содержит шесть атомов углерода. Керосин – это смесь молекул алканов, в составе которых от двенадцати до восемнадцати атомов углерода. Подожжем небольшие количества гексана и керосина. Гексан загорается сразу: алканы с небольшой молекулярной массой загораются легко. Поджечь керосин оказывается немного труднее, появляется коптящее пламя. В виде копоти выделяется несгоревший углерод. Большинство алканов горят коптящим пламенем из-за высокого содержания углерода. Мы убедились в том, что алканы с небольшой молекулярной массой загораются легче, чем алканы с большой молекулярной массой. Оборудование: фарфоровые чашки, лучина, огнезащитная прокладка. Техника безопасности. Соблюдать правила работы с горючими жидкостями. Работать с небольшими количествами жидких углеводородов (не более 2 мл). Горение твердых углеводородов (на примере парафина) Парафин – смесь твердых алканов, содержащих в своем составе от 16 до 40 атомов углерода. Твердый парафин на воздухе загорается с трудом. Кипящий парафин на воздухе самовозгорается. Нагреем парафин до кипения. Выливаем кипящий парафин из пробирки в кристаллизатор, наполненный водой. Кипящий парафин, смешиваясь с воздухом, загорается. При горении парафина образуются углекислый газ и водяные пары. Оборудование: пробирка, зажим пробирочный, горелка, кристаллизатор. Техника безопасности. Соблюдать правила работы с горючими веществами. Не наклоняться над кипящим парафином. Не допускать попадание парафина на одежду, кожу. Установление качественного состава предельных углеводородов Общим методом определения углерода и водорода в органических соединениях является окисление веществ оксидом двухвалентной меди. При этом углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu Углекислый газ обнаруживают при помощи известковой воды. Известковая вода мутнеет от углекислого газа. Ca (OH)2 + CO2 = CaCO3 ↓ + H2O Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос CuSO4 + 5H2O = CuSO4 * 5 H2O Оборудование: пробирка с газоотводной трубкой, стакан, штатив, горелка. Техника безопасности. Соблюдать правила работы с нагревательными приборами. Определение содержания хлора в органических соединениях Качественно определить содержание галогена в органическом соединении можно при помощи медной проволоки. При нагревании с оксидом меди (II) галогенсодержащие вещества сгорают с образованием летучих соединений, окрашивающих пламя в сине-зеленый цвет. Эта качественная реакция на галогены в органических соединениях называется пробой Бейльштейна. Для проведения пробы медную проволоку прокаливают в пламени горелки, опускают в жидкость или касаются твердого вещества и вновь вносят в пламя горелки. Появление сине-зеленого окрашивания, свидетельствует о наличии галогена в органическом соединении. Испытаем диметиламин хлорид и убедимся в том, что в его составе присутствует галоген — хлор. Оборудование: горелка, медная спираль. Техника безопасности. Соблюдать правила работы с нагревательными приборами. Видео:Получение алканов. 10 класс.Скачать  Получение метана в лаборатории и промышленностиПростейшее углеводородное соединение – метан – используется в промышленности, на транспорте, в быту, находя широкое применение и как сырье для органического синтеза, и в качестве конечного продукта. Потребность в метане испытывают многие отрасли хозяйства, и его производство постоянно расширяется. Видео:Получение и изучение свойств метана. Опыт 1Скачать  Общая характеристика метанаМетан представляет собой легкий бесцветный горючий газ без запаха. Распространен в природе как основной компонент природного газа и попутных нефтяных газов. Химическая формула – В атмосферу метан поступает в составе вулканических газов, а также является продуктом жизнедеятельности ряда микроорганизмов. В форме газогидратов в значительных количествах содержится на дне океанов и в многолетней мерзлоте. Является одним из важнейших парниковых газов. Как представитель ряда предельных углеводородов проявляет низкую химическую активность. Вследствие малой растворимости в воде и химической инертности метан считается малотоксичным веществом (класс опасности – IV), но при высокой концентрации в воздухе (4,4 — 17%) взрывоопасен, а дальнейшее повышение содержания метана приводит к удушью от недостатка кислорода. Физические свойстваОсновные физические характеристики метана при нормальном атмосферном давлении приведены в таблице. Видео:Не знаешь как запомнить алканы? Слушай #shorts #алканы #химия #репетиторпохимииСкачать  Получение метанаПромышленное производство и получение метана в лаборатории проводятся разными методами. Существуют также способы получения газа в домашних условиях, например, в частном хозяйстве для удовлетворения потребности в топливе. Промышленные методы получения метанаПоскольку газ в больших количествах поступает при добыче нефтегазового сырья, способы его производства нацелены не на искусственный синтез, а на выделение в процессах переработки нефти и газа. Кроме того, метан может быть получен при технологической обработке каменноугольного сырья. Очистка и переработка природного газаМетан – главный компонент такого важного вида горючих полезных ископаемых, как природный газ. Содержание метана в газе различных месторождений составляет 70-98%. После очистки от твердых частиц и примесей (сероводород, азот, углекислый газ, гелий) и осушки (отделения водяных паров) природный газ подвергается низкотемпературному фракционированию. Более тяжелые углеводородные компоненты газа – этан, пропан и бутан – переходят в жидкую фазу при более высоких температурах, чем метан, и последовательно отделяются от него в конденсационной колонне. Переработка нефти и попутного газаВ процессах термического разложения (пиролиза) высокомолекулярных алканов, входящих в состав нефти, в числе продуктов получают метан: Метан входит в состав газа, отделяемого от сырой нефти в процессе крекинга (разложения при высоком давлении и температурах около 450 — 550 ℃ либо с использованием катализатора). Кроме того, метан составляет значительную долю попутных газов, от которых его отделяют методом сепарации. Переработка каменного угля
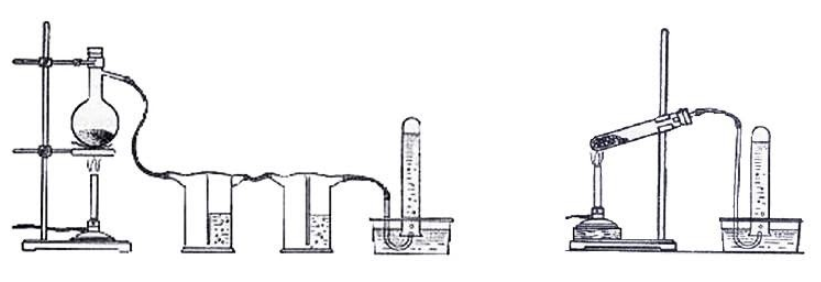
Лабораторный синтез метанаВ лабораторной практике используются два основных способа получения метана:
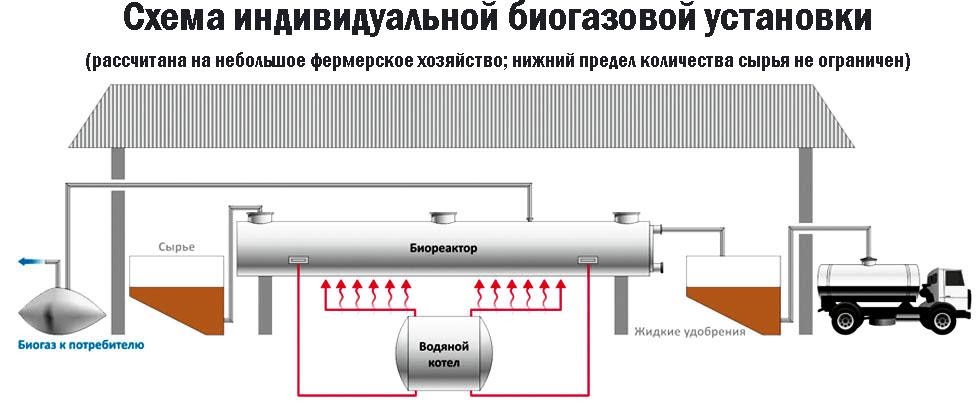
Взаимодействие карбида алюминия с водой (метод Муассана)Неорганическое бинарное соединение Реакция необратима и служит простым и удобным способом получения газа в лабораторных условиях. Взаимодействие ацетата натрия с щелочью (метод Дюма)Еще один простой лабораторный способ получения метана – прокаливание натриевой соли уксусной кислоты Подробное рассмотрение лабораторного процесса показывает, как с помощью щелочи получить метан из ацетата натрия. Присутствие воды препятствует этой реакции, поэтому уксуснокислый натрий должен быть обезвожен, а гигроскопичный гидроксид натрия – смешан с негашеной известью (оксидом кальция). Такая смесь носит название натронной извести. В реакционной смеси она должна присутствовать с избытком 1:3, чтобы обеспечить полное использование ацетата натрия. Порошки реагентов хорошо перемешиваются и помещаются в колбу с отводной трубкой или в пробирку. Выделяющийся газ собирают по методу вытеснения воды в пробирку. При нагревании колбы на пламени горелки используется асбестовая сетка. Пробирку нагревают на открытом пламени. Для улавливания примесей может использоваться промывная склянка с раствором щелочи. Для проверки результата опыта газ в пробирке поджигается. Варианты сборки прибора для получения метана в лаборатории изображены на рисунке. Получение метана в домашних условияхМетан можно получать и как продукт биологических процессов. Он выделяется в ходе обмена веществ особыми анаэробными микроорганизмами – бактериями-метаногенами. Они широко распространены в органических отходах животного и растительного происхождения. Поскольку метан может применяться в качестве горючего для водонагревательных установок, печей и кухонного оборудования, в частных хозяйствах, располагающих большим количеством отходов, становится выгодным самостоятельное получение из них метана и его использование. Получение из органических отходов животноводстваМетаногены обитают в кишечном тракте позвоночных и принимают участие в пищеварительном процессе. Поэтому в хозяйствах, занимающихся разведением крупного рогатого скота, свиней или домашней птицы, отходы жизнедеятельности животных могут быть переработаны с помощью биогазовых установок. Неразложимый остаток служит органическим удобрением. Технология получения биогенного метана состоит из нескольких этапов:
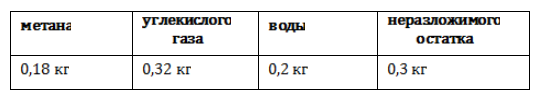
В некоторых установках предусмотрена система очистки биогаза от примесей – углекислого газа и сероводорода. Получение из древесиныВ качестве сырья для биогазовой технологии могут использоваться и растительные отходы, такие как древесная щепа. Пригодна для использования в биореакторе некондиционная древесина (например, пораженная вредителями или пострадавшая от пожаров), а также отходы лесозаготовок – ветки, кора и пр. Так как древесина содержит смолы, в установках по ее переработке нужно применять катализаторы для очистки газа. В качестве катализатора подходят шлаки металлургических производств, особенно эффективны мартеновские шлаки. Эффективность синтеза биометанаВ среднем переработка 1 кг биомассы, разложимой на 70%, дает: Эффективность выработки биогаза зависит от поддержания нужной температуры ферментации, поэтому в холодных регионах работа биогазовой установки потребует дополнительных затрат на подогрев и устройство надежной теплоизоляции. Большую роль играет биохимическое равновесие: выход газа снижается при возрастании кислотности. В этом случае требуется добавление нейтрализующего агента. Крупные фермерские хозяйства могут позволить себе привлечение специалистов, установку полностью автоматизированных биореакторов с большим выходом газа и получать дополнительный доход от его продажи. Для эффективной работы установки необходимо бесперебойное поступление сырья, поэтому хозяйствам с малым количеством животных невыгодно заниматься производством биометана. Если количество биомассы позволяет наладить синтез газа в небольшом хозяйстве, мини-установку для его производства можно сделать собственными силами. Следует помнить, что ее сооружение потребует серьезных вложений, составления технологической схемы, оформления документации, согласования с СЭС, пожарной и газовой инспекциями. Если хозяйство имеет возможность установить биогазовый реактор, оно получает существенные выгоды:
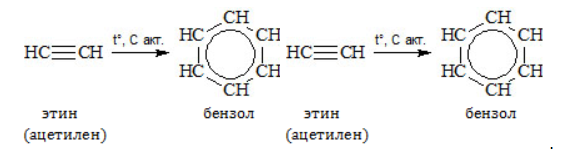
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Метан в органическом синтезеМетан широко используется для получения многих востребованных соединений, таких как ацетилен, метанол или анилин. Получение ацетилена из метанаВ лабораторной практике проводится дегидрирование метана. Реакция требует сильного нагревания: В промышленности используются такие методы, как:
В этой реакции используется теплота частичного сгорания сырья, благодаря которой реакционная смесь разогревается до 1600 ℃ . Получение метанола из метанаМетиловый спирт может быть получен:
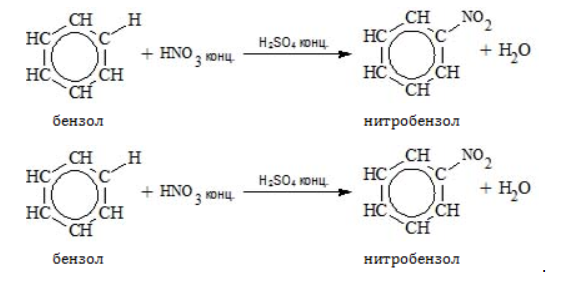
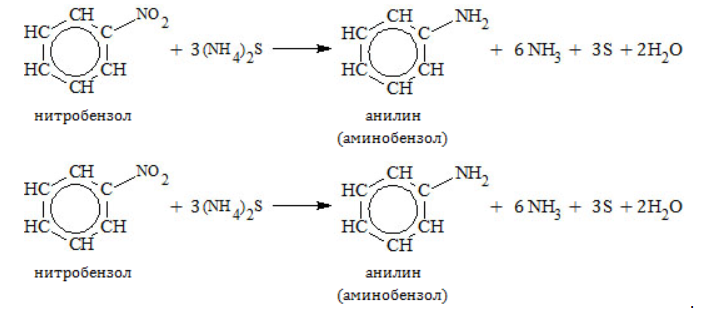
Получение анилина из метанаАроматическое соединение анилин получают в несколько стадий:
Видео:Все углеводороды за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать  ЗаключениеМетан востребован во многих областях. Росту объемов его производства для различных нужд способствует достаточно высокая распространенность в природе. Однако метан производится не только на крупных промышленных предприятиях. Простота его получения с использованием биологических отходов стимулирует производство индивидуальными хозяйствами, что идет на пользу экологической обстановке, снижая бесконтрольное гниение отходов и выброс ценного продукта в атмосферу. Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Примеры решения задач1. Каков объем метана, выделяющегося при гидролизе карбида алюминия массой 12.5 г.? Запишем уравнение реакции: Найдем количество карбида алюминия, вступающего в реакцию, по формуле Из уравнения реакции видно, что Молярный объем газа Vm при нормальных условиях составляет 2. Какова масса ацетата натрия, необходимого для получения 10 л метана? Запишем уравнение реакции: Используя знание молярного объема газа, составим пропорцию: Вычислим количество получаемого метана: Из него следует, что количество ацетата натрия равно количеству метана: Рассчитаем массу ацетата натрия по формуле m=nM. 3. Сколько граммов ацетата натрия затрачено на получение 60 г метана при выходе продукта реакции 75%? Запишем уравнение реакции: Выход продукта равен отношению массы вещества, полученной на практике, к массе, рассчитанной по уравнению: Вычислим расчетную массу метана: Рассчитаем молярные массы ацетата натрия и метана: Уравнение показывает, что количества вещества ацетата натрия и метана равны. Вычислим их: Вычислим массу ацетата натрия: |
















 .
.

 с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия:
с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия: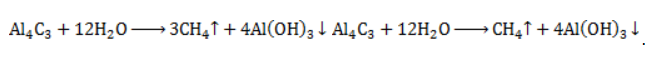
 с едким натром
с едким натром  :
: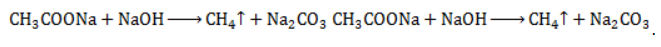
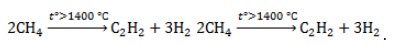


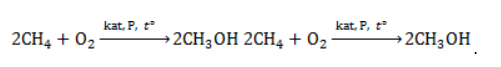
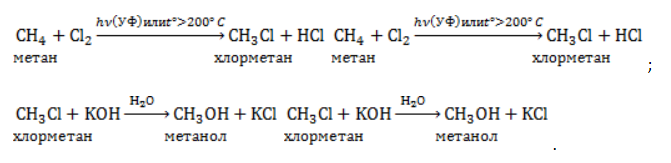
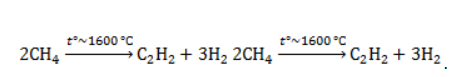

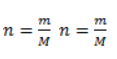 , где – n количество вещества, m– масса, M – молярная масса.
, где – n количество вещества, m– масса, M – молярная масса.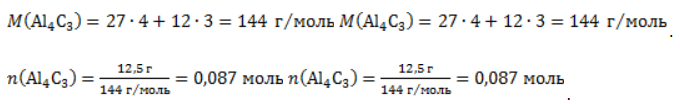
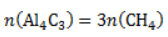 . Следовательно, количество метана равно:
. Следовательно, количество метана равно: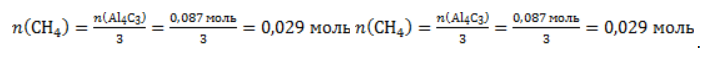
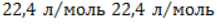 . Следовательно, объем метана будет равен:
. Следовательно, объем метана будет равен: