Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n.
- Запишите уравнения реакций между хлором и циклопропаном, между хлором и циклогексаном?
- . Взаимодействие метана с хлором – это реакция : ?
- Запишите уравнение химической реакции между алюминием и хлором с образованием хлорида алюминия?
- 1. запишите уравнения реакций магния?
- Составьте уравнения реакций взаимодействия : — 2 метилбутана с хлором ; — 3 метилгексана с хлором ?
- Запишите формулы всех оксидов хлора с нечётными степенями окисления галогена?
- Напишите уравнения реакций между : хлором и цинком?
- Нужно чтобы из FeCl3 (феррум хлор три) получилось Fe2O3 (феррум два о три) напишите уравнение рекции?
- Почему уравнение реакции магния и хлора — Mg + Cl2 = MgCl2, а не 2Mg + Cl2 = 2MgCl А, например, реакция калия и хлора записывается иначе : 2К + Cl2 = 2KCl?
- Напишите уравнения реакций : а) между хлором и медью ; б) между хлором и алюминием?
- Напишите уравнения реакций между : а) хлором и железом ; б)хлором и фосфором Укажите окислитель и восстановитель?
- Acetyl
- 🎥 Видео
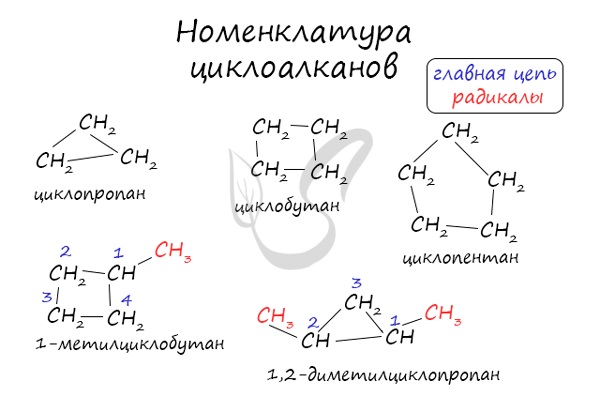
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
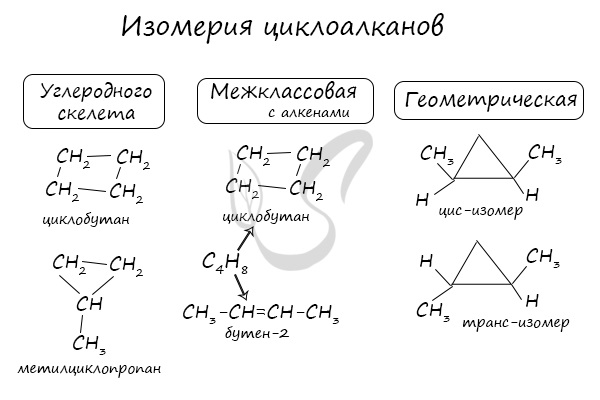
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
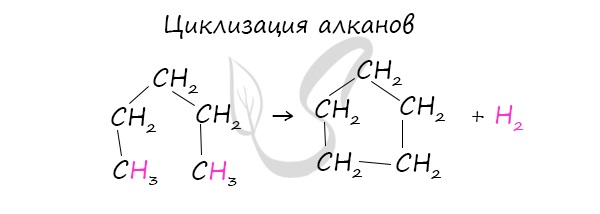
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
Химические свойства циклоалканов
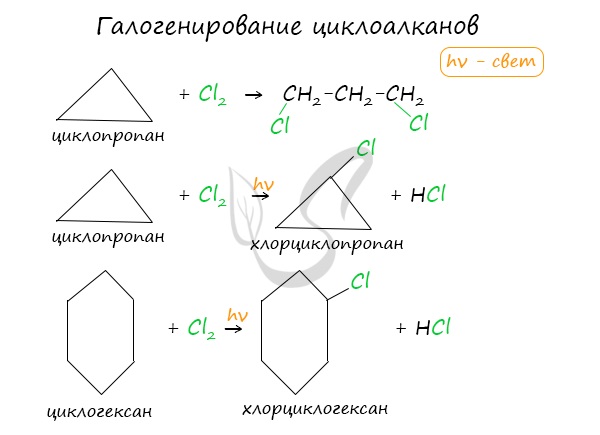
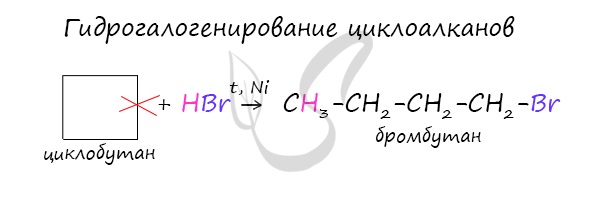
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
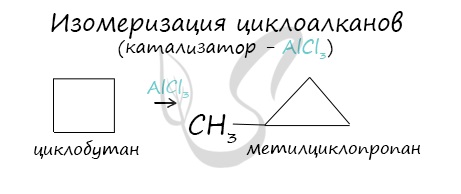
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Взаимодействие хлора с железомСкачать

Запишите уравнения реакций между хлором и циклопропаном, между хлором и циклогексаном?
Химия | 10 — 11 классы
Запишите уравнения реакций между хлором и циклопропаном, между хлором и циклогексаном.
В чём принципиальная разница этих рекциях , объясните её причину.
Сам незнаю ломаю голову.
Видео:Прожарка хлором (C, Si, Ge, Sn, Pb, Fl)Скачать

. Взаимодействие метана с хлором – это реакция : ?
. Взаимодействие метана с хлором – это реакция : ?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Запишите уравнение химической реакции между алюминием и хлором с образованием хлорида алюминия?
Запишите уравнение химической реакции между алюминием и хлором с образованием хлорида алюминия.
Видео:Реакция сурьмы с хлоромСкачать

1. запишите уравнения реакций магния?
1. запишите уравнения реакций магния.
А)с хлором, б)с серой, в)с кислородом.
Видео:Конформации циклогексана, часть IV. Трехзамещенный циклогексан (видео 32)|Алканы и Циклоалканы|ХимияСкачать

Составьте уравнения реакций взаимодействия : — 2 метилбутана с хлором ; — 3 метилгексана с хлором ?
Составьте уравнения реакций взаимодействия : — 2 метилбутана с хлором ; — 3 метилгексана с хлором ;
Видео:Всё о циклоалканах за 40 минут | Химия 10 класс | УмскулСкачать

Запишите формулы всех оксидов хлора с нечётными степенями окисления галогена?
Запишите формулы всех оксидов хлора с нечётными степенями окисления галогена.
Составьте уравнения реакции гидратации этих оксидов.
Видео:Химические свойства циклоалкановСкачать

Напишите уравнения реакций между : хлором и цинком?
Напишите уравнения реакций между : хлором и цинком.
Видео:Взаимодействие хлора с железомСкачать

Нужно чтобы из FeCl3 (феррум хлор три) получилось Fe2O3 (феррум два о три) напишите уравнение рекции?
Нужно чтобы из FeCl3 (феррум хлор три) получилось Fe2O3 (феррум два о три) напишите уравнение рекции!
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Почему уравнение реакции магния и хлора — Mg + Cl2 = MgCl2, а не 2Mg + Cl2 = 2MgCl А, например, реакция калия и хлора записывается иначе : 2К + Cl2 = 2KCl?
Почему уравнение реакции магния и хлора — Mg + Cl2 = MgCl2, а не 2Mg + Cl2 = 2MgCl А, например, реакция калия и хлора записывается иначе : 2К + Cl2 = 2KCl?
Видео:ЦиклоалканыСкачать

Напишите уравнения реакций : а) между хлором и медью ; б) между хлором и алюминием?
Напишите уравнения реакций : а) между хлором и медью ; б) между хлором и алюминием.
Укажите условия протекания этих реакций, а также окислитель и восстановитель.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Напишите уравнения реакций между : а) хлором и железом ; б)хлором и фосфором Укажите окислитель и восстановитель?
Напишите уравнения реакций между : а) хлором и железом ; б)хлором и фосфором Укажите окислитель и восстановитель.
На этой странице сайта, в категории Химия размещен ответ на вопрос Запишите уравнения реакций между хлором и циклопропаном, между хлором и циклогексаном?. По уровню сложности вопрос рассчитан на учащихся 10 — 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
K2O — оксид калия (основные оксиды) BaO — оксид бария (основные оксиды) Al2(SO4)3 — сульфат алюминия (средние соли) NaHCO3 — гидрокарбонат натрия (кислые соли).
4P + 5O₂ = 2P₂O₅ P⁰ — 5e = P⁺⁵ 4 фосфор восстановитель, процесс окисления O₂ + 4e = 2O⁻² 5 кислород окислитель, процесс восстановления P₂O₅ + 3H₂O = 2H₃PO₄ P₂O₅ + 3H₂O = 2H⁺ + 2H₂PO₄⁻ H₃PO₄ + 3NaOH = Na₃PO₄ + 3H₂O H⁺ + H₂PO₄⁻ + 3Na⁺ + 3OH⁻ = 3Na⁺ + P..
Fe(OH)3 + 3HCl = FeCl3 + 3H2O n(Fe(OH)3) = 21. 4 / 107 = 0. 2моль по уравнению реакции n(HCl) в 3 раза больше n(fe(oh)3) n(hcl) = 0, 6 моль m = n * M m(hcl) = 0. 6 * 36. 5 = 21. 9г W = m(в — ва) / m(р — ра) m(р — ра) = m(в — ва) / W m(hcl)(ра — ..
HCl + H2O = H3O( + ) + Cl ( — ).
А) по уравнению при восстановлении 1моль оксида выделяется 80кДж теплоты , значит при восстановлении 5 моль = 80 * 5 = 400кДж б)1, 6г это 1, 6 / 64 = 0, 025моль оксида , теплоты будет 80 * 0, 025 = 2кДж.
Mr(SO3) = 32 + 3 * 16 = 80 W(S) = 32 / 80 = 0. 4 = 40% Mr(SO2) = 32 + 2 * 16 = 64 W(S) = 32 / 64 = 0. 5 = 50% В 0, 8 раза.
M(CuSO4) = 64 + 32 + 4 * 16 = 160 г / моль n(CuSO4) = 1. 6 / 160 = 0. 01 моль.
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 ВидеоВидеоурок «Циклоалканы»Скачать  Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  Химические свойства циклоалканов. Обычные циклы и полициклоалканы.Скачать  Химические свойства циклоалканов. Малые циклы: циклопропан и циклобутан.Скачать  5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать  Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать  ХимияСкачать  |