Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
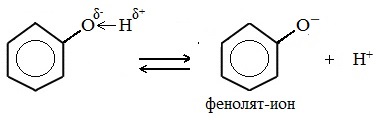
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
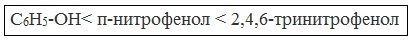
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
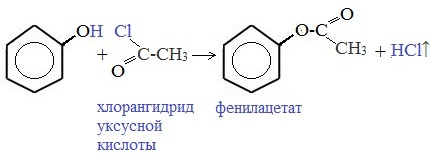
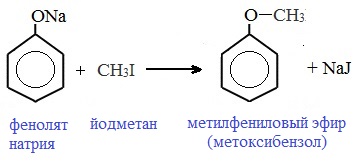
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
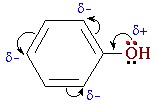
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
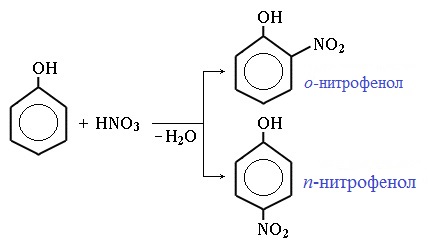
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
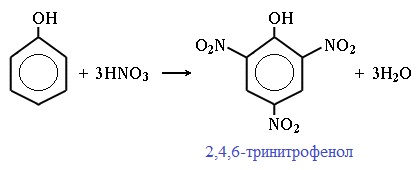
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
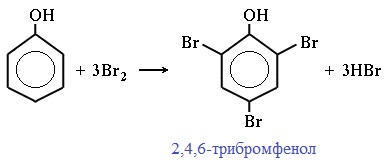
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: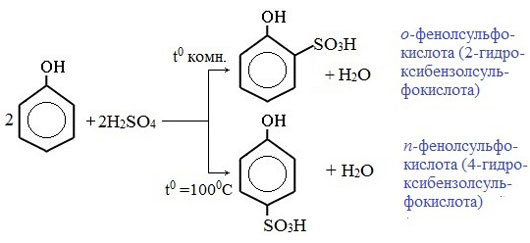
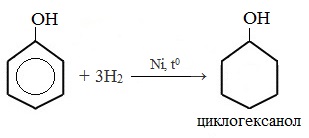
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
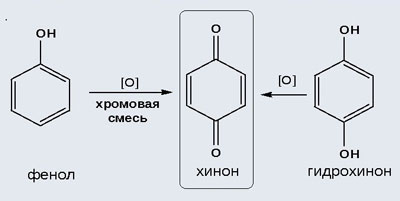
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
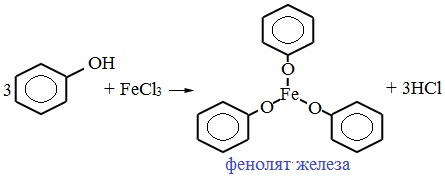
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Урок по химии «Химические свойства фенола» (естественно-научный профиль). 10-й классКласс: 10 Презентация к урокуФорма урока: комбинированный (2 часа). Цели:
Оборудование: мультимедийная установка, шаростержневые модели бензола, этилового спирта, презентация “Химические свойства фенола”. На ученических столах: коллекция изделий на основе фенолформадегильной смолы, FeCl3, чайная заварка. 1. Организационный момент. 2. Актуализация опорных знаний и мотивация познавательной деятельности. Учитель: Предлагает ответить на вопросы (Слайды: 1, 2) и наводит на определение темы и целей урока.
Учитель: В основе учения об органических веществах лежит теория химического строения А.М.Бутлерова. Объясните почему? (Ответ: Эта теория раскрывает взаимосвязь между строением веществ и их свойствами, показывает, что свойства веществ неслучайные). Из каких двух знакомых фрагментов состоит молекула фенола? Сформулируйте 3 положение теории А.М.Бутлерова. 3. Определение темы урока, целей и задач урока. Учитель задаёт вопрос: Как вы считаете, какой будет тема урока? (Ученики высказывают версии, формулируют с помощью учителя тему урока. Записывают тему урока в тетрадь). Слайд 3. 4. Изучение нового материала. Учитель: Свойствами каких соединений формально должен обладать фенол? (Ответ: фенол должен сочетать свойства аренов (бензола) и одноатомных спиртов). Учитель: Оказывается, это не совсем так. Именно поэтому фенолы рассматриваются отдельно от класса спиртов. Учитель: Как Вы думает, в чем причина? (Ответ: причина кроется в том, что в результате взаимного влияния гидроксильной группы и ароматического радикала химические свойства этих фрагментов изменяются, а фенол в целом приобретает некоторые особенные свойства). (Слайд: 7). 4.1. Кислотные свойства фенола. Ученики предполагают, что для фенола характерна реакция с Ме (IА). (Слайды: 8, 9).
Учитель: первым доказательством более сильных кислотных свойств фенола по сравнению со спиртами является тот факт, что в водном растворе наблюдается незначительная диссоциация фенола: C6H5OHFC6H5O – + H + . (Слайд: 10). В отличие от спиртов фенол взаимодействует с щелочами.
Реакция обратима, т.к. фенолят натрия — это соль, образованная слабой кислотой и сильным основанием. (Слайд: 11, 12). Вопрос: что происходит с солями в водном растворе? Какова реакция среды в растворе фенолята натрия? (Ответ: они гидролизуются; среда щелочная). (Слайд: 13). Учитель: первым названием фенола было карболовая кислота. Однако кислота эта значительно слабее не только сильных, но даже некоторых неорганических кислот, даже угольной:
Отличие от спиртов: (Слайд: 14).
Вопрос: Чем обусловлено различие кислотных свойств спиртов и фенола? (Ответ: различие кислотных свойств спиртов и фенола обусловлено влиянием радикала на гидроксильную группу: радикал фенил — C6H5 увеличивает подвижность атома водорода в ОН группе, а алкильные радикалы (- СН3, — C2H5) уменьшают ее, поэтому кислотные свойства у фенола выражены сильнее, чем у спиртов. (Слайд: 15). Вопрос: как можно получить сложные и простые эфиры? Ученики высказывают свои предположения. Затем идет объяснение. Учитель: в отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот, для этого можно использовать хлорангидриды кислот. H3CC(O)Cl+HO–C6H5 —> H3C–C(O)–O–C6H5+HCl (Слайд: 16). В качестве исходных веществ для получения простых и сложных эфиров используются также феноляты. (Слайды: 17, 18). Затем ученики составляют уравнения возможных реакций получения эфиров. (Слайд: 19). (На усмотрение учителя данное упражнение может быть выполнено учениками в качестве домашнего задания). 4.2. Реакции электрофильного замещения. Учитель: Почему реакции электрофильного замещения в бензольном кольце фенола протекают легче, чем у бензола, и в более мягких условиях? (Слайд: 20). Ответ: Влияние ОН — группы на бензольное кольцо ОН — группа — заместитель I рода. Подает электроны на бензольное кольцо, увеличивая электронную плотность в орто и пара положениях.Атомы Н в положениях 2,4,6 — более подвижны и легко замещаются. (Слайд: 21). Хлорирование (Слайд: 22). Реакция с бромной водой- качественная реакция. (Слайд: 23, 24). Аналогичные закономерности наблюдаются при нитровании фенола. Однако при действии на фенол разбавленной азотной кислотой можно получить смесь монозамещенных нитропроизводных: о-нитрофенола и п-нитрофенола. (Слайд: 25). Ученик у доски записывает реакцию взаимодействия фенола с разбавленной HNO3. Проверка — (Слайд: 26). При взаимодействии с концентрированной азотной кислотой образуется 2,4,6—тринитрофенол. Ученик у доски записывает реакцию взаимодействия фенола с концентрированной HNO3. Проверка — (Слайд: 27). Электроноакцепторные свойства нитрогрупп значительно усиливают кислотность тринитрофенола. Он является примерно в миллиард раз более сильной кислотой по сравнению с фенолом, и в 100 раз сильнее фосфорной кислоты. (Слайд: 28). Рассказ учителя. Впервые тринитрофенол получил в 1771г. английский химик П.Вульф действием азотной кислоты на природное органическое вещество индиго. Благодаря интенсивной желтой окраске вещества его стали использовать в качестве красителя для волокна и тканей. Из-за горького вкуса тринитрофенол назвали сначала пикрином (от греческого слова pykros — горький, острый), а затем — пикриновой кислотой. В 1779г. выяснилось, что это вещество способно взрываться. Но только после того, как на нескольких красильных фабриках произошли несчастные случаи в результате взрывов пикриновой кислоты, она в 1885г. была запатентована в качестве взрывчатого вещества. 4.3. Реакция поликонденсация. Одним из важнейших свойств фенола, используемых в промышленности, является его способность вступать в реакцию с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, в ходе которой образуется реакция поликонденсации, в ходе которой образуется высокомолекулярное соединение — фенолформальдегидная смола и выделяется низкомолекулярный продукт вода. (Слайд: 29, 30, 31, 32). Из фенолформальдегидной смолы получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Сравнение с реакцией полимеризацией. Закрепление понятий “полимер”, “мономер”, “структурное звено”, “степень полимеризации”, “степень поликонденсации”. Работа с коллекцией изделий на основе фенолформадегильной смолы. 4.5. Взаимодействие с раствором хлорида железа (III). Качественной реакцией на фенол и его гомологи является образование окрашенных комплексов с раствором хлорида железа (III). (Слайд 33, 34). В экстрактах многих растений, особенно обладающих дубильным и вяжущим действием, содержатся вещества, называемые “танины”. В состав их молекул входит большое число фенольных остатков. Они также дают с хлорным железом интенсивное окрашивание. Ученики проводят опыт: в пробирку наливают 2-3 мл холодной чайной заварки светло-желтого цвета и добавляют 2-3 капли раствора хлорида железа (III). Жидкость приобретает чернильный цвет. В чайных листах содержится большое количество танина, придающего напитку терпкий вяжущий привкус. Ученик у доски записывает реакцию взаимодействия фенола с водородом. Проверка — (Слайд 35). Объяснение: фенолы легко окисляются даже под действием кислорода воздуха. На воздухе фенол постепенно окрашивается в розовато-красный цвет. При окислении фенола сильными окислителями основным продуктом окисления является хинон. Двухатомные фенолы окисляются легче. При окислении гидрохинона также образуется хинон. Окисление фенола и гидрохинона. (Слайд 37, 38). На усмотрение учителя данный материал может быть рассмотрен на элективных курсах при подготовке к ЕГЭ. 5. Заключительная часть. Задания для закрепления материала и развития логического мышления. (Слайд 39-41). 6. Подведение итогов урока. Рефлексия. Учитель предлагает ученикам определить результаты урока, сравнить их с целями. 7. (Слайд 42). Домашнее задание. Параграф 18 по учебнику О.С.Габриелян, И.Г.Остроумов, С.Ю.Пономарев. Химия. 10 класс (М. Дрофа, 2014); стр. 193 № 1-10. 🎬 ВидеоРЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать  Решение задач на термохимические уравнения. 8 класс.Скачать  Уравнивание реакций горения углеводородовСкачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать  25. Схема реакции и химическое уравнениеСкачать  Ошибка! смотри коммент. Контрольная #2 Вариант 2 Химия 8 класс. Классы неорганических соединенийСкачать  РАЗБОР ЗАДАНИЯ №6 ЕГЭ | ХИМИЯСкачать  Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать  Как уравнивать окислительно-восстановительные реакции?Скачать  Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать  Реакции горенияСкачать  Реакции разложения. Как понять?Скачать  Реакции разложенияСкачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  |

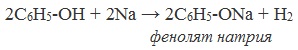
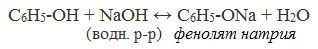
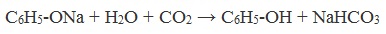

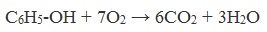


 C6H5ONa + H2O
C6H5ONa + H2O +NaHCO3.
+NaHCO3.


