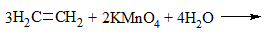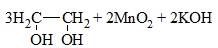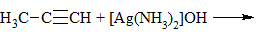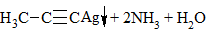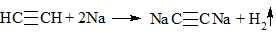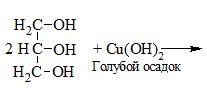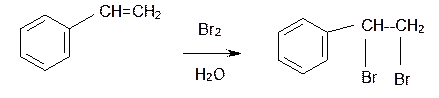Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
CH2=CH2 + Br2 → CH2Br-CH2Br
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
C2H2 + 2Br2 → CHBr2-CHBr2
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O (K2C2O4 — соль щавелевой кислоты)
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
2) + Na → наблюдаем выделение газа:
2C2H5-OH + 2Na → 2C2H5-ONa + H2
С основаниями одноатомные спирты не взаимодействуют.
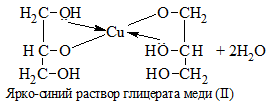
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3  → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
Видео:Взаимодействие этилена с бромной водойСкачать

Некоторые свойства стирола.
Как уже было сказано выше, стирол не относится к аренам, так как имеет двойную связь, и основным типом химических реакции для него будут реакции присоединения, окисления и полимеризации.
Так стирол легко реагирует с бромной водой, обесцвечивая ее, что является качественной реакцией на двойную связь:
По той же схеме происходит гидрирование стирола на никелевом катализаторе:
Окисление стирола осуществляется холодным водным раствором перманганата калия, продуктом окисления будет ароматический двухатомный спирт:
При окислении горячим раствором перманганата калия в присутствии серной кислоты будет образовываться бензойная кислота и углекислый газ.
Важной реакцией, имеющей большое практическое значение, является реакция полимеризации стирола:
Винильная группа представляет собой ориентант I рода, поэтому дальнейшее каталитическое замещение (например, галогеналканами) пойдет в орто- и пара- положения.
7.3.Примеры решения задач
Пример 21.Плотность по озону газовой смеси, состоящей из паров бензола и водорода, равна 0,2. После пропускания через контактный аппарат для синтеза циклогексана величина этой относительной плотности составила 0,25. Определить объемную долю паров циклогексана в конечной смеси и практический выход циклогексана.
Решение:
1)Найдем молярную массу исходной смеси:
2) Молярная масса конечной смеси равна 0,25 ∙ 48=12 г/моль.
3) Найдем молярное соотношение компонентов в исходной смеси
Мсм= φ∙М(бенз.) + М(водор.) ∙(1-φ ), где φ-молярная (объемная) доля бензола
9,6 = 78φ + 2(1 –φ); 7,6 = 76φ; φ =0,1.
Значит, объемная доля водорода равна 0,9.
Следовательно, водород – в избытке, расчет ведем по бензолу.
4) Пусть количество исходной смеси равно 1 моль.
а масса исходной смеси mсм =1∙9,6= 9,6г.
Обозначим количество прореагировавшего бензола –z(моль) и
составим количественный баланс этой реакции.
Прореагировало z 3 z z
Запишем эти данные для удобства в виде таблицы:
| Вещества | Было(моль) | Прореаг.(моль) | Стало(моль) |
| С6Н6 | 0,1 | Z | 0,1- z |
| Н2 | 0,9 | 3z | 0,9 –3z |
| С6Н12 | — | — | Z |
5) Найдем общее количество веществ в конечной реакционной смеси:
n(кон) = 0,1 – z + 0,9 – 3z + z = 1 — 3 z .
Так как общая масса веществ в контактном аппарате не изменилась,
6) Тогда 1 – 3z = 0,8; 3 z = 0,2; z= 0,067.
В таком случае объемная доля циклогексана равна 0,067/0,8 = 0, 084.
7) Теоретическое количество циклогексана составляет 0,1 моль; количество образовавшегося циклогексана 0,067 моль. Практический выход
η =0,067/0,1= 0,67 (67,0%).
Ответ: φ(циклогексана) = 0,084. η =0,067/0,1= 0,67 (67,0%).
Пример 22. На нейтрализацию смеси ароматических кислот, полученных окислением смеси этилбензола и его изомеров, требуется объем раствора гидроксида натрия в пять раз меньший, чем минимальный объем такого же раствора, необходимого для поглощения всего углекислого газа, полученного при сжигании той же порции смеси изомеров. Определить массовую долю этилбензола в исходной смеси.
Решение:
1) Этилбензол — С6Н5С2Н5. М = 106 г/моль; его изомерами являются диметилбензолы, имеющие одинаковую молекулярную формулу С6Н4(СН3)2 и ту же молярную массу, что и этилбензол.
Пусть количество этилбензола равно х(моль), а количество смеси диметилбензолов – y(моль).
2) Напишем уравнения реакций окисления этилбензола и его изомеров:
5C6H5C2H5 + 12KMnO4 + 18H2SO4 
5C6H4(CH3)2 + 12KMnO4 + 18H2SO4 
Очевидно, что количества бензойной кислоты и смеси фталевых кислот тоже равны x и yсоответственно.
3) Уравнения нейтрализации полученных органических кислот:
Из этих уравнений следует, что общее количество щелочи, пошедшее на
нейтрализацию смеси кислот n(общ) = x + 2 y
4) Рассмотрим уравнения сжигания углеводородов, учитывая, что все они
имеют молекулярную формулу С8Н10.
С6Н5С2Н5 + 10,5 О2 
С6Н4(СН3)2 + 10,5 О2 
5) Из этих уравнений следует, что общее количество углекислого газа после сжигания исходной смеси аренов равно n(СО2) = 8x + 8y
6) Так как требуется затратить минимальное количество щелочи, то нейтрализация протекает с образованием кислой соли:
Таким образом, количество щелочи на нейтрализацию СО2 тоже равно
8x + 8y. В таком случае 8x + 8y = 5(x + 2y ); y =1,5x. x =2/3y 7) Расчет массовой доли этилбензола
ω(этилбензола) = m(этилбензола)/m(общ) = 106x/(106x +106y) =
Ответ: ω (этилбензола) = 0,4 =40% .
Пример 23.Смесь толуола и стирола сожгли в избытке воздуха. При пропускании продуктов сгорания через избыток известковой воды образовалось 220 г осадка. Найдите массовые доли компонентов в исходной смеси, если известно, что она может присоединить
Решение:
1) С бромоводородом реагирует только стирол в соотношении 1:1.
2) Количество вещества бромоводорода
3) Запишем уравнение реакции сгорания стирола:
C8H8 + 10 О2 
В соответствии с уравнением реакции при сгорании 0,1моль стирола образуется 0,8 моль углекислого газа.
4) Углекислый газ реагирует с избытком гидроксида кальция тоже в
мольном соотношении 1:1 с образованием осадка карбоната кальция:
5) Общее количество карбоната кальция равно
Значит, при сгорании углеводородов образовалось тоже 2,2моль СО2, из
которых 0,8моль дает при сгорании стирол.
Тогда на долю толуола приходится 2,2 — 0,8 = 1,4 моль СО2.
6) Уравнение сгорания толуола:
C7H8 + 9 О2 
Количество толуола в 7 раз меньше, чем количество углекислого газа:
n(толуол) = 1,4/7 = 0,2 моль.
7) Масса стирола m(стир.) = n(стир)∙M(стир) = 0,1∙104 =10,4(г);
масса толуола m(тол) = n(тол)∙M(тол) =0,2∙92 = 18,4(г).
8) Общая масса смеси углеводородов 10,4 + 18,4= 28,8(г).
массовая доля стирола: ω =10,4/ 28,8 = 0,361;
массовая доля толуола ω=0,639.
Ответ: ω(стирол) = 0,361 = 36,1%; ω(толуол)=0,639=63,9%.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎦 Видео6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Взаимодействие этилена с бромной водойСкачать  Взаимодействие фенола с бромной водойСкачать  Опыты по химии. Отношение бензола к йодной и бромной водеСкачать  Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать  9.3. Фенол: Химические свойстваСкачать  Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Арены: реакции окисления | Химия 10 класс | УмскулСкачать  6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать  Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать  25. Схема реакции и химическое уравнениеСкачать  Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать  Все качественные реакции на углеводороды за 45 минут | Химия ЕГЭ для 10 класса | УмскулСкачать  2.3. Алкены: Химические свойстваСкачать  Обесцвечивание раствора перманганат калия стироломСкачать  Все качественные реакции в органике | Химия ЕГЭ 2022 | УмскулСкачать  Лекция 16Скачать  |