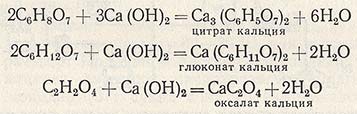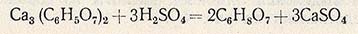Лимонная кислота СН2СООН-СОНСООН-СН2СООН является трехосновной оксикислотой, кристаллизующейся из водных растворов с одной молекулой воды в виде бесцветных, прозрачных ромбической формы кристаллов.
Моногидратная форма лимонной кислоты имеет молекулярную массу 210, плотность 1,54 и температуру плавления 70-75 °С. При хранении и особенно быстро при нагревании до 40-50°С теряется кристаллизационная вода, при температуре 100 °С кристаллизационная вода теряется полностью.
При температуре кристаллизации 36,6 °С и выше выделяется безводная (температура плавления 153°С) лимонная кислота с молекулярной массой 192. При нагревании до 175°С кислота разлагается.
Лимонная кислота широко распространена в плодах и ягодах. Она находит применение в ряде отраслей пищевой промышленности (производство кондитерских изделий и напитков), химической и текстильной промышленности (окраска тканей, приготовление светочувствительных фотоэмульсий), медицине и т. д.
Мировое производство лимонной кислоты в настоящее время составляет около 130 тыс. т в год. При культивировании на углеводах в качестве продуцентов лимонной кислоты используют мутантные штаммы Asp. niger, на н-парафинах — дрожжи Candida lipolitica, Candida guilliermondii, Candida oleophila и бактериальные штаммы из рода Corynebacterium, Arthrobacter.
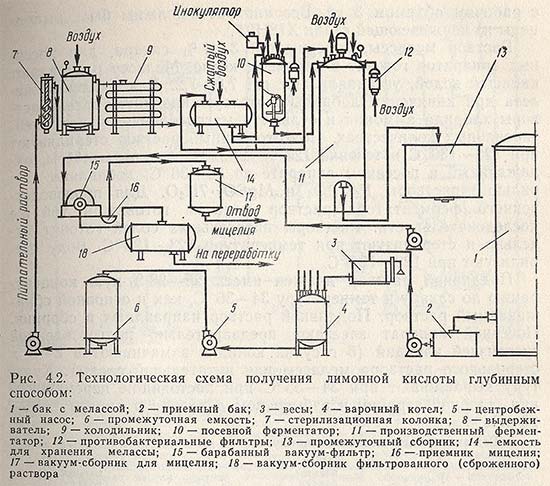
В Советском Союзе лимонную кислоту получают из мелассы микробиологическим синтезом, применяя главным образом микроскопические грибы Asp. niger, выращиваемые поверхностным или глубинным способом. Производство лимонной кислоты включает следующие основные технологические стадии: получение посевного материала, подготовку мелассы к сбраживанию, сбраживание растворов мелассы в лимонную кислоту с последующим отделением мицелия, выделение из сброженных растворов лимонной кислоты и получение ее в кристаллическом виде.
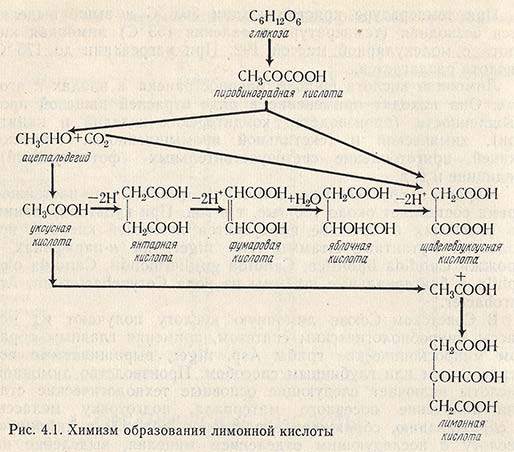
- Химизм образования лимонной кислоты
- Получение посевного материала
- Подготовка мелассы к сбраживанию
- Сбраживание растворов мелассы
- Получение цитрата кальция
- Упаривание раствора лимонной кислоты
- Кристаллизация и сушка лимонной кислоты
- Уравнение реакции разложения лимонной кислоты при нагревании с серной кислотой
- Серная кислота
- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- 💡 Видео
Видео:Серная кислота и ее соли. 9 класс.Скачать

Химизм образования лимонной кислоты
Синтез лимонной кислоты связан с циклом дикарбоновых кислот и происходит в результате конденсации какой-либо кислоты, содержащей четыре атома углерода и две карбоксильные группы, с кислотой, имеющей два атома углерода и одну карбоксильную группу. Химизм образования лимонной кислоты представлен на рис. 4.1. В результате гликолиза глюкозы образуется пировиноградная кислота. На следующем этапе происходит ферментативное связывание пировиноградной кислоты с диоксидом углерода. Образовавшаяся щавелевоуксусная кислота вступает далее в реакцию с уксусной кислотой и образуется лимонная кислота. Таким образом, химизм образования лимонной кислоты включает реакции гликолиза и ряд реакций, замкнутых в цикл Кребса. При каждом обороте этого цикла молекула щавелевоуксусной кислоты вступает во взаимодействие с молекулой уксусной кислоты, образуя лимонную кислоту.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Получение посевного материала
Для производства лимонной кислоты поверхностным и глубинным способами используют отселекционированные штаммы Asp. niger. Исходные культуры хранят в виде сухих спор (конидий) в смеси с активным углем. Тщательно проверенная на микробиологическую чистоту и биохимическую активность музейная культура используется для приготовления посевного материала. Посевной материал размножают в пробирках с агаризованной средой (сусло-агар, среда Журавского и др.), а затем в колбах и кюветах — на твердой питательной среде. Длительность каждой стадии 2-7 сут, оптимальная температура выращивания 32 °С. В процессе выращивания на поверхности твердой среды развивается плотная мицелиальная пленка, которая затем покрывается конидиями. На последней стадии (из кювет) зрелые конидии собирают при помощи специального вакуумного устройства. Для удлинения срока хранения конидии подсушивают при 32 °С, смешивая со стерильным наполнителем — активным углем или тальком в соотношении 1:2. Обработанные таким способом конидии можно хранить 1-2 года. С 10 дм2 площади кювет получают 3-4 г сухих конидий (площадь одной кюветы 8,5 дм2). Готовый посевной материал фасуют в стерильные стеклянные колбы или банки вместимостью от 0,5 до 1 л. Посевной материал хранится при комнатной температуре и относительной влажности воздуха 70%. Гарантированный срок годности конидий не менее 6 мес. со дня выпуска.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Подготовка мелассы к сбраживанию
Многие органические вещества, главным образом сахара, сбраживаются с образованием лимонной кислоты. Хороший выход получают обычно, если используют в качестве источника углерода глюкозу, фруктозу, сахарозу, мальтозу. Для промышленного производства лимонной кислоты в качестве субстрата применяют обычно мелассу — отход сахарного производства.
Меласса — нестандартное сырье, ее химический состав зависит от качества сахарной свеклы, технологии переработки и условий хранения. Пригодность мелассы для производства лимонной кислоты определяют на основе предварительных биохимических испытаний. Растворы мелассы сбраживают поверхностной и глубинной культурой соответствующего штамма гриба Asp. niger. Меласса считается пригодной для производства лимонной кислоты поверхностным способом, если съем лимонной кислоты при контрольном сбраживании составляет не менее 1,25 кг/(м2-сут), глубинным способом — 10-12 кг/(м3-сут).
Хорошо сбраживаемые мелассы обычно содержат не более 1,0% инвертного сахара, 1% СаО, 0,06% SO2 при общем содержании сухих веществ не менее 75% и сахара более 46%. В зависимости от способа сбраживания мелассу разбавляют и готовят растворы с различной концентрацией сахара: для поверхностного выращивания Asp. niger до 13-15%, для глубинного культивирования — 3-4% и 25-28%. В приготовленных растворах серной кислотой доводят pH до 6,8-7,5. Необработанная меласса плохо ассимилируется и сбраживается микроорганизмом-продуцентом, так как наряду с веществами, необходимыми для нормального роста гриба и активного кислотообразования, в ней содержатся минеральные и ограничение примеси, тормозящие рост гриба и подавляющие процесс образования лимонной кислоты. Это ионы тяжелых металлов, в первую очередь железа.
Меласса, как было сказано выше, не единственный источник сырья для получения лимонной кислоты. За последние годы в различных странах мира запатентованы способы получения лимонной кислоты путем культивирования микроорганизмов, в основном дрожжей рода Candida, на средах, содержащих в качестве источника углерода н-парафины, глицерин, этанол, кислоты уксусную, масляную, животные или растительные жиры.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Сбраживание растворов мелассы
Поверхностный способ. При поверхностном способе сбраживания подготовленная меласса подается в варочный котел, где разбавляется кипящей водой в соотношении 1:1, pH раствора доводится до значения 6,8-7,2. При кипячении вводится раствор желтой кровяной соли для осаждения железа и солей тяжелых металлов с таким расчетом, чтобы избыток свободного ферроцианида, поскольку он угнетает развитие микроорганизма, не превышал 10 мг %. В раствор мелассы при температуре 60-70°С последовательно добавляют источники фосфора (обычно стерильный раствор фосфата калия) и другие минеральные вещества, например сульфат цинка, стимулирующий биосинтез лимонной кислоты и рост мицелия. Для активного биосинтеза лимонной кислоты в питательной среде кроме сахара должны содержаться 0,07% азота, 0,016-0,021% Р2O5, цинк, магний, калий и другие элементы в небольших количествах. Готовая среда температурой 45-50 °С передается в бродильные камеры. Культивирование гриба осуществляется в кюветах из нержавеющей стали толщиной 2 мм или из алюминия марки АО-МО толщиной 4-5 мм, установленных на стеллажах. После предварительной стерилизации камер парами формалина, дегазации газообразным аммиаком и охлаждения до 30-40 °С воздухом производится (начиная с верхних) заполнение кювет питательной средой. В зависимости от высоты борта кювет питательный раствор наливают слоем от 8 до 18 см. В камере предусмотрена система вентиляции для подачи нагретого (до 30-32°С) стерильного кондиционированного воздуха из расчета 3-18 м3/ч на 1 м2 поверхности кювет. В питательную среду через воздуховоды с помощью специального устройства для распыления вносят посевной материал из расчета 50-75 мг конидий на 1 м2 площади кювет.
При поверхностном способе различаются 3 режима культивирования: бессменный, бессменный с доливами и односменный.
При бессменном режиме гриб Asp. niger культивируется на одной и той же питательной среде до окончания процесса кислотообразования. При односменном режиме культивирования примерно через 7 сут сброженный раствор мелассы сливается и после промывки пленки стерильной водой заливается новый раствор. Наиболее эффективным режимом культивирования является так называемый бессменный способ с доливом. Суть его заключается в том, что раствор мелассы в количестве 30-35% начального объема вводится под пленку гриба. Долив питательной среды производится один или несколько раз, начиная с 4-5-х суток роста, через каждые 36-48 ч. Добавляемый раствор мелассы содержит 8,5-11,0% сахара и не имеет в своем составе питательных солей и антисептиков. Такой режим обеспечивает увеличение съема лимонной кислоты с 1 м2 бродильной поверхности на 15-20 % и снижает удельный расход мелассы на 10-15 % по сравнению с другими методами.
В первые 24-36 ч, когда происходит интенсивный рост мицелия гриба, температуру поддерживают в пределах 34-36 °С. Для аэрации на каждый квадратный метр растущего мицелия подают 3-4 м3/ч воздуха. В период активного кислотообразования температуру раствора снижают до 32-34 °С, а подачу воздуха увеличивают до 15-18 м3/(м2-ч). По мере снижения интенсивности кислотообразования и уменьшения количества выделяемого тепла подачу воздуха в камеру постепенно снижают. Ежедневно, начиная с 5-х суток, отбирают пробы для определения титруемой кислотности и остаточного сахара. Брожение прекращают, когда в растворе остается 1-2% сахара и общая титруемая кислотность в сброженном растворе достигает 12-20%. Сброженный раствор сливают в сборник. Для промывки мицелия под грибную пленку подливают горячую воду. После слива промывных вод мицелий по вакуум-линии транспортируют в запарник, где мицелий отмывают от кислоты горячей водой. Кислые растворы (концентрация 2,5-6,0%), собранные из-под ложного днища запарника, подают на фильтр-пресс. Выгруженный из запарника с помощью шнека мицелий используется на корм скоту.
При поверхностном способе брожения основные растворы содержат от 12 до 20% органических кислот в пересчете на лимонную кислоту, 0,5-2,0% несброженных сахаров и другие продукты метаболизма. Лимонная кислота в сброженных растворах составляет 94-98%.
Глубинный способ. При глубинном способе сбраживания мелассных растворов процесс ведут в ферментаторах вместимостью 50 м3, разовая загрузка — 38 м3 (рис. 4.2). Конидии проращивают в посевных аппаратах вместимостью 5 м3 с рабочим объемом 3 м3. Все аппараты должны быть выполнены из нержавеющей стали Х18Н9Т.
Раствор мелассы, содержащий 3-4% сахара, для посевных аппаратов готовят в варочном котле. Мелассу разбавляют кипящей водой, устанавливают pH 7,0-7,2. Для удаления железа при кипячении добавляют желтую кровяную соль. Растворы хлорида аммония и сульфата магния вводят в регламентированных количествах. Подготовленный раствор стерилизуют при 128-130 °С в течение 12-15 мин. В раствор мелассы, охлажденный в посевном аппарате до 35-36 °С, добавляют стерильные растворы К2НРО4 и MgSO4-7H2O. Для производственного ферментатора раствор мелассы готовят в той же последовательности. Растворы питательных солей готовят отдельно и стерилизуют при температуре 123-125 °С. Воду стерилизуют при 128-130 °С.
Подливной раствор должен иметь 25-28%-ную концентрацию по сахару и температуру 34-36 °С, как и основной сбраживаемый раствор. Подливной раствор направляют в сборник. Посевной аппарат засевают предварительно подготовленной суспензией конидий (3 г сухих конидий замачивают в 2-3 л стерильного раствора мелассы или питательной среды). Культуру выращивают при 34-35°С при постоянном перемешивании, дробной аэрации и избыточном давлении в аппарате 10-20 кПа.
В период интенсивного вспенивания среды (12-24 ч) небольшими порциями подают пеногаситель (олеиновая кислота). Процесс подращивания мицелия заканчивается к 30-36 ч. Общая титруемая кислотность культуральной жидкости составляет 1,0-2,0%. Подращенный мицелий передают для засева среды производственного ферментатора.
Процесс кислотообразования продолжается 5-7 сут при температуре 31-32 °С, непрерывном перемешивании и дробной аэрации.
Начиная со 2-х суток после посева по мере снижения концентрации сахара в растворе проводят 2-3 подкормки. Дробное введение подливного 25-28%-ного раствора обычно проводят из расчета доведения конечной концентрации сахара в сбраживаемом растворе до 12-15%. Контроль за нарастанием титруемой кислотности и расходом сахара позволяет вовремя определить конец процесса и получить наибольший съем лимонной кислоты с 1 м3 ферментатора в сутки (не ниже 7,5 кг/м3). После окончания процесса сброженный раствор нагревают острым паром до 60-65 °С и сливают в сборник, откуда его подают на вакуум-фильтр для отделения и промывки мицелия горячей водой. Отделенный и промытый мицелий направляется на корм скоту. Основной раствор лимонной кислоты вместе с промывными водами передается в химический цех.
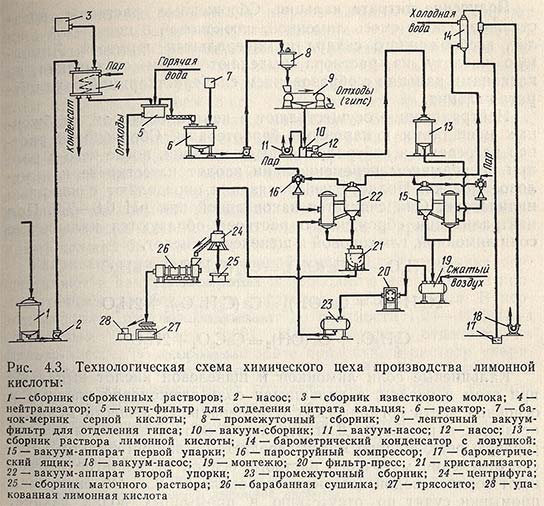
При глубинном способе сбраживания основные растворы содержат от 5 до 12 % органических кислот, 0,2-1,5% сахара, а лимонная кислота составляет 80-98% °т суммы всех кислот. Схема выделения лимонной кислоты из сброженных растворов представлена на рис. 4.3.
Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Получение цитрата кальция
Сброженные растворы представляют собой смесь лимонной, глюконовой и щавелевой кислот, несброженного сахара и минеральных примесей. Лимонную кислоту из раствора выделяют путем связывания ее катионами кальция с образованием слаборастворимой соли цитрата кальция.
Нейтрализацию осуществляют в нейтрализаторах, снабженных мешалками и паровыми барботерами. Сброженный раствор нагревают в нейтрализаторе до кипения, после чего в него при непрерывном перемешивании вводят известковое или меловое молоко. Полноту нейтрализации определяют с помощью индикатора. Она считается законченной при pH 6,8-7,5. При нейтрализации сброженного раствора образуются кальциевые соли лимонной, глюконовой и щавелевой кислот.
Кальциевые соли лимонной и щавелевой кислот выпадают при этом в осадок, а кальциевая соль глюконовой кислоты и основная часть органических и минеральных веществ мелассы остаются в растворе. Для отделения образовавшегося осадка горячую реакционную массу передают на вакуум-фильтры. После отделения маточного раствора осадок на фильтре промывают горячей водой (температура около 95 °С). Об окончании промывки судят по отсутствию в промывных водах сахара. Для подсушивания через осадок в течение некоторого времени пропускают воздух.
Перевод лимонной кислоты в свободное состояние и отделение ее от оксалата кальция достигается обработкой осадка серной кислотой с последующим фильтрованием. Разложение цитрата кальция осуществляют в реакторе, снабженном мешалкой и паровым барботером. В реактор подают воду из расчета 0,25-0,5 м3 на 1 т лимонной кислоты и при работающей мешалке загружают туда цитрат кальция с таким расчетом, чтобы после его разложения концентрация лимонной кислоты в растворе была не меньше 25%. В качестве осветлителя в реактор вводят активный уголь (2% к массе лимонной кислоты), содержимое реактора нагревают до 60 °С и при перемешивании подают из мерника серную кислоту (плотность 1,80-1,84) из расчета 0,425 л на 1 кг лимонной кислоты в цитрате. Смесь кипятят в течение 10-20 мин.
Разложение цитрата кальция серной кислотой протекает по уравнению
После полного разложения цитрата кальция (контролируют по отсутствию в среде цитрата кальция и серной кислоты) в реактор вводят гранулированный сернистый барий (из расчета 0,10-0,15 кг на 100 кг лимонной кислоты) для осаждения тяжелых металлов. Для отделения раствора лимонной кислоты от осадка, содержащего гипс, оксалат кальция, уголь, сернистые соединения тяжелых металлов и берлинскую лазурь, горячую реакционную смесь направляют из реактора на вакуум-фильтр. Отфильтрованный раствор передают на дополнительное упаривание, а осадок на фильтре промывают горячей водой (90°С). Промывку осадка прекращают при содержании лимонной кислоты в промывной воде 0,1 %. Средняя концентрация раствора лимонной кислоты (вместе с промывными водами) должна быть не ниже 16%.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Упаривание раствора лимонной кислоты
Упаривание осуществляют в вакуум-аппаратах и проводят в две стадии с промежуточным освобождением раствора от осадка гипса. В первом аппарате раствор упаривают до плотности 1,24-1,26 (под остаточным давлением 0,021 МПа), осадок отделяют на фильтр-прессе. Во втором аппарате прозрачный раствор упаривают (под остаточным давлением 0,021 МПа) до плотности 1,35-1,36, что соответствует концентрации лимонной кислоты 80% (около 1070 г моногидрата в 1 л).
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

Кристаллизация и сушка лимонной кислоты
Из вакуум-аппарата вторично упаренный раствор температурой 70 °С передают на кристаллизацию.
После заполнения кристаллизатора раствор охлаждают до 35-37 °С и вносят в него затравку — кристаллы лимонной кислоты. Кристаллизацию проводят при непрерывном перемешивании и медленном охлаждении до температуры 8-10 °С. При конечной температуре кристаллизации раствор выдерживают не менее 30-45 мин. Кристаллы отделяют в центрифуге, промывают их небольшим количеством холодной воды, затем кристаллы влажностью 2-3% передают на сушку.
Сушку проводят в ленточных или барабанных пневматических сушилках при температуре воздуха не более 35 °С. При: более высокой температуре происходит разрушение кристаллов вследствие потери ими кристаллизационной воды. В товарном продукте должно содержаться не менее 99,5% лимонной кислоты (в пересчете на моногидрат), зольность не более 0.1% для высшего сорта и 0,35% для I сорта.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Уравнение реакции разложения лимонной кислоты при нагревании с серной кислотой
Лимонная кислота (хим.) — 4-атомнотрехосновная оксикислота состава C 6H8O7 = СН 2 (СООН)·С(ОН)(СООН)·СН 2 (СООН), открыта Шееле в 1784 г. Лимонная кислота кислота очень распространена в растениях; в свободном виде и почти без примеси других кислот находится в значительном количестве в соке лимонов, в бруснике и клюкве; в смеси с яблочной и винной кислотами в крыжовнике, смородине, чернике, малине, рябине и др.; в виде солей калия и кальция в табаке, латуке, свекловице и пр. Лимонная кислота кислота применяется в ситцепечатании, в медицине, для приготовления лимонадов и проч. В технике она получается из лимонного сока, который содержит ее от 6 до 7%. Лимонная кислота сок насыщается при паровом нагреве мелом в деревянных, выложенных свинцом, чанах, при чем оседает трудно растворимая, особенно в горячей воде, лимонно-известковая соль. Осадок известковой соли промывается горячей водой и разлагается разбавленной серной кислотой. Раствор, содержащий освободившуюся из соли Лимонная кислота кислоту, отфильтровывается от осевшего гипса и сгущается при нагревании паром в свинцовых чренах или в вакуум-аппаратах и кристаллизуется в свинцовых кристаллизаторах. Для очищения Лимонная кислота кислоту вновь растворяют в воде, фильтруют через животный уголь и несколько раз перекристаллизовывают. Синтетически Лимонная кислота кислота получена (Grimaux et Adam, 1881) рядом превращений, исходя из симметрического дихлоргидрина глицерина СН 2 Сl·СН(ОН)·СН 2 Сl.
Ее можно получить также из ацетоуксусного эфира: СН 3 СО.СН 2 (СО 2 С 2 Н 5), переходя через СН 2 Сl·СО·СН 2 (СО 2C2 Н 5)
Этими реакциями синтеза и способностью легко переходить, отщепляя Н 2 О, в аконитовую кис. СН 2 (СООН)·С(СООН):СН(СООН), которая затем при восстановлении дает трикарбаллиловую кис. СН 2 (СООН)СН(СООН)СН 2 (СООН), вполне определяется вышеприведенное строение Лимонная кислота кислоты. Лимонная кислота кислота кристаллизуется в прозрачных бесцветных призмах ромбической системы, уд. веса 1,54, с одной частицей кристаллизационной воды. При 70-75° кристаллы спекаются, теряя воду. Если выпаривать раствор Лимонная кислота кислоты до тех пор, пока температура не достигнет 130°, то при охлаждении выделяются кристаллы безводной Лимонная кислота кислоты с темп. плав. 153°. Эти кристаллы обладают замечательным свойством выделяться и при последующих перекристаллизациях из холодных растворов в безводном состоянии (Witter, 1892). Лимонная кислота кислота оптически недеятельна (отличие от винной кислоты); растворяется в воде в 3 /4 своего веса при 15° и в 1 /2 при 1000; хорошо растворима в спирте, мало в эфире. При нагревании Лимонная кислота кислоты до 175° самой по себе, а также с крепкими кислотами, она переходит в аконитовую кислоту (см. выше), а при сухой перегонке, теряя воду и СО 2 и при одновременном образовании ацетона, в ангидриды итаконовой и цитраконовой кислот. Под влиянием окисляющих веществ (HNO 3, KMnO4 и др.) Лимонная кислота кислота в большинстве случаев дает либо щавелевую кислоту, либо ацетон. При нагревании с крепкой серной кислотой Лимонная кислота кислота, как α-оксикислота, отщепляет муравьиную кислоту и превращается в ацетондикарбоновую кислоту СН 2 (СОНО)·СО·СН 2 (СОНО), которая далее распадается на СО 2 и ацетон (ср. Молочная кислота). Как трехосновная кислота, Лимонная кислота кислота дает 3 ряда солей и сложных эфиров. Триметиловый эфир С 3 Н 4 (ОН)(СО 2 СН 3)3 кристалличен, плав. при 78,5-79° и перегоняется, отчасти разлагаясь, при 283°-287°. Триэтиловый эфир С 3 Н 4 (ОН)(СО 2 С 2 Н 5)3 жидкость, перегоняется при 185° (17 мм). Из солей Лимонная кислота кисл. только соли щелочных металлов легко растворимы в воде (для соли калия отличие от такой же соли винной кислоты). Из других примечательны соль кальция (С 6 Н 5 О 7)2 Са+4Н 2 О, которая труднее растворима в горячей воде, чем в холодной; соль бария (С 6 Н 5 О 7)2 Ва 3+3 1 /2 Н 2 О, представляющая под микроскопом характерную кристаллическую форму; серебряная соль — клочковатый осадок, растворимый в кипящей воде, и свинцовая — белый осадок, растворимый в аммиаке. Заключая в своем составе алкогольный водный остаток, Лимонная кислота кислота способна образовать сложные эфиры и с кислотами. Таковы: нитро-Лимонная кислота кислота (CH 2·COHO)2 ·С(NO 3)(COHO), образующаяся при действии на Лимонная кислота кислоту смеси дым. азотной кислоты с серной, и ацетил-Лимонная кислота кислота, образующаяся в виде эфиров С 3 Н 4 (О·СОСН 3)(СО 2R)3 при действии хлористого ацетила на упомянутые триметиловый и триэтиловый эфиры Лимонная кислота кислоты и в виде ангидрида С 3 Н 4 (О·СОН 3)(СОНО)(СО) 2 О (крист., темп. пл. 121°) при действии хлористого ацетила на самую Лимонная кислота кислоту. При действии иодистого этила на натриевое производное триэтилового эфира C 3 Н 4(NaO)(CO2 С 2H5)3 получен тетраэтиловый эфир C 3 Н 4(OC2 Н 5)(СО 2 С 2 Н 5)3, в котором четвертый остаток C 2 Н 5 замещает водород алкогольного водного остатка Лимонная кислота кисл. по типу простых эфиров. Лимонная кислота кислота и ее соли под влиянием различных микроорганизмов способны бродить: выделяется углекислота и образуются обыкновенно уксусная или масляная кислоты или же обе вместе, а иногда еще, смотря по условиям, спирт, водород и янтарная кислота. Аммиак, действуя на триметильный эфир, дает наряду с цитраминовыми кислотами цитрамид C 3H4 (ОН)(CONH 2)3, кристаллическое вещество, плавящееся с разложением при 210-215°.
Ф. Ю. Ворожейкин. Δ.
Лимонная кислота (мед.) — чистая, а чаще в виде свежевыжатого лимонного сока, назначается внутрь при скорбуте. У лихорадящих больных как утоляющее жажду питье в виде лимонада, шипучих порошков и т. п. В случае отравления щелочами (содой, поташем) Лимонная кислота кислотой можно воспользоваться безотлагательно как противоядием. Лимоннокислое железо и лимоннокислый хинин употребляются как горькие средства и как препараты железа.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
💡 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Триоксид Серы(6). Разложение Сульфаминовой кислоты. Ангидрид Серной кислоты.Скачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Признаки химических реакций. Урок 12. Химия 7 класс.Скачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Реакции разложения. Как понять?Скачать

Эта СУПЕРКИСЛОТА Растворит Все что угодно!Скачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Реакция алюминия с серной кислотойСкачать