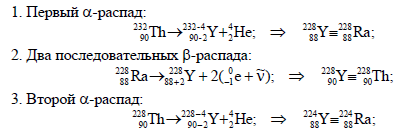- Ваш ответ
- решение вопроса
- Похожие вопросы
- Ядро изотопа тория 232 90 Th претерпевает α-распад, два электронных β-распада и ещё один α-распад. Ядро какого изотопа получается в результате таких превращений? Записать ядерные реакции соответствующих превращений.
- Химия
- ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
- 3. Строение атома
- 🎬 Видео
Видео:Уравнения ядерных реакций для разных видов распада (видео 19)| Квантовая физика | ФизикаСкачать

Ваш ответ
Видео:Ядерные реакции, закон радиоактивного распада. 9 класс.Скачать

решение вопроса
Видео:Торий - МЕТАЛЛ, КОТОРЫЙ НЕКУДА ДЕВАТЬ!Скачать

Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Урок 223 (осн). Альфа- и бета-распад. Правила Содди.Скачать

Ядро изотопа тория 232 90 Th претерпевает α-распад, два электронных β-распада и ещё один α-распад. Ядро какого изотопа получается в результате таких превращений? Записать ядерные реакции соответствующих превращений.
В курсе ядерной физики 11 класса может появиться задача подобного рода:
Ядро изотопа тория 232 90 Th претерпевает α-распад, два электронных β-распада и ещё один α-распад. Ядро какого изотопа получается в результате таких превращений? Записать ядерные реакции соответствующих превращений.
Правильное с высокой долей вероятности решение этого задания можно увидеть чуть ниже:
Нам дано ядро изотопа тория 232 90 Th. Оно претерпело альфа распад, два электронных бета распада и еще один альфа распад. Нам необходимо найти ядра изотопов, которые получаются в ходе таких превращений. В ходе работы мы нашли эти ядра, которые вы можете посмотреть выше. Это и является верным решением этой задачи.
Видео:Ядерные реакции. 10 класс.Скачать

Химия
Видео:Закон радиоактивного распада. Период полураспадаСкачать

ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
3. Строение атома
Ядро атома и радиоактивные превращения. В настоящее время в ядре атома открыто большое число элементарных частиц. Важнейшими из них являются протоны (символ p ) и нейтроны (символ n ). Обе эти частицы рассматриваются как два различных состояния ядерной частицы нуклона. Элементарные частицы характеризуются определенной массой и зарядом. Протон обладает массой 1,0073 а.е.м. и зарядом +1. Масса нейтрона равна 1,0087 а.е.м., а его заряд — нулю (частица электрически нейтральна). Можно сказать, что массы протона и нейтрона почти одинаковы.
Вскоре после открытия нейтрона , была создана протонно-нейтронная теорию строения ядра. Согласно этой теории ядра всех атомов, кроме ядра атома водорода, состоят из Z протонов (А — Z) нейтронов, где Z — порядковый номер элемента, А — массовое число.
Массовое число А указывает суммарное число протонов Z и нейтронов N в ядре атома, т.е.
Силы, удерживающие протоны и нейтроны в ядре, называются ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10 -15 м) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика. В ядре сосредоточена почти вся масса атома. Массой электронов по сравнению с массой ядра можно практически пренебречь. Свойства ядра определяются главным образом числом протонов и нейтронов, т.е. составом ядра. Состав ядер атомов различных химических элементов не одинаков, а потому элементы отличаются по атомной массе. И поскольку в состав ядра входят протоны, ядро заряжено положительно. Так как заряд ядра численно равен порядковому номеру элемента Z , то он определяет число электронов в электронной оболочке атома и ее строение, а тем самым и свойства химического элемента. Поэтому положительный заряд ядра, а не атомная масса является главной характеристикой атома, а значит, и элемента.
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Изотопы. Исследования показали, что в природе существуют атомы одного и того же элемента с разной массой. Так, встречаются атомы хлора с массой 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов.
Атомы одного и того же элемента, имеющие разную массу (массовое число), называют изотопами. Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с массовым числом 12 записывается так: 12 6 С, или 12 С, или словами: “углерод-12”. Эта форма записи распространена и на элементарные частицы: электрон 0 1 е, нейтрон 1 0 n, протон 1 1 p или 1 1 Н, нейтрино 0 0 n . Изотопы известны для всех химических элементов.
Обычно изотопы различных элементов не имеют специальных названий. Единственным исключением является водород, изотопы которого имеют специальные химические символы и названия: 1 H — протий, 2 D — дейтерий, 3 T — тритий. Это связано с тем, что относительное отличие масс изотопов для водорода является максимальным среди всех химических элементов.
Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом их распространенности.
Так, например, природный хлор состоит из 75,4% изотопа с массовым числом 35 и из 24,6% изотопа с массовым числом 37; средняя атомная масса хлора 35,453. Средняя атомная масса природного лития, содержащего 92,7% 7 3 Li и 7,3% 6 3 Li равна 6,94 и т.д. Атомные массы элементов, приводимые в периодической системе Д. И. Менделеева, есть средние массовые числа природных смесей изотопов. Это одна из причин, почему они отличаются от целочисленные значений. Наряду с термином “изотопы” используется термин “нуклид”. Нуклид — это атом со строго определенным значением массового числа, т.е. с фиксированным значением числа протонов и нейтронов в ядре. Радиоактивный нуклид сокращенно называют радионуклид. Термин “изотопы” следует применять только для обозначения стабильных и радиоактивных нуклидов одного элемента.
Устойчивые и неустойчивые изотопы. Все изотопы подразделяются на стабильные и радиоактивные. Стабильные изотопы не подвергаются радиоактивному распаду, поэтому они и сохраняются в природных условиях. Примерами стабильных изотопов являются 16 О, 12 С, 19 F. Большинство природных элементов состоит из смеси двух или большего числа стабильных изотопов. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов). В редких случаях, например у алюминия, в природе встречается только один стабильный изотоп, а остальные изотопы неустойчивы.
Радиоактивные изотопы подразделяются, в свою очередь, на естественные и искусственные — и те и другие самопроизвольно распадаются, испуская при этом a — или b -частипы до тех пор, пока не образуется стабильный изотоп. Химические свойства всех изотопов в основном одинаковы. Эти свойства определяются главным образом зарядом ядра, а не его массой.
С помощью ядерных реакций получают изотопы, обладающие радиоактивностью (радиоактивные изотопы). Все они неустойчивы и в результате радиоактивного распада превращаются в изотопы других элементов.
Радиоактивные изотопы получены для всех химических элементов. Их известно около 1500. Элементы, состоящие только из радиоактивных изотопов, называются радиоактивными. Это элементы с Z = 43, 61 и 84 — 107.
Стабильных (нерадиоактивных) изотопов известно около 300. Из них состоит большинство химических элементов периодической системы элементов Д.И. Менделеева. У некоторых элементов наряду со стабильными имеются и долгоживущие радиоактивные изотопы. Это 40 19 K, 87 37 Rb, 115 49 In и др.
По химическим свойствам радиоактивные изотопы почти не отличаются от стабильных. Поэтому они служат в качестве “меченых” атомов, позволяющих по измерению их радиоактивности следить за поведением всех атомов данного элемента и за их передвижением. Радиоактивные изотопы широко применяются в научных исследованиях, в промышленности, сельском хозяйстве, медицине, биологии и химии. В настоящее время их получают в больших количествах.
Виды радиоактивного распада. Существует три основных вида самопроизвольных ядерных превращений.
1. a — распад. Ядро испускает a — частицу, которая представляет собой ядро атома гелия 4 Не и состоит из двух протонов и двух нейтронов. При a — распаде массовое число изотопа уменьшается на 4, а заряд ядра — на 2 :
2. b -распад. В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электрон ( b -частицу) и антинейтрино:
При b -распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1:
3. g -распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и очень высокой частотой ( g -излучение), при этом энергия ядра уменьшается, массовое число и заряд ядра остаются неизменными.
Радиоактивные превращения . Ядерные реакции — это превращение атомных ядер в результате их взаимодействия с элементарными частицами и друг с другом. Написание уравнений таких реакций основано на законах сохранения массы и заряда. Это означает, что сумма масс и сумма зарядов в левой части уравнения должна быть равна сумме масс и сумме зарядов в правой части уравнения :
Это уравнение показывает, что при взаимодействии атома алюминия с 
Более употребительна краткая запись ядерных реакций. Вначале записывают химический знак исходного ядра, затем (в скобках) кратко обозначают частицу, вызвавшую реакцию, и частицу, образовавшуюся в результате реакции, после чего ставят химический знак конечного ядра. При этом у символов исходного и конечного ядер обычно проставляются только массовые числа, так как заряды ядер легко определять по периодической системе элементов Д.И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая:
где a — обозначение a -частицы ( 4 2 Не); р — протона ( 1 1 Н); черточка означает отсутствие действующей частицы в случае радиоактивного распада.
Важнейшей особенностью ядерных реакций является выделение огромного количества энергии в форме кинетической энергии образующихся частиц или в форме энергии излучения. В химических реакциях энергия выделяется главным образом в форме теплоты. Энергия ядерных реакций превышает энергию химических реакций в миллионы раз. Этим объясняется неразрушимость ядер атомов при протекании химических реакций.
Скорость радиоактивного распада. Период полураспада. Скорости распада радиоактивных элементов сильно отличаются от одного элемента к другому и не зависят от внешних условий, таких, например, как температура (в этом состоит важное отличие ядерных реакций от обычных химических превращений). Каждый радиоактивный элемент характеризуется периодом полураспада t 1/2 , т. е. временем, за которое самопроизвольно распадается половина атомов исходного вещества. Для разных элементов период полураспада имеет сильно отличающиеся значения. Так, для урана 238 U период полураспада t 1/2 = 4,5 × 10 9 лет. Именно поэтому активность урана в течение нескольких лет заметно не меняется. Для радия 226 Ra период полураспада t 1/2 = 1600 лет, поэтому и активность радия больше, чем урана. Ясно, что чем меньше период полураспада, тем быстрее протекает радиоактивный распад. Для разных элементов период полураспада может изменяться от миллионных долей секунды до миллиардов лет.
На примере естественного распада урана 238 U показаны превращения, которые через промежуточные радиоактивные элементы приводят к устойчивому элементу — свинцу 206 Р b . Схема хорошо иллюстрирует различие в периодах полураспада t 1/2 для различных элементов (периоды полураспада даны внизу под стрелкой, частицы, испускаемые радиоактивными элементами, — над стрелкой).
Уравнение радиоактивного распада. Математическое уравнение, описывающее закон радиоактивного распада, связывает значение массы m(t) радиоактивного изотопа в момент времени t с начальной массой m 0 :
Кроме приведенного на рисунке естественного ряда радиоактивных элементов (так называемого ряда урана), известны еще два других естественных ряда — это ряд актиния, начинающийся с 235 U и заканчивающийся 208 Р b , и ряд тория, начинающийся с 232 Т h и заканчивающийся 208 Р b . Существует еще и четвертый ряд радиоактивных изотопов, этот ряд получен искусственно.
Искусственные превращения , ядерный синтез. Первая искусственная ядерная реакция была осуществлена Резерфордом путем бомбардировки атомов азота a частицами :
В настоящее время, чтобы осуществить искусственные превращения, чаще используют протоны или нейтроны, например:
В ядерных реакциях (в случае естественного или искусственного превращения элементов) сумма атомных масс (сумма индексов слева вверху) реагентов и продуктов всегда одинакова. Это относится и к зарядам ядер (индексы слева внизу, которые часто опускаются).
В 1930 г. был создан первый в мире циклотрон (ускоритель элементарных частиц — “снарядов” для бомбардировки ядер атомов), после чего было открыто и изучено множество разнообразных ядерных реакций. В настоящее время специальная область химии, ядерная химия, занимается изучением превращений элементов.
Особую важность представлял синтез неизвестных ранее элементов: технеция, франция, астата и др., а также всех трансурановых элементов (элементов, порядковый номер которых превышает 92). В настоящее время получено 17 трансурановых элементов (от Z = 93 до Z = 109 включительно). Работы в этой области проводятся в Объединенном институте ядерных исследований в г. Дубне. Там впервые были синтезированы элементы с порядковыми номерами 102, 103, 104, 105, 106, 107. Ведутся работы по синтезу элементов с более тяжелыми ядрами.
🎬 Видео
Закон радиоактивного распада. 11 класс.Скачать

Урок 467. Радиоактивные превращения. Правила смещения СоддиСкачать

Уран - САМЫЙ ОПАСНЫЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

Физика 11 класс (Урок№28 - Ядерные реакции.)Скачать

Качественная реакция на соединения торияСкачать

Ядерные реакции. Простой и понятный советский научный фильм.Скачать

Радий - САМЫЙ РАДИОАКТИВНЫЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

Виды ядерного распада(видео 18) | Квантовая физика | ФизикаСкачать

Чем заменить уран? Почему ученые молчат 12+Скачать

Радиохимия (часть 3) Half Life / закон радиоактивного распада / Химия – ПростоСкачать

Урок 468. Закон радиоактивного распадаСкачать

Радиоактивность. 10 класс.Скачать

Закон радиоактивного распада. Период полураспада. Изотопы | Физика 11 класс #49 | ИнфоурокСкачать

Почему до сих пор нет ториевой энергетики (Взрослый ответ на детский вопрос)Скачать