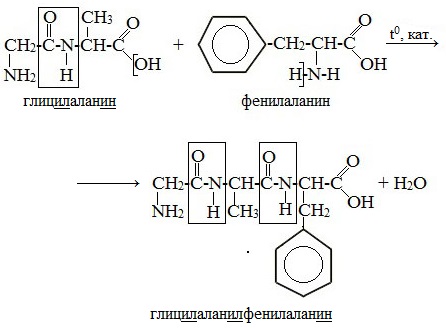
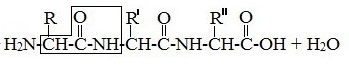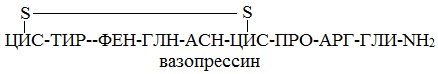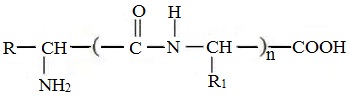напишите уравнние реакции образования трипептида гли-ала-сер и составьте формулы еще 2-ух изомеров этого трипептида.очень безотлагательно плз
- Игорь
- Химия 2019-04-12 06:41:15 1 1
H2N-CH-CO-NH-CH2-CO-NH-CH-COOH — Ala-Gly-Ser
I I
CH3 CH2
I
OH
H2N-CH-CO-NH-CH-CO-NH-CH2-COOH — Ala-Ser-Gly
I I
CH3 CH2
I
OH
Видео:Пептидная связь. 11 класс.Скачать

Уравнение реакции получения трипептида ала гли цис
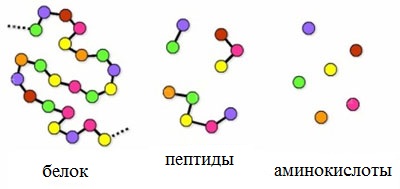
Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями —С(О)NН- .
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
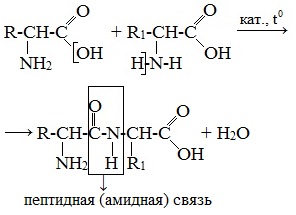
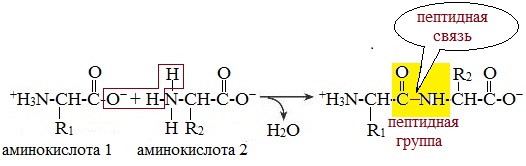
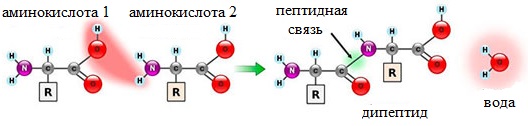
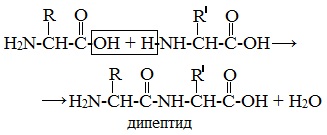
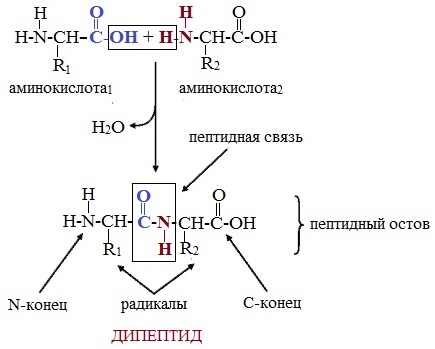
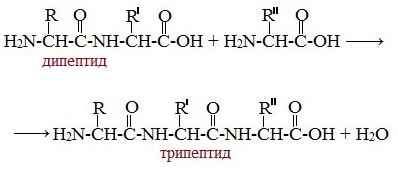
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH- .
Образование дипептидов
Две аминокислоты образуют дипептид:
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
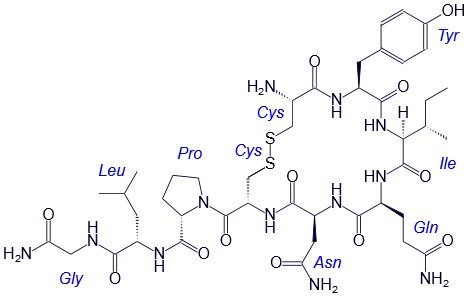
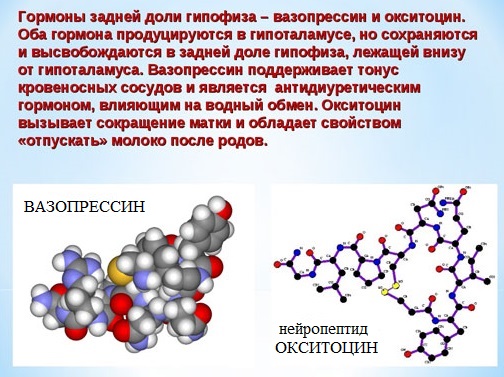
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
Номенклатура
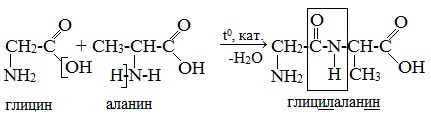
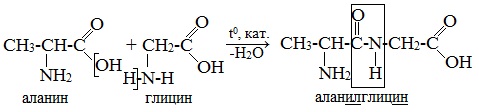
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Видео:Трипептиды как составлять (РязГМУ 2 семестр последний коллок)Скачать

Интегрированный урок (биология + химия) по теме «Белки»
Разделы: Биология
“Нельзя питать надежду на то, что когда-либо мы сумеем искусственно производить органические вещества”.
Берцелиус (1844)
Цели и задачи:
- Расширить знания учащихся о природных высокомолекулярных веществах – белках.
- Раскрыть ведущую роль белков в строении и жизнедеятельности клетки.
- Сформировать представление о связи между строением, свойствами и применением белков через лабораторный эксперимент.
Тип занятия: урок усвоения новых знаний.
Форма проведения занятия: урок-лекция с элементами лабораторного практикума и медиа-технологий.
Оборудование и материалы: таблицы “Функции белков”, модель молекулы белка (бусы – первичная структура, спирально закрученный телефонный шнур – вторичная структура), карточки с названиями аминокислот (аланин, глицин, цистеин), цветные карандаши, персональный компьютер, медиа-проектор, презентация (слайд-шоу), химические реактивы: растворы гидроксида натрия, сульфата меди, азотной кислоты; химическая посуда, спиртовки, держатели для пробирок, выставка дополнительной литературы.
Оформление доски: тема, эпиграф и план урока.
План урока:
- Введение.
- История исследования белка.
- Аминокислоты – основа белка.
- Структура белковых молекул.
- Химические свойства белка (лабораторный опыт).
- Биологическое разнообразие и значение белков.
- Функции белков (демонстрационный опыт).
- Повторение и выводы.
На перемене выставка дополнительной литературы о белках.
Учитель биологии. (слайд 1) “Жизнь есть способ существования белковых тел” – этими словами Ф. Энгельса можно начать наш урок, тема которого “Белки”. Основная цель – проследить взаимосвязь строения белка с его свойствами и функциями. Эта тема изучается как в курсе биологии, так и химии, поэтому мы и проводим сегодня интегрированный урок. Работать мы будем согласно плану, который вы видите на доске. Для того, чтоб наш урок проходил более динамично, мы подготовили и раздали каждому из вас опорные карточки-конспекты, с которыми вы будете работать в течении урока, а потом вклеите их в тетради.
Белки называют также протеинами от греческого “protos” – первый, главный. Этим названием подчеркивается первостепенное значение белков для живых организмов (слайд 2). В протоплазме и ядре клеток их содержание достигает 10–20 %. На слайде видно, что за исключением неорганических веществ, белки занимают ведущее место. Другими словами белки – основной структурный компонент живых организмов. Например, волосы, сосуды, оболочки, ногти состоят практически полностью из белков.
Учитель химии. Что же представляют из себя белки в химическом смысле? Еще к началу XIX века было установлено, что все белковые молекулы имеют большую молекулярную массу и состоят из атомов углерода, водорода, кислорода, азота, и серы (слайд 3).
Основоположником исследований строения белка является немецкий химик Эмиль Фишер, применивший для этого реакцию гидролиза. Он показал, что при гидролизе белков образуется смесь, состоящая из 20 различных аминокислот (слайд 4). На слайде приведены их тривиальные названия и показано химическое строение некоторых из них. В ваших конспектах вы так же найдете структурные формулы этих аминокислот, но некоторые из них не названы. Итак, вместо точек напишите названия аминокислот по международной номенклатуре, кто справится с заданием поднимает руку. (Задание в опорном конспекте)
Задание 1: Вместо точек напишите названия веществ по международной номенклатуре.
глицин (2-амино-этановая кислота)
валин (2-амино-3-метил-бутановая кислота)
лейцин (2-амино-4-метил-пентановая кислота)
Обратите внимание, что кроме карбоксильных и аминогрупп в состав аминокислот могут входить и другие функциональные группы, такие как гидрокси- (–OH), тио- (–SH) группы, а так же ароматические фрагменты.
При внимательном рассмотрении формул аминокислот, можно заметить, что все они содержат одинаковый фрагмент – аминогруппа находится у второго атома углерода, т.е. это 2-аминокислоты. Отличие между ними состоит в строении радикала, связанным с этим фрагментом. Поэтому аминокислоты, входящие в состав белков можно выразить одной общей формулой (слайд 5). Радикал R связанный с фрагментом 2-аминокислоты (слайд 6).
Для объяснения строения белковых молекул Э. Фишер выдвигает полипептидную теорию, согласно которой аминокислотные остатки в белках связаны так называемыми пептидными связями (слайд 7). На слайде показан синтез простейшего белка – дипептида (т.е. состоящего всего из двух аминокислотных остатков). Обратная реакция – взаимодействие пептида с водой, т.е. гидролиз. Видно, что при гидролизе мы получаем исходные молекулы аминокислот (слайд 7).
В ваших конспектах так же имеется пример образования белка состоящего из трех фрагментов аминокислот, другими словами трипептида:
В общем виде для полипептида:
R1, R2, R3 . – одинаковые или разные радикалы.
Итак, белок это полимерная макромолекула, построенная их аминокислотных остатков и имеющая очень сложную структуру.
Учитель биологии: Действительно, в белковой молекуле можно выделить первичную, вторичную, третичную и даже четвертичную структуры.
Первичная структура – порядок чередования аминокислотных фрагментов в полипептидной цепи, определяемой генотипом (слайд 8). Эта последовательность очень строгая и замена хотя бы одной аминокислоты приводит к изменению свойств белка, а в некоторых случаях происходит потеря их биологических свойств. Поэтому, искусственно синтезированные полипептидные цепочки зачастую не обладают природными биологическими свойствами.
Например, такое заболевание как серповидноклеточная анемия (демонстрация рисунка) связано с изменением формы эритроцита и невозможностью нормального транспорта кислорода. Причина же – одна единственная ошибка, когда из 146 аминокислотных фрагментов этого белка один – глутаминовая кислота заменяется на другой – валин.
Многообразие белков можно объяснить практически безграничными возможностями перестановок остатков аминокислот относительно друг друга.
Задание 2. Составьте формулы всех возможных трипептидов из остатков глицина (гли), аланина (ала) и цистеина (цис):
| 1. гли-ала-цис 2. ___________ 3. ___________ | 4. ____________ 5. ____________ 6. ____________ | 7. ____________ 8. ____________ 9. ____________ |
Трое учащихся с табличками на которых написаны названия аминокислот выстраиваются в произвольной последовательности. Остальные учащиеся записывают в тетради названия полученного трипептида, например, ГЛИ-АЛА-ЦИС. Далее учащиеся меняются местами и составляют все возможные варианты.
– Таким образом, даже из 3 аминокислот мы получили шесть белковых молекул. А в общем случае число возможных вариантов будет
Pn = 1 . 2 . 3… . n = n! И для Р10 = 6328800 изомеров, т.е. любой живой организм будет полностью индивидуален по структуре белковых молекул.
Наиболее ярким примером огромного многообразия белковых молекул является любопытный расчет индийского ученого Синга. Он взял белок с молекулярной массой 34000. И если даже его состав будут входить не все 20, а только 12 аминокислот, то число возможных изомеров будет равно 10 300 . Чтобы ощуить всю громадность этой цифры представим 10 300 однокопеечных монет. Такая груда весит соответственно 10 300 грамм, а масса земного шара лишь 10 27 грамм. Т.е. это равно по массе 10 273 планет Земля.
Задание 3 (домашнее): Рассчитайте количество аминокислотных остатков в белках учитывая, что средняя молекулярная масса аминокислоты равна 110.
- Инсулин
.… аминокислотных остатков, масса – 5700
Альбумин
.… аминокислотных остатков, масса – 36000
Гемоглобин
.… аминокислотных остатков, масса – 65000
Учитель химии. Можно предположить, что полипептидная цепь, должна иметь линейное строение (демонстрируются бусы). В действительности же строго линейная структура характерна лишь для ограниченного числа белков (например, фиброин – белок натурального шелка). Подавляющее число белковых молекул свернуты в виде правильной винтовой спирали. Такая пространственная структура полипептидной цепи называется вторичной структурой белка (слайд 9). Белковая спираль сохраняет свою форму благодаря образованию большого числа водородных связей между группами NH и CO, находящихся на соседних витках спирали.
Найдите в ваших конспектах задание 4 в котором требуется объяснить, почему между этими группами происходит образование водородных связей.
Задание 4. Укажите смещение общих электронных пар для всех ковалентных связей и заряды, возникающие на атомах N, H, C и O.
> N – H O = C 2+ проявляет слабовыраженные окислительные свойства и является хорошим комплексообразователем. Для катионов щелочных и щелочноземельных металлов такие свойства не характерны.
Учитель биологии: Влияние на организм тяжелых металлов – актуальная экологическая проблема. Наиболее сильному воздействию подвержены жители мегаполисов с связи с повышенным антропогенным загрязнением этими металлами. Типичный пример: – тетраэтилсвинец, который добавляется в бензины для повышения их октанового числа.
Кроме того, есть ряд других факторов, вызывающих денатурацию белков, это различные виды излучения, в том числе радиоактивное и ультрафиолетовое.
Учитель химии: Продолжая знакомство с химическими свойствами белков нельзя обойти вниманием две качественные реакции, которые применяют для распознавания белковых веществ в животных и растительных объектах. Традиционно их называют цветными реакциями белков. Рассмотрим цветные реакции на примере молочного белка – казеина.
(Учитель химии проводит демонстрационные реакции)
а) Биуретовая реакция. К исследуемому раствору приливают NaOH и по каплям добавляют раствор СuSO4. Характерная фиолетовая или красно-фиолетовая окраска появляется в том случае, если вещество содержит пептидные связи. Наличие пептидных связей как раз характерно только для белковых молекул.
Учащиеся в своих опорных конспектах отмечают при помощи цветных карандашей наблюдаемые изменения и дополняют указанную схему:
б). Ксантопротеиновая реакция. К исследуемому раствору приливают HNO3, для ускорения реакции несильно нагревают. Характерное желтое окрашивание появляется в том случае, если белки содержат в своем составе ароматические фрагменты – происходит их нитрование. Имея сложную структуру, большинство белков, как правило, содержат ароматические кольца.
Учащиеся в своих опорных конспектах так же отмечают наблюдаемые изменения и дополняют указанную схему:
На этом завершается первый урок. Учителя напоминают о выставке дополнительной научной литературы, медиа-пособий по данной теме которую учащиеся могут посмотреть на перемене.
Лабораторный опыт “Определение белка в различных материалах”
Каждой группе я раздаю карточки с заданием, вы проводите реакции, наблюдения отображаете на рисунках и рассказываете нам о своих выводах.
Учитель биологии. Значение белка и функции белка
Учитель химии. Лабораторный опыт “Действие фермента каталазы”.
Цель: доказать присутствие ферментов в животных и растительных клетках.
Фермент каталаза катализирует расщепление токсичной перекиси водорода которая непрерывно образуется в клетке в процессе жизнедеятельности. Активность этого фермента очень высока: даже при 0 °С – 1 молекула каталазы разлагает до 40 000 молекул Н2О2 в секунду.
Найдите в карточках задание 6 и напишите уравнение реакции разложения перекиси водорода:
Я приливаю по 1 мл Н2О2 в пробирки с сырой и вареной печенью, сырым и вареным картофелем. Внесите ваши наблюдения в таблицу, сделайте вывод.
В конце закрепление пространственной структуры белков (слайд 12) и модели молекул белков (слайд 13).
Устные вопросы в конце урока
1. На рубашке осталось пятно от мясного соуса. Почему даже после ее кипячения с биопорошком пятно осталось?
2. Почему свежие пятна крови на одежде нельзя отстирывать в горячей воде?
3. Почему при массовом выпадении и хрупкости волос врачи-косметологи прописывают принимать серусодержащие препараты?
4. Почему при применении препаратов для химической завивки особенно тщательно рекомендуют защищать ногти, в то время как этот состав довольно длительное время взаимодействует с кожей головы, не причиняя особого вреда?
5. Подумайте, почему, для того чтобы получить вкусный бульон, мясо кладут в холодную воду, а для вкусного мяса его опускают в кипяток?
6. Подумайте, почему мясной суп полезней для растущего организма, чем овощной?
7. Почему молоко сворачивается естественным образом при долгом хранении в теплом месте?
8. Почему в инструкции к стиральным порошкам с биологически активными добавками пишут, что эти средства не рекомендуется применять для стирки изделий их натуральной шерсти?
🎦 Видео
Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Определение pI (изоэлектрической точки) пептидов. Биохимия.Скачать

Образование пептидов. Запись структурной формулы пептидаСкачать

Кислотно-основные свойства пептидов. Изоэлектрическая точка.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.Скачать

Задача на определение формулы трипептида. Биохимия.Скачать

Биохимия. Белки. Строим полипептидную цепь.Скачать

25. Схема реакции и химическое уравнениеСкачать

Реакция торможения гемагглютинацииСкачать

Изоэлектрическая точка (ИЭТ или pI) для аминокислот. Учимся вычислять. Биохимия.Скачать

Реакции преципитации. Реакция двойной иммунодиффузииСкачать

1.2. Формирование заряда у пептидов. ИЭТСкачать

Получение Тетраамминокупрохлората - [Cu(NH3)4]ClO3.Скачать
![Получение Тетраамминокупрохлората - [Cu(NH3)4]ClO3.](https://i.ytimg.com/vi/u8M1lMmm4l0/0.jpg)