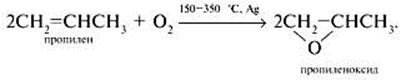При нагревании в присутствии серебряных катализаторов:
Получение
| В лаборатории |
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование пропина в присутствии катализатора (Pd):
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Янтарная кислота(Бурштиновая кислота)
| Химическая формула | НООС-СН2-СН2-СООН |
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Биохимическая роль
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши) [2] .
Применение
Янтарную кислоту используют для получения пластмасс, смол, лекарственных препаратов (в частности, хинолитина), для синтетических целей, а также в аналитической химии.
В пищевой промышленности используется в качестве пищевой добавки E363.
В медицине янтарная кислота применяется, в частности, как одно из средств для борьбы с похмельным синдромом [источник?] .
Химические свойства.
Янтарная кислота содержится в небольшом кол-ве в буром угле, прир. смолах, в янтаре (отсюда название). Найдена во мн. растениях.
Конденсация янтарной кислоты или ее эфиров с кетонами и альдегидами в присут. оснований приводит к алкилиденянтарным к-там (см. Штоббе конденсация); при взаимод. с аммиаком и аминами образуются сукцинимид и его N-замещенные производные; с ароматич. соед. в условиях р-ции Фриделя-Крафтса -4-арил-4-кетомасляная к-та (р-ция сукциноилирования). При окислении янтарной кислоты Н2О2 в зависимости от условий образуются пероксиянтарная (СН2СОООН)2, оксоянтарная или малоновая к-ты либо смесь ацетальдегида, малоновой и малеиновой к-т, при окислении КМnО4 — щавелевая к-та или смесь малоновой и винной к-т, при окислении NaClO4 — 3-гидроксипропионовая к-та, Каталитич. восстановление янтарной кислоты в зависимости от катализатора и условий р-ции приводит к 1,4-бутандиолу, 

При 235 °С янтарная кислота отщепляет воду, давая янтарный ангидрид, при фотохим. распаде mpem-бутилпероксиэфиров — этилен.
Я нтарная кислота вступает в р-ции замещения по активным метиленовым группам. Нагревание с бромом в закрытом сосуде при 100 °С дает с количеств. выходом 2,3-дибромянтарную к-ту.
Янтарную кислоту получают в качестве побочного продукта при произ-ве адипиновой к-ты, а также выделяют из смеси к-т, образующихся при окисленииуглеводородов С4 — С10. Янтарная кислота может быть получена окислением фурфурола пероксидом водорода, гидрированием малеинового ангидрида с последующей гидратацией. Известен пром. способ выделения янтарной кислоты из отходов янтаря.
Соли янтарной кислоты образуются при окислении 1,4-бутандиола р-ром Na2O2 или 
Применяют янтарную кислоту для получения алкидных смол, сукцинатов, фотоматериалов, красителей, лек. в-в. Эфиры янтарной кислоты используют в пищ. и парфюм. пром-сти. Так, диэтилсукцинат -ароматизатор для пищ. продуктов, компонент парфюм. композиций (запах цветов); обладает также св-вамипластификатора. Моно- и диамиды янтарной кислоты с ароматич. и гетероциклич. аминами применяют в произ-ве нек-рых красителей и инсектицидов.
Для янтарной кислоты ПДК в воде водоемов 0,01 мг/л.
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 21, N. Y., 1983, p. 848-6
- Уравнение реакции окисления пропена кислородом
- Химические свойства алкенов
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
- 💥 Видео
Видео:Уравнивание реакций горения углеводородовСкачать

Уравнение реакции окисления пропена кислородом
Органическое вещество А, широко используемое в производстве пластмасс, состоит из трёх элементов. Оно содержит 5,66% водорода и 26,42% азота по массе. Вещество А образуется при окислении пропена кислородом воздуха в присутствии аммиака. Оно легко вступает в реакции полимеризации и сополимеризации. Определите молекулярную формулу вещества А, установите его структуру и напишите уравнение полимеризации.
1) Определена молекулярная формула вещества A:
n(C) : n(H) : n(N) = ((100 –5,66 – 26,42) / 12) : (5,66 / 1) : (26,42 / 14) =5,66 : 5,66 : 1,89 = 3 : 3 : 1 .
Простейшая формула – .
Вещество А образуется при окислении пропена, значит, в молекуле вещества А три атома углерода, и молекулярная формула совпадает с простейшей.
Молекулярная формула – .
2) Вещество А легко вступает в реакции полимеризации и сополимеризации, значит, содержит кратную связь. При окислении пропена кислородом воздуха в присутствии аммиака образуется акрилонитрил:
3) Уравнение полимеризации акрилонитрила:
| Критерии оценивания выполнения задания | Баллы | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ответ правильный и полный: − правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества; − записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать  Химические свойства алкеновАлкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С. Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать  Химические свойства алкеновАлкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов. Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
Можно примерно оценить энергию π-связи в составе двойной связи С=С: Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам. Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение). Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  1. Реакции присоединенияДля алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена. 1.1. ГидрированиеАлкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
1.2. Галогенирование алкеновПрисоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму. 1.3. Гидрогалогенирование алкеновАлкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.4. ГидратацияГидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Гидратация алкенов также протекает по ионному (электрофильному) механизму. Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
1.5. ПолимеризацияПолимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать  2. Окисление алкеновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое. 2.1. Каталитическое окислениеКаталитическое окисление протекает под действием катализатора.
2.2. Мягкое окислениеМягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается. В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи. При этом образуются двухатомные спирты (диолы).
2.2. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2. Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота: При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон: При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления. 2.3. Горение алкеновАлкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкенов выглядит так:
3. Замещение в боковой цепиАлкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы. При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
4. Изомеризация алкеновПри нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы. 💥 ВидеоОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химия 9 класс — Как определять Степень Окисления?Скачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Составление уравнений реакций горения. 11 класс.Скачать  Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Окисление органических соединений перманганатом калияСкачать  Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Химия с нуля — Химические свойства АлкеновСкачать  Реакции металлов с кислородом и водой. 8 класс.Скачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  ЕГЭ ХИМИЯ/Окисление пропена в жестких условиях/органикаСкачать  |