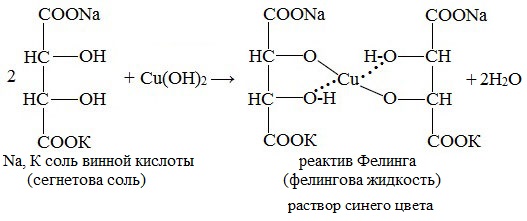
Реактив Фелинга (медно-тартратный реактив, фелингова жидкость) — состоит из равных объемов раствора сложной соли тартрата натрия-калия (сегнетова соль, натрий-калий виннокислый) в 10%-ном р-ре NaOH и раствора сульфата меди.
Приготавливается непосредственно перед анализом путем смешения двух растворов.
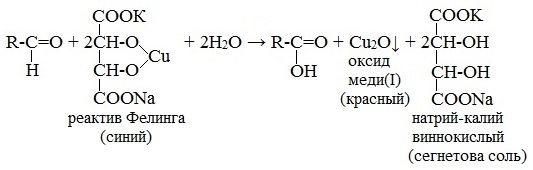
Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений.
При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O.
Впервые был предложен в 1850 году немецким химиком Г. Фелингом.
Реакция на моносахариды
Глюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими.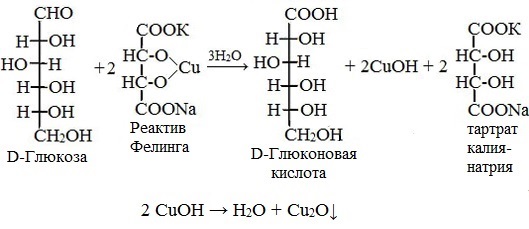
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Реакция на альдегиды
Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную.
Ароматические альдегиды эту реакцию не дают.
Образование реактива Фелинга
Реактив Фелинга используется как качественная реакция для определения альдегидной группы.
Видео:Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать

Лабораторные органическая химия. Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты
| Название | Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты |
| Анкор | Лабораторные органическая химия .doc |
| Дата | 22.04.2017 |
| Размер | 0.81 Mb. |
| Формат файла |  |
| Имя файла | Лабораторные органическая химия .doc |
| Тип | Лабораторная работа #5376 |
| страница | 3 из 3 |
| Подборка по базе: Лабораторная работа-раб с вирт машинами.docx, курсовая работа.docx, Конттрольная работа по дисциплине Документирование.docx, Практическая работа.docx, Проектная работа.docx, ПРАКТИЧЕСКАЯ РАБОТА №1 ЗаданиеИностранный язык. Английский. Част, иностранный язык письменная работа.docx, Курсовая работаЭкономика организации.docx, Практическая работа Русский язык.docx, Лабораторная работа №1.pdf Опыт 27. Реакции на гидроксильные группы дисахаридов 27.2. Ацилирование дисахаридов (тяга). В сухой пробирке смешивают 0,5 г безводной лактозы и 0,5 г безводного ацетата натрия. К полученной смеси приливают 2,5 мл уксусного ангидрида, содержимое пробирки перемешивают и нагревают 5 мин при непрерывном встряхивании. Реакционную смесь охлаждают на воздухе и выливают в стакан с водой и льдом при тщательном перемешивании: По какому механизму идет эта реакция? Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов Схема реакции окисления мальтозы реактивом Фелинга: Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Следует помнить, что длительное кипячение раствора сахарозы в щелочной среде приводит к ее расщеплению, и продукты гидролиза могут восстанавливать реактив Фелинга до оксида меди (I). Напишите уравнение реакции окисления лактозы реактивом Фелинга. 28.2. Получение фенилозазонов мальтозы и лактозы. В две сухие пробирки помещают по 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и безводного ацетата натрия (1:3). Затем в одну пробирку добавляют 1 мл 1%-ного раствора мальтозы, а в другую — 1 мл 1%-ного раствора лактозы при тщательном перемешивании. Пробирки помещают на кипящую водяную баню на 15—20 мин. При охлаждении на воздухе, а потом в стакане со льдом в реакционной смеси выпадают кристаллы фенилозазонов мальтозы и лактозы.
Напишите уравнение реакции образования фенилозазона лактозы. Кристаллы фенилозазонов мальтозы и лактозы рассматривают под микроскопом. Кристаллы озазона мальтозы имеют форму игл, частично образующих сферические скопления, а кристаллы фенилозазона лактозы — форму пластинок, образующих розетки. Зарисуйте кристаллы фенилозазонов мальтозы и лактозы в рабочий журнал. Опыт 29. Гидролиз (инверсия) сахарозы Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью. Со второй частью гидролизата проводят реакцию Селиванова на наличие фруктозы, входящей в состав сахарозы (см. опыт 26.1). Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля 3.3. ВЫСШИЕ ПОЛИСАХАРИДЫ В две пробирки наливают по 1 мл 1%-ных растворов полисаха-Ридов: в первую — крахмала, во вторую — гликогена. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы, в гликогене число остатков D-глюкозы доходит до нескольких миллионов. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. В молекулах гликогена общее число глюкозных остатков выше, чем в молекулах амилопектина, поэтому он, как и крахмал, не обладает восстанавливающими свойствами. Опыт 32. Взаимодействие крахмала и гликогена с иодом Реакция крахмала и гликогена с иодом представляет собой сложный процесс. Синюю окраску с иодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков а, D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы иода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции иода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 33. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор иода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки. Схема гидролиза крахмала: После того как реакционная смесь перестанет давать окраску с иодом, ее кипятят еще несколько минут, охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге). Отливают в пробирку 1—2 мл гидролизата и добавляют равный объем реактива Фелинга. Верхнюю часть жидкости нагревают на пламени горелки до начинающегося кипения. Выпадает красный осадок оксида меди (I), что свидетельствует о наличии в растворе продуктов глубокого гидролиза крахмала — глюкозы и мальтозы. Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 34. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью (см. опыт 55.3) для обнаружения в продуктах гидролиза восстанавливающих Сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №4 Опыт 35. Получение фурфурола и его свойства Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: С полученным раствором фурфурола проводят некоторые реакции. 35.2. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 35.3. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра (см. опыт 22.1) и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра. Подберите коэффициенты методом электронного баланса. Полоску белой хлопчатобумажной ткани смачивают водой, отжимают, а затем опускают в раствор «белого» индиго. Через несколько минут ткань вынимают, отжимают от избытка раствора и оставляют развешенной на воздухе. Постепенно «белое» индиго окисляется кислородом воздуха, и ткань окрашивается в синий цвет: К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение. Напишите уравнение реакции пиридина с соляной кислотой. 37.2. Образование солей пиридина. В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета: В пробирке с сульфатом меди сначала выпадает голубой осадок В избытке пиридина осадок гидроксида меди (II) быстро ра- Опыт 38. Мочевая кислота Несколько кристаллов мочевой кислоты растворяют в 1—2 мл соляную кислоту. Сначала выпадают кристаллы малорастворимой Кристаллы мочевой кислоты имеют форму удлиненных призм. Во вторую пробирку добавляют равный объем фелинговой Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать  Опыт 8. Окисление дисахаридовДисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).Связи, соединяющие моносахаридные остатки, называются гликозидными. Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар). Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2)-гликозидной связью: Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала», так как не способна превращаться в открытую форму, содержащую альдегидную группу. Подобные дисахариды не способны окисляться (т.е. быть восстановителями) и называются невосстанавливающими сахарами. Существуют дисахариды, в молекулах которых имеется свободный полуацетальный гидроксил, в водных растворах таких сахаров существуют равновесие между открытой и циклической формами молекул. Эти дисахариды легко окисляются, т.е. являются восстанавливающими, например, мальтоза. В мальтозе остатки глюкозы соединены (1→ 4)-гликозидной связью. Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды: При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей): Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов. Принцип метода. В зависимости от способа связи моносахаридов в молекулах дисахаридов они проявляют разную способность к окислению. Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Схема реакции окисления мальтозы реактивом Фелинга: мальтоза реактивом Фелинга Уравнение реакций окисления лактозы реактивом Фелинга::
Порядок выполнения работы. В 3 пробирки наливают по 2 мл. 1%-ного раствора сахарозы, мальтозы и лактозы. В каждую пробирку добавляют столько же фелинговой жидкости (Реактива Фелинга, представляет собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением.). Затем все пробирки нагревают до начинающегося кипения. В пробирке с сахарозой восстановления меди не наблюдается, в двух других появляются осадки оксида меди (I). Оксид меди, химическое соединение меди и кислорода, существующее в двух формах: закиси (Сu ₂О), блестящий красный порошок, встречающийся в природе в виде минерала куприта, и окиси (СuО), черного цвета. Оформление работы: объясните различное взаимодействие гидроксида меди (II) с дисахаридами. Составьте уравнения реакции окисления мальтозы и лактозы. 🎦 ВидеоРеакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Основы окислительно-восстановительных реакций | Химия ОГЭ 2023 | УмскулСкачать  25. Схема реакции и химическое уравнениеСкачать  Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать  Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать  Окислительно-восстановительные реакции - НЕОРГАНИКА | ЕГЭ химияСкачать  Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать  Окисление в органике: кислородсодержащие соединения | Химия ЕГЭ 2022 | УмскулСкачать  Общие свойства углеводов. Реактив Фелинга, Фруктоза, Сахароза, Крахмал.Скачать  Окислительно-восстановительные реакции (ОВР) | Химия ЕГЭ, ЦТСкачать  ОВР Окислительно-восстановительные реакции. Как определить окислитель и восстановительСкачать  117. Реакция диспропорционирования (дисмутации).Скачать  Химические свойства альдегидов и кетонов. 11 класс.Скачать  Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать  Ерёмин В. В. - Общая химия - Окислительно-восстановительные реакции (Лекция 6)Скачать  Лактозный оперон - что такое. Пример регуляции активности генов.Скачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  "Биологические ОВР (окислительно-восстановительные реакции)"Скачать  |
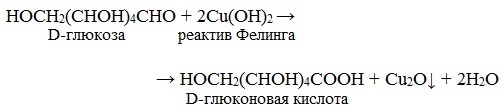
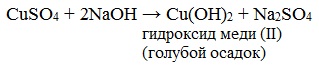



























 H
H

 C H O O C H
C H O O C H



 + Cu
+ Cu

 C H O O C H
C H O O C H




 + 2 + Cu2O + H2O
+ 2 + Cu2O + H2O