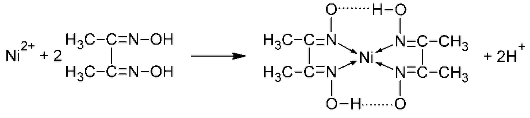
Катионы Ni 2+ при реакции с диметилглиоксимом (реактивом Чугаева) при рН 6-9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета — бис-диметилглиоксиматоникель (II) (старое название — «никельдиметилглиоксим»):
(здесь точками обозначены водородные связи OH). Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта (II) в малых концентрациях не мешают определению никеля. Мешают катионы Cu 2+ , Pb 2+ , Fe 2+ , Fe 3+ . Разработаны методики для устранения их мешающего действия.
Эта реакция, впервые предложенная Л.А.Чугаевым, является наиболее характерной для катионов никеля (II) и высокочувствительной: предел обнаружения равен 0,16 мкг, предельное разбавление — 3 10 5 мл/г. Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих никель (II) в никель (III), комплекс которого с диметилглиоксимом имеет еще более интенсивную окраску.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли концентрированного раствора аммиака и каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса диметилглиоксимата никеля.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли никеля (II), затем — каплю спиртового раствора диме-тилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака (в парах аммиака) до появления розово-красного пятна.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.4. Реакция ссульфид-ионами
Катионы Ni 2+ с сульфид-ионами S 2- в нейтральной среде образуют черный осадок сульфида никеля (II) NiS.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора сульфида натрия. Выпадает черный осадок.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.5. Реакция сщелочью и бромной (хлорной) водой
Со смесью щелочи и бромной (хлорной) воды соль двухвалентного никеля дает черно-бурый осадок гидроксида никеля (III) Ni(OH)3:
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора гидрооксида натрия и бромную или хлорную воду. Выпадает черно-бурый осадок.
Записать наблюдение и уравнение реакции в тетрадь. Рассмотреть уравнение с помощью метода электронного баланса.
Контрольные вопросы
1. Назовите групповые реагенты на катионы шестой аналитической группы.
2. Перечислите катионы, входящие в состав этой группы.
3. Какие элементы, катионы которых входят в состав шестой группы, проявляют переменную степень окисления?
4. Какие катионы шестой группы подвергаются гидролизу?
5. Напишите общую формулу комплексных соединений катионов шестой группы с аммиаком. Дайте названия этим соединениям.
6. Перечислите органические реагенты, применяемые для обнаружения катионов шестой группы.
7. Как действуют растворы щелочей и аммиака на катионы пятой и шестой аналитических групп? Напишите соответствующие уравнения реакций.
8. Как действует пероксид водорода в щелочной среде на кобальт (II)? Напишите соответствующее уравнение реакции и укажите цвет продукта реакции.
9. Какую окраску имеют аммиачные комплексы катионов шестой группы? Напишите их формулы.
10. Какую окраску имеетсульфид кадмия? Из каких растворов его выделяют?
11. Летучие соли каких ионов шестой групп окрашивают пламя газовой горелки? Укажите цвет пламени.
12. Для чего при растворении основной соли кобальта (II) CoOHCl и HgNH2Cl в избытке концентрированного раствора аммиака добавляют сухую соль аммония? Дайте обоснование, используя уравнения реакций растворения этих солей.
13. Какую реакцию можно использовать для дробного обнаружения ртути (II) в смеси катионов пятой и шестой групп? Напишите ее уравнение в ионном виде.
14. Почему реакцию образования диметилглиоксимата никеля проводят в аммиачной среде? Поясните, написав соответствующее уравнение реакции.
15. Напишите формулы комплексных соединений:
16. а) Cu 2+ скупроном,
17. б) Co 2+ с 1-нитрозо-2-нафтолом.
18. При выполнении какой аналитической реакции катиона кобальта (II) применяют экстракцию? Объясните необходимость ее применения.
Глава 7
Дата добавления: 2020-11-18 ; просмотров: 442 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Реакция никеля и диметилглиоксима (качественная реакция на никель).Скачать

Избирательная реакция иона никеля с диметилглиоксимом
Образование внутрикомплексного соединения никеля (II) с диметилглиоксимом Ni(DH)2 розового цвета в аммиачной среде (рН-8) —одна из избирательных реакций в аналитической химии (см. опыт 3):
Лишь несколько катионов Fe2+, Со2+, Cu2+, Pd11, Ptn, Bi111, Revn реагируют с диметилглиоксимом. Однако условия реакций различны. Например, диметилглиоксимат палладия образуется в кислой среде, диметилглиоксимат кобальта при больших концентрациях (ПО = gm/gco = = 1:5000). В аммиачно-тартратном буферном растворе в присутствии окислителя диметилглиоксимат железа (II) не образуется. Подобрав условия, можно обнаружить ион никеля в присутствии почти всех катионов.
Хлориды никеля(II), кобальта(II), цинка(II), хрома(III), алю-миния(III), желсза(III), 1%-ные растворы, 0,1 н. по хлористоводородной кислоте.
Диметилглиоксим, 1%-ный этанольный раствор.
Аммиачно-тартратный буферный раствор. К, 100 мл насыщенного раствора тартрата калия добавляют 20 мл 25%-ного раствора аммиака.
Выполнение опыта. В цилиндр поместить по 4 мл растворов хлоридов кобальта, цинка, хрома, алюминия и железа и 400 мл воды. На лекции добавить 100 мл буферного раствора и разлить раствор в два цилиндра. В первый цилиндр добавить 20 мл раствора хлорида никеля, в оба цилиндра прилить по 50 мл раствора ди-метилглиоксима. В первом цилиндре выпадает объемистый розовый осадок диметилглиоксимата никеля, во втором цилиндре осадка не образуется.
Примечание. Опыт является также демонстрацией маскирующего влияния тартрат-иона, используемого для повышения избирательности реагента [маскировка ионов хрома (III) и железа (III)].
Видео:Реакция нитрата никеля со щелочьюСкачать

Уравнение реакции никеля с диметилглиоксимом
Начнем с эксперимента. Насыпьте в стакан 0.5-1.0 г растворимой соли никеля (сульфат, нитрат, хлорид и т.д.). Добавьте 100-150 мл воды и хорошо перемешайте. Образуется зеленый раствор. Добавьте к нему раствор аммиака до устойчивого запаха и несколько миллилитров 1% спиртового раствора диметилглиоксима (ДМГ).
В аммиачном растворе никель образует с диметилглиоксимом ярко-розовый (или красный) комплекс, который выпадает в осадок (хлопья). Данную реакцию используют для обнаружения ионов никеля.
Кобальт и другие металлы также образует комплексы с диметилглиоксимом, но они остаются в растворе и не выпадают в осадок. Этим методом можно провести количественное определение содержания никеля в присутствии кобальта.
Кроме никеля аналогичный нерастворимый комплекс с диметилглиоксимом образует также палладий. Поскольку палладий встречается в аналитической практике не так часто, диметилглиоксим успешно используется для обнаружения и количественного определения никеля.
Как селективный реагент на никель диметилглиоксим был впервые предложен Л. А. Чугаевым в 1905 г, поэтому это вещество иногда называют «реактив Чугаева».
Теперь рассмотрим строение комплекса, который образуется при реакции никеля с диметилглиоксимом.
Ион никеля связан с двумя молекулами диметилглиоксима, причем каждая из них образует с металлом не одну, а сразу две связи (за счет двух атомов азота). Лиганды, подобные диметилглиоксиму, называются бидендатными (в общем случае — полидендатными), поскольку они образуют с металлом-комплексообразователем сразу две (в общем случае — несколько) химических связей.
Комплекс диметилглиоксима с никелем принадлежит к классу хелатов. Хелатами называют комплексные соединения, внутренняя сфера которых состоит из циклических групп атомов, включающих ион-комплексообразователь. Это название возникло от латинского слова chelate — клешня. В хелатах центральный ион металла как бы зажат в клешни полидендатными лигандами. Как правило, такие комплексы характеризуются большой устойчивостью. Например, благодаря своей прочности диметилглиоксимат никеля используется как пигмент в губной помаде. Катион никеля насколько хорошо связан в комплекс, что практически не проявляет токсичных свойств.
🌟 Видео
Никель - Ni. Реакция Сульфата Никеля и Цинка. Реакция NiSO4 и Zn. Получение Никеля.Скачать

Уравнивание реакций горения углеводородовСкачать

Реакция Сульфата Никеля, Сульфата Аммония и Фосфата Аммония. Реакция NiSO4, (NH4)2SO4 и Na3PO4Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химическая реакция NiSO4 с NaOH и NH4OHСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Получение сульфата никеляСкачать

Получение нитрата никеляСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Химия | Молекулярные и ионные уравненияСкачать