В степени окисления (+6) железо образует ферраты — соли железной кислоты, которая не выделена в свободном состоянии. Их получают окислением соединений железа(Ш) в сильнощелочной среде:
Ферраты в нейтральной и кислой среде являются сильными окислителями:
Видео:Химия. 9 класс. Качественные реакции на катионы Fe2+, Fe3+, CU2+, взаимодействие со щелочамиСкачать

Комплексные соединения железа
Железо образует комплексные соединения с органическими и неорганическими лигандами с координационным числом 6.
Желтая кровяная соль K^[Fe(CN)6] — гексацианоферрат(Н) калия образуется при действии на раствор соли железа(П) избытком цианида калия:
При взаимодействии с ионами Fe в водном растворе желтая кровяная соль дает синий осадок KFe[Fe(CN)6] (берлинскую лазурь):
Эта реакция является качественной на ионы Fe .
Красная кровяная соль K3[Fe(CN)6] — гексацианоферрат(Ш) калия — образуется при действии на раствор соли железа(Ш) избытком цианида калия:
При взаимодействии с ионами Fe в водном растворе красная кровяная соль дает синий осадок KFe[Fe(CN)6] (турнбуллеву синь):
Эта реакция является качественной на ионы Fe 2+ .
Ион Fe 3+ образует с тиоцианат-ионом комплексное соединение с интенсивной красной окраской:
Видео:Качественная реакция на ион трехвалентного железаСкачать

Реакции комплексообразования и их применение в анализе
Общие сведения. Вначале реакции комплексообразования нашли свое применение в качественном анализе – образование или разрушение окрашенных комплексов позволяет обнаружить многие вещества, в частности, катионы переходных металлов. Позднее некоторые из этих реакций стали использовать и для количественного анализа:
-малорастворимые комплексные соединения могут быть осаждаемой и даже гравиметрической формой.
-реакции образования комплексных соединений – основа метода комплексометрии, широко распространенного в практике титриметрического анализа
— в фотометрическом анализе определяемые вещества переводят в поглощающие свет (окрашенные) комплексы, а уже затем измеряют аналитический сигнал
— аналогичные реакции позволяют проводить экстракционное разделение и концентрирование микропримесей.
-наконец, с помощью реакций комплексообразования можно целенаправленно регулировать кислотно-основные или окислительно-восстановительные свойства определяемых веществ.
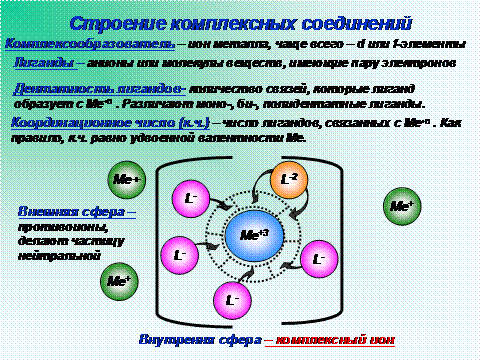
Строение и состав комплексных соединений впервые были объяснены А. Вернером на рубеже XIX и XX веков. Любой комплекс должен включать центральный атом, или ион (комплексообразователь) и лиганды (молекулы или анионы). Они связаны ковалентными связями. Получающуюся при таком взаимодействии устойчивую заряженную частицу можно рассматривать как внутреннюю сферу комплексного соединения, с которой слабо связаны ионы внешней сферы. Последние имеют заряд, противоположный заряду внутренней сферы, и удерживаются около нее ионными связями. Из раствора кристаллизуются именно такие – нейтральные – комплексные соединения. Примеры – К4[ Fe ( CN )6] или [ Cu ( NH 3)4] Cl 2.
К3[ Fe ( CN )6] – гксацианоферрат калия. Fe +3 – комплексообразователь, CN — — лиганды, 6-координационное число, 3 иона К + образуют внешнюю сферу, а комплексный ион [ Fe ( CN )6] -3 представляет собой внутреннюю сферу.
Свойства выделенных из раствора нейтральных комплексных соединений изучают специалисты в области неорганической и координационной химии.
Несколько по-другому подходят к комплексообразованию аналитики. Они изучают и применяют реакции между комплексообразователем и лигандами, идущие в растворе. В водном растворе «внутренняя сфера» является самостоятельной частицей, ионы внешней сферы связаны с ней очень слабо, практически не влияя на важные для анализа характеристики. Поэтому аналитики считают комплексными соединениями продукты взаимодействия центрального атома с лигандами, независимо от наличия заряда у образующегося соединения и возможности его препаративного выделения. Соответственно комплексом (комплексной частицей) они называют ион или молекулу, в состав которых входят более простые частицы, способные к самостоятельному существованию в растворе (или в составе кристалла). Примерами могут быть анионный гексароданидный комплекс Fe ( SCN )6 3- , нейтральный комплекс Fe С l 3 или катионный комплекс Cu ( NH 3)4 2+ . А вот сульфат-анион комплексом не является, так как атомы кислорода и серы в соответствующих степенях окисления не способны к самостоятельному существованию в растворе.
Способность комплексообразователя образовывать определенное число химических связей с лигандами характеризуют его координационным числом. Чаще всего оно равно 4 или 6. В анализе применяют устойчивые комплексные соединения переходных металлов, свинца, олова, алюминия, редкоземельных элементов и т.п. Однако широко используются и такие комплексы, в которых центральным атомом является неметалл (например, As или P ).
Число связей, которые лиганд образует с комплексообразователем, называют его дентатностью. Неорганические лиганды обычно монодентатны: аммиак, вода, фторид-, хлорид-, цианид-ион и др. Бидентатными лигандами являются некоторые двухзарядные анионы (например, сульфат SO 4 2- ), бифункциональные органические соединения (диамины, многие аминокислоты и оксикислоты, оксалат С2О4 2 и другие анионы двухосновных карбоновых кислот). Существуют и лиганды с более высокой дентатностью, соответствующие органические молекулы содержат 3-6 функциональных групп донорного характера, каждая из которых образует одну связь с центральным атомом. Эти функциональные группы (-ОН, -СООН, — NH 2 и некоторые другие) имеют неподеленные электронные пары, обеспечивающие образование связи с комплексообразователем.
· Наибольшую практическую значимость имеют такие комплексы, которые содержат один центральный атом, а вся его координационная сфера заполнена одинаковыми лигандами.
Соотношение между координационным числом комплексообразователя и дентатностью лиганда определяет возможный состав комплекса. Так, катион Al 3+ с координационным числом 6 может присоединить 6 монодентатных лигандов (пример – фторидный комплекс AlF 6 3- ), или 3 бидентатных лиганда (оксалатный комплекс Al (С2О4) 3- ), или 2 тридентатных лиганда. Учитываются и пространственные (стерические) факторы. Так, если молекула монодентатного лиганда очень велика по объему, и несколько таких молекул у одного и того же комплексообразователя не помещаются, то в координационной сфере центрального атома свободные места занимают молекулы растворителя или какого-либо другого лиганда.
Комплексы с полидентатными лигандами называют хелатами. Разные функциональные группы одного и того же лиганда при этом захватывают центральный атом с разных сторон, как клешня краба (слово хелат в переводе с греческого и обозначает клешню). Нередко молекула реагента превращается в лиганд, теряя атомы водорода, в этом случае раствор подкисляется. Примером может быть взаимодействие щавелевой кислоты с ионами цинка, в ходе которого образуется оксалатный комплекс:
2 H2C2O4 + Zn 2+ 
Видео:Опыты по химии. Качественные реакции на ионы железа (II) и (III)Скачать

Chemicals-el.ru
Видео:Константа нестойкости и диссоциация комплексных соединенийСкачать

» Сайт о химических элементах
Видео:Взаимодействие хлорида железа III с роданидом калияСкачать

Аналитические реакции цианид — иона CN-
Цианиды — соли, содержащие цианид — анионы CN- слабой цианистоводородной кислоты HCN (синильной кислоты).
Синильная кислота — летуча (имеет запах горького миндаля), очень ядовита и даже при незначительных дозах (меньше 0,05 г) приводит к смерти’
Цианид — ион в водных растворах бесцветен, сильно гидролизуется, обладает восстановительными свойствами, является очень эффективным лигандом и образует многочисленные весьма устойчивые цианидные комплексы с катионами многих металлов.
Цианиды щелочных и щелочно — земельных металлов, а также цианид ртути (II) Hg(CN)2 растворяются в воде. Остальные цианиды мало растворимы в воде. При кипячении в водных растворах CN- практически полностью гидролитически разлагается до аммиака и формиат — ионов:
CN- + 2 Н2О -> NH3 + НСОО-. Под действием кислорода воздуха цианид — ионы окисляются до цианат — ионов NCO-:
2 CN + О2 -> 2 NCO-
Цианиды, особенно KCN, — сильно ядовитые вещества. Поэтому при работе с ними следует соблюдать повышенную осторожность! Все операции проводятся только под тягой! Избегать разбрызгивания растворов!
Образованием бесцветных дицианоаргентат (I) — ионов [Ag(CN)2]-:
CN- + Ag+ -> AgCN CN- + AgCN -> [Ag(CN)2]-
Этот процесс протекает до тех пор, пока все присутствующие в растворе ионы CN- прореагируют с катионами серебра. По мере дальнейшего прибавления AgNO3 из раствора осаждается,белая малорастворимая комплексная соль Ag[Ag(CN)2]:
Ag+ + [Ag (CN)2]- — Аg [Аg(СN)2]+(белый)
б). Если, наоборот, к раствору, содержащему катионы Ag+, постепенно прибавлять раствор, содержащий ионы CN-, то выпадает белый творожистый осадок AgCN — до
тех пор, пока все катионы Ag+ прореагируют с прибавляемыми цианид — ионами. При дальнейшем добавлении раствора цианида осадок AgCN растворяется с образованием комплексных анионов [Ag(CN)2]
2.Реакция с дисульфидом аммония и хлоридом железа (III).
Дисульфид-ион тиоцианат-ион сульфид-ион nNCS- + FeCl3 + 6-n H2O — [Fe(NCS)n(H2O)6.n]3-n тиоцианатный комплекс (красный)
3.Реакция образования берлинской лазури.
6 CN- + Fe2+ = [Fe(CN)6]4-
4Fe3+ + 3 [Fe(CN)6]4- = Fe4[Fe(CN)6]3
Выпадает синий осадок берлинской лазури, а раствор приобретает синюю окраску.
4. Другие реакции цианид-ионов.
Цианид – ион образует многочисленные устойчивые комплексы с солями различных металлов: а) Буро-черный CuS растворяется в присутствии CN- — ионов с образованием бесцветных цианидных комплексов меди (1) — тетерациано — купрат (1) — ионов [Cu(CN)4]3- Эту реакцию проводят капельным методом на фильтровальной бумаге. Для этого фильтровальную бумагу смачивают аммиачным раствором сульфата меди (II), слегка высушивают и вносят в пары сероводорода. Бумага темнеет вследствие образования сульфида меди (II) CuS. На бумагу наносят 1-2 капли раствора, содержащего цианид — ионы.
Цианид — ионы реагируют с пикриновой кислотой с образованием продуктов реакции, красного цвета; с ацетатом меди (II) и бензидином дают продукты синего цвета.
Смотрите также
Актиний (Actinium), Ac
Актиний — химический элемент с атомным номером 89, обозначается в периодической системе элементов символом Ac. Актиний — радиоактивный химический элемент III группы периодической системы Менделе .
🎬 Видео
Реакции ионного обмена. 9 класс.Скачать

Комплексиметрия: комплексонометрия, меркуриметрия.Скачать

Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Шеховцова Т.Н. - Аналитическая химия - Органические реагенты. Комплексонометрическое титрованиеСкачать

Лабораторный опыт №4 «Качеств реакции на катионы Fe2+, Fe3+, Cu2+, взаимодействие со щелочами» 9 клСкачать

Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать

Видео поведение комплексных соединений в растворах.Скачать
Ерёмин В. В. - Общая химия - Комплексные соединения (Лекция 7)Скачать

Комплексные соединенияСкачать

Классификация реакций: ионные и радикальные реакцииСкачать

11 класс, 8 мая - Урок онлайн Химия: Соединения железаСкачать

Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Фотоколориметрический метод определения концентрации ионов железаСкачать

Реакция ЖЕЛЕЗА и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии.Скачать