Фторид кальция CaF2 — соль щелочного — земельного металла кальция и плавиковой кислоты. Белый. Плавится без разложения. Не растворяется в воде (растворимость повышается в присутствии солей аммония), кристаллогидратов не образует.
Относительная молекулярная масса Mr = 78,07; относительная плотность тв. и ж. вещества d = 3,18; tпл = 1419º C;
- Способ получения
- Химические свойства
- Реакция взаимодействия кальция и фтора
- Реакция взаимодействия кальция и фтора
- Реакции кальция
- Реакция взаимодействия оксида иттербия (III) и кальция
- Реакция взаимодействия оксида меди (II) и водорода
- Реакция взаимодействия гидроксида свинца (II) и гидроксида натрия
- Выбрать язык
- Популярные записи
- Предупреждение.
- Фторид кальция
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Опасность применения
- 📺 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. Фторид кальция можно получить путем взаимодействия при комнатой температуре кальция и фтора :
2. В результате взаимодействия разбавленной плавиковой кислоты и оксида кальция , образуется фторид кальция и вода:
CaO + 2HF = CaF2↓ + H2O
3. Карбонат кальция вступает в реакцию с разбавленной плавиковой кислотой и образует на выходе фторид кальция, углекислый газ и воду:
4. В результате реакции между хлоридом кальция и фторидом аммония образуется фторид кальция и хлорид аммония:
Видео:Реакция ФТОРИДА НАТРИЯ и ГИДРОКСИДА КАЛЬЦИЯ. Химические опыты.Preparation CALCIUM FLUORIDE.ChemistryСкачать

Химические свойства
1. Фторид кальция вступает в реакцию со сложными веществами :
1.1. Фторид кальция вступает во взаимодействие с кислотами .
1.1.1. При 130 — 200º С в результате взаимодействия с концентрированной серной кислотой фторид кальция образует сульфат кальция и газ фтороводород:
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Реакция взаимодействия кальция и фтора
Видео:Электролитный марафон! Расстройства обмена кальция, магния и фосфораСкачать

Реакция взаимодействия кальция и фтора
Уравнение реакции взаимодействия кальция и фтора:
Реакция взаимодействия кальция и фтора.
В результате реакции образуется фторид кальция.
Реакция протекает при нормальных условиях.
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Реакции кальция
Реакции кальция с веществами:
Формула для поиска по сайту: Ca + F2 → CaF2.
Реакция взаимодействия оксида иттербия (III) и кальция
Реакция взаимодействия оксида меди (II) и водорода
Реакция взаимодействия гидроксида свинца (II) и гидроксида натрия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

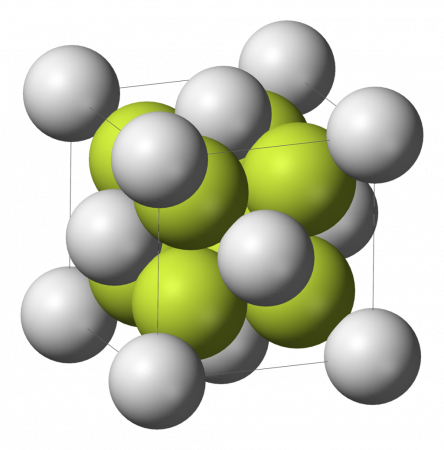
Фторид кальция
| Фторид кальция | |
|---|---|
 | |
 |
наименование
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Опасность применения
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Видео:Биохимия: Обмен кальция и фосфатовСкачать

Получение
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство
4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
Фторид кальция можно получить обменными реакциями, например:
CaCl2 + 2NH4F → CaF2↓ + 2NH4Cl
Видео:Фосфор. 9 класс.Скачать

Химические свойства
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
Разлагается концентрированной серной кислотой, что используется в промышленности для получения HF:
При избытке HF образует сложный кристаллогидрат:
При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
2LiF + CaO → 600−700oC CaF2 + Li2O
Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х годов добывалось
5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Применяется в стоматологии, для глубокого фторирования – насыщения твердых тканей зуба минеральными соединениями, путём обработки(очистка, просушивание струёй воздуха зуба и нанесение) поврежденных мест. Благодаря этому, терапевтический эффект по сравнению с применением фторлаков, усиливается в 100 раз.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
- Микроскопии,
- Квантовой и силовой оптике,
- Инфракрасной технике,
- Спектрофотометрии,
- Фурье-спектроскопии,
- Рентгеновской технике,
- Космотехнике,
- Астрономии,
- Голографии.
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba 2+ , компенсируется очень низкой растворимостью сульфата.
📺 Видео
Уравнивание реакций горения углеводородовСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Фосфин - PH3. Реакция Фосфида Кальция И Соляной Кислоты. Получение Фосфида Кальция.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)


