Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
- Гомологический ряд алкенов
- Строение алкенов
- Изомерия алкенов
- Структурная изомерия
- Пространственная изомерия
- Номенклатура алкенов
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
- Получение алкенов
- 1. Дегидрирование алканов
- 2. Крекинг алканов
- 3. Дегидрогалогенирование галогеналканов
- 4. Дегидратация спиртов
- 5. Дегалогенирование дигалогеналканов
- 6. Гидрирование алкинов
- 7. Гидрирование алкадиенов
- Acetyl
- химические свойства алканов
Видео:КАЖДЫЙ ШКОЛЬНИК поймет химию — Типы ИзомерииСкачать

Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp 2 :
При образовании связи σ-связи между атомами углерода происходит перекрывание sp 2 -гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
| Например, молекуле этилена C2H4 соответствует плоское строение. |
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
| Например, в молекуле пропилена присутствует атом углерода в sp 3 -гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи. |
Изображение с сайта orgchem.ru
Видео:Реакции изомеризации углеводородовСкачать

Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Видео:Видео №3. Как составить изомерыСкачать

Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен |
| Бутен-1 | Метилпропен |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
| Например. Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан |
| Пропилен | Циклопропан |
 |  |
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
| Например. Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2 |
| Бутен-1 | Бутен-2 |
 |  |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| Например. Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере м етильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны. |
| цис-Бутен-2 | транс-Бутен-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Видео:Химия с нуля — Химические свойства АлкеновСкачать  Номенклатура алкеновВ названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами: 1. Углеродная цепь, в составе которой есть двойная связь, считается главной. 2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи. 3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи. 4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Химические свойства алкеновАлкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов. Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
Можно примерно оценить энергию π-связи в составе двойной связи С=С: Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам. Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение). Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  1. Реакции присоединенияДля алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена. 1.1. ГидрированиеАлкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
1.2. Галогенирование алкеновПрисоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму. 1.3. Гидрогалогенирование алкеновАлкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.4. ГидратацияГидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Гидратация алкенов также протекает по ионному (электрофильному) механизму. Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
1.5. ПолимеризацияПолимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  2. Окисление алкеновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое. 2.1. Каталитическое окислениеКаталитическое окисление протекает под действием катализатора.
2.2. Мягкое окислениеМягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается. В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи. При этом образуются двухатомные спирты (диолы).
2.2. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2. Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота: При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон: При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления. 2.3. Горение алкеновАлкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкенов выглядит так:
3. Замещение в боковой цепиАлкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы. При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
4. Изомеризация алкеновПри нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать 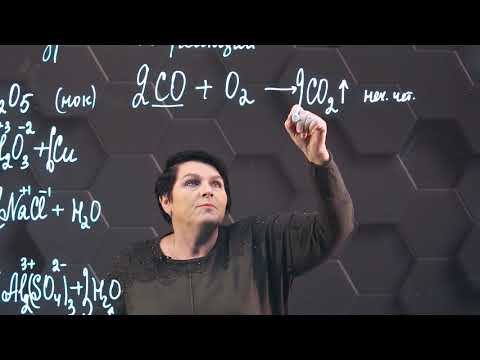 Получение алкеновВидео:5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать  1. Дегидрирование алкановПри дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2: Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3: Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  2. Крекинг алкановКрекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью. Крекинг бывает термический и каталитический. Термический крекинг протекает при сильном нагревании без доступа воздуха. При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия). Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  3. Дегидрогалогенирование галогеналкановГалогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
Видео:Составление уравнений реакций. 1 часть. 8 класс.Скачать  При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  4. Дегидратация спиртовПри нагревании спиртов (выше 140 о С) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды. При дегидратации спиртов образуются алкены.
Дегидратация более сложных молекул также протекает по правилу Зайцева.
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать  5. Дегалогенирование дигалогеналкановДигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов. Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Видео:Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать  6. Гидрирование алкиновГидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов. При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  7. Гидрирование алкадиеновГидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением. При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2): Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При полном гидрировании дивинила образуется бутан: Видео:8 класс.Ч.1.Решение задач по уравнению реакций.Скачать  AcetylНаведите курсор на ячейку элемента, чтобы получить его краткое описание. Чтобы получить подробное описание элемента, кликните по его названию.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








































