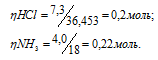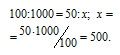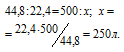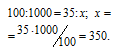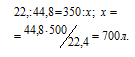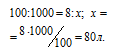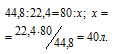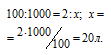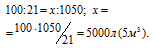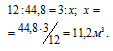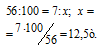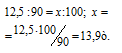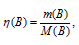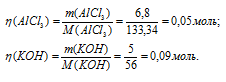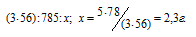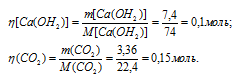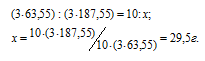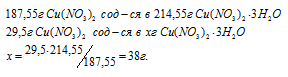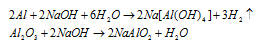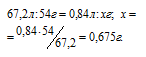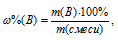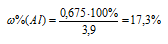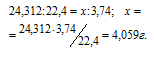- Оксид углерода (II)
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Расчёты, связанные с протеканием химических реакций
- а) Уравнение реакции сгорания водорода:
- б) Уравнение реакции сгорания метана:
- СН4 + О2 = СО2 + 2Н2О
- в) Уравнение реакции горения угарного газа:
- г) Уравнение реакции горения этилена:
- Уравнение реакции горения угарного газа в кислороде
- 🌟 Видео
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Расчёты, связанные с протеканием химических реакций
Задача 121.
Смешано 7,3г НСI с 4,0г NH3. Сколько граммов NH4С1 образуется? Найти массу оставшегося после реакции газа.
Решение:
Уравнение реакции имеет вид:
Молекулярные массы HCl, NH3 и NH4Cl соответственно равны 36,453, 17 и 53,453. Следовательно, их мольные массы составляют 36,453; 17; 53,453г/моль. Согласно уравнению реакции 1 моль HCl реагирует с 1 моль NH3, образуя 1 моль NH4Cl. Находим, какое вещество взято в недостатке:
В недостатке взято 0,2 моля HCl, значит, расчёт массы, образовавшейся соли NH4Cl, производим по количеству соляной кислоты:
m(NH4Cl) = 0,2 . 53,453 = 10,69г.
Затем рассчитаем массу NH3, вступившего в реакцию с HCl:
Ответ: 10,69г NH4Cl; 3,4г NH3.
Задача 122.
Какой объем воздуха потребуется для сжигания 1м 3 газа, имеющего следующий состав по объему: 50% Н2, 35% СН4, 8% СО, 2% С2Н4 и 5% негорючих примесей. Объемное содержание кислорода в воздухе равно 21%.
Решение:
Рассчитаем объём кислорода, необходимый для сжигания газов.
а) Уравнение реакции сгорания водорода:
Находим объём водорода, содержащегося в 1 м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 2 молей Н2 расходуется 1 моль О2 т. е. на сжигание 44,8 л водорода требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
б) Уравнение реакции сгорания метана:
СН4 + О2 = СО2 + 2Н2О
Находим объём метана, содержащегося в 1 м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 1 моль СН4 расходуется 2 моля О2 т. е. на сжигание 22,4 л метана требуется 44,8л кислорода.
Находим объём расходуемого кислорода из пропорции:
в) Уравнение реакции горения угарного газа:
Находим объём угарного газа, содержащегося в 1м 3 газа из пропорции:
Согласно уравнению реакции на сжигание 2 молей СО расходуется 1 моль О2 т. е. на сжигание 44,8 л угарного газа требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
г) Уравнение реакции горения этилена:
Согласно уравнению реакции на сжигание 1 моль С2Н4 расходуется 3 моль О2, т.е. затрачивается в три раз больший объём кислорода, чем этилена.
Находим содержание этилена в 1 м 3 газа из пропорции:
Кислорода для сжигания этилена требуется в три раза больше по объёму, чем этилена, а именно 60 л (20 . 3 = 60).
Теперь находим общий объём кислорода, затраченный на сжигание 1 м 3 газа:
V(O2) = 250 + 700 + 40 + 60 = 1050 л.
Рассчитаем объём воздуха, содержащий 1050 л кислорода из пропорции
Ответ: 5 м 3
Задача 123.
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и Н2. Какой объем водяного газа (условия нормальные) может быть получен из 3,0 кг угля?
Решение:
Уравнение протекающей реакции:
Согласно уравнению реакции из одного моля угля и одного моля воды образуется «водяной газ», состоящий из одного моля угарного газа и одного моля водорода. Мольная масса углерода равна 12 кг/кмоль; 1 кмолоь «водяного газа» занимает объём 44,8 м 3 .
Рассчитаем объём водяного газа, образуемого из 3 кг угля из пропорции:
Ответ: 11,2м 3 .
Задача 124.
Карбонат кальция разлагается при нагревании на СаО и СО2. Какая масса природного известняка, содержащего 90% (масс.) СаСО3, потребуется для получения 7,0т негашеной извести?
Решение:
Уравнение протекающей реакции:
СаСO3 
Молекулярные массы СаСО3 и СаО соответственно равны 100 и 56, следовательно, их мольные массы составляют 100 и 56 г/моль. Согласно уравнению реакции 1 моль СаСО3 образует 1 моль СаО. Находим теоретический выход негашёной извести из пропорции:
Находим массу природного известняка из пропорции:
Ответ: 13,9т.
Задача 125.
К раствору, содержащему 6,8г АIСl3, прилили раствор, содержащий 5,0г КОН. Найти массу образовавшегося осадка.
Решение:
Уравнение протекающей реакции:
Мольные массы АlCl3, KOH и Al(OH)3 соответственно равны 133,34; 56 и 78 г/моль. Рассчитаем количество реагирующих веществ по формуле:
Где n — количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.
Отсюда
Согласно уравнению реакции 1 моль AlCl3 реагирует с 3 моль КОН с образованием 1 моль Al(OH)3, т.е. КОН должно 0,15 моль (0,05 . 3 = 0,15), чем взято по условию задачи (0,09 моль). Таким образом, КОН взят в недостатке, поэтому расчёт массы Al(OH)3 проводим по КОН, получим:
Ответ: 2,3г
Задача 126.
Через раствор, содержащий 7,4г гидроксида кальция, пропустили 3,36л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Решение:
Уравнение реакции имеет вид:
Молекулярные массы Са(ОН)2 и СаСО3 соответственно равны 74 и 100, следовательно, их мольные массы составляют 74 и 100г/моль. Согласно уравнению реакции из 1 моль Са(ОН)2 и 1 моль СО2 образуется 1 моль СаСО3. Рассчитаем количество реагирующих веществ по формуле
Следовательно, СО2 взят в избытке и поэтому расчёт массы образовавшегося СаСО3 будем проводить по Са(ОН)2.
m(CaCO3) = n(CaCO3) . M(CaCO3) = 0,1 . 100 = 10 г.
Ответ: 10 г.
Задача 127.
Рассчитать массу кристаллогидрата Cu(NO3) . 3Н2O, полученного растворением 10 г меди в азотной кислоте и последующим выпариванием раствора.
Решение:
Уравнение протекающей реакции:
Мольные массы Cu и Cu(NO3)2 соответственно равны 63,55 и 187,55 г/моль. Согласно уравнению реакции из 3 моль Cu образуется 3 моль Cu(NO3)2. Рассчитаем массу Cu(NO3)2, образующуюся при растворении 10 г меди в азотной кислоте:
Находим мольную массу кристаллогидрата нитрата меди:
M[(Cu(NO3)2) . 3H2O] = 187,55 + (3 . 18) = 214,55г/моль.
Рассчитаем массу образовавшегося кристаллогидрата меди:
Ответ: 38г
Задача 128.
При обработке раствором гидроксида натрия 3,90г смеси алюминия с его оксидом выделялось 840 мл газа, измеренного при нормальных условиях. Определить процентный состав (по массе) исходной смеси.
Решение:
Уравнения протекающих реакций:
Следовательно, водород образуется при растворении алюминия в растворе щёлочи Согласно уравнению реакции из 2 моль Al (2 . 27 = 54 г) образуется 3 моль Н2 или 67,2л (3 . 22,4 = 67,2). Рассчитаем массу алюминия в смеси из пропорции:
Теперь находим процентное содержание алюминия в смеси по формуле:
Где
Ответ: 17,3%.
Задача 129.
5,10 г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74л Н2, измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
Решение:
Уравнение протекающей реакции:
Мольная масса Mg равна 24,312 г/моль, мольный объём газа равен 22,4 л/моль. Согласно уравнению реакции 1 моль магния выделяет 1 моль водорода. Рассчитаем массу магния, которая растворилась в кислоте из пропорции:
Процентный состав магния в образце определяем из пропорции:
Видео:Уравнивание реакций горения углеводородовСкачать

Уравнение реакции горения угарного газа в кислороде
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы — 
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
🌟 Видео
Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Оксид углерода(II). Угарный газ. Состав. Строение. Получение. СвойстваСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Реакции горенияСкачать

Горение угля в кислородеСкачать

Получение угарного газаСкачать

Горение. 7 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Угарный и углекислый газ. Это знать обязательно.Скачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Занятие 14 | Реакции горения | Курс химии | 7 классСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Химия. 7 класс. Процесс горения. Практическая работа №2 /15.12.2020/Скачать

Химические свойства кислорода. Урок 18. Химия 7 класс.Скачать