Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Видео:Уравнивание реакций горения углеводородовСкачать

Уравнение реакции горения сероводорода в воздухе
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
А откуда здесь 6,67?Объясните пожалуйста.
Объем газа в литрах.
Возможна реакция: 4H2S + O2 -> 2S + 2H2O
Почему мы именно по этой реакции должны судить?
В условии есть слово, указывающее именно на реакцию .
Это слово идёт после «для» и перед «сжигания»
Хорошо! Тогда пожалуйста реакция ПОЛНОГО сжигания сероводорода: 2H2S + 4O2 = 2SO3 + 2H2O. Почему бы и нет?
При сжигании серы, сероводорода, сульфидов в избытке кислорода образуется оксид серы (IV).
Для превращения оксида серы (IV) в оксид серы (VI) необходим катализатор.
А что мешает написать его? У нас же не сказано конкретно что без катализатора реакция идёт.
Использовано слово «сжигание», которое не подразумевает наличие катализаторов.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Горение сероводорода
Сделав предварительно пробу на гремучий газ, подожжем сероводород, выходящий из оттянутой на конце стеклянной трубки. Сероводород горит с появлением бледного пламени с голубым ореолом:
В результате сгорания возникает оксид серы (IV) или сернистый газ. Его легко определить по резкому запаху и по покраснению влажной голубой лакмусовой бумажки.
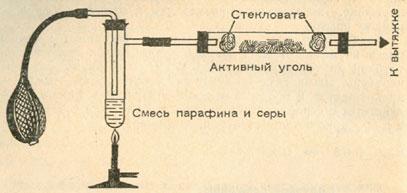
При недостаточном доступе кислорода сероводород окисляется только до серы. Активный уголь каталитически ускоряет этот процесс. Этим способом часто пользуются при тонкой очистке промышленных газов, содержание серы в которых не должно превышать 25 г/м3:
Нетрудно воспроизвести этот процесс. Схема установки изображена на рисунке. Главное заключается в том, чтобы пропустить через активный уголь воздух и сероводород в соотношении 1 : 3. На угле выделится желтая сера.
Активный уголь можно очистить от серы, промыв его в сероуглероде. В технике для этой цели применяют чаще всего раствор сульфида аммония (NН4)2S.
Два метода для одного продукта
Сера сгорает с появлением бледно-голубого пламени. При этом образуется бесцветный газ с резким запахом — оксид cepы (IV) SO2. Он ядовит и раздражает дыхательные пути, поэтому мы должны стараться не вдыхать его.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
💡 Видео
29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Горение. 7 класс.Скачать

Горение сероводорода. Химический опытСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

СероводородСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции горенияСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Крайон. Великий Эксперимент. Ответы на главные вопросы. Каким будет Переход?Скачать

Опыты по химии. Горение серы в кислородеСкачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать