Na2CO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
Полное ионное уравнение
2Na + + CO3 2- + HOH ⇄ Na + + HCO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
CO3 2- + HOH ⇄ HCO3 — + OH —
Видео:Опыты по химии. Гидролиз гидрокарбоната натрия, карбоната натрия и силиката натрияСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHCO3 + HOH ⇄ H2CO3 + NaOH
Полное ионное уравнение
Na + + HCO3 — + HOH ⇄ H2CO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HCO3 — + HOH ⇄ H2CO3 + OH —
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Среда и pH раствора карбоната натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Please wait.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2959e618c4218d • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Урок №14. Гидролиз
Гидролизом называется процесс разложения вещества водой («гидро» — вода, «лизис» — разложение).
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо.
Примеры гидролиза
Неорганических веществ
CH 3 COONH 4 +H 2 O↔CH 3 COOH+NH 4 OH
Органических веществ
CH 3 COOCH 3 +H 2 O↔CH 3 COOH+CH 3 OH
C 2 H 5 ONa+H 2 O↔C 2 H 5 OH+NaOH
CH 2 (NH 2 )-CO-NH-CH 2 -COOH+H 2 O↔2CH 2 (NH 2 )-COOH
Количественно гидролиз характеризуется безразмерной величиной h , называемой степенью гидролиза и показывающей, какая часть молекул растворяемого вещества (от общего количества, принятого за единицу или 100%) подвергается гидролизу:
, где n — число молекул, подвергшихся гидролизу,
N — общее число молекул вещества до начала гидролиза
Факторы, влияющие на степень гидролиза
Степень гидролиза зависит от:
природы растворяемого вещества
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Чем меньше концентрация соли, тем выше степень ее гидролиза. При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
3). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO 4 + 2H 2 O (CuOH) 2 SO 4 + H 2 SO 4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
нагреть или разбавить раствор водой;
добавит раствор щёлочи (NaOH);
добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
Ослабить гидролиз этой соли можно, если:
растворение вести на холоду;
готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
FeCl 2 + H 2 O FeOHCl + HCl
Fe 2+ + 2Cl — + H 2 O (FeOH) + + 2Cl — + H +
Fe(OH)Cl + H 2 O Fe(OH) 2 + HCl
(FeOH) + + Cl — + H 2 O Fe(ОН) 2 + Н + + Cl —
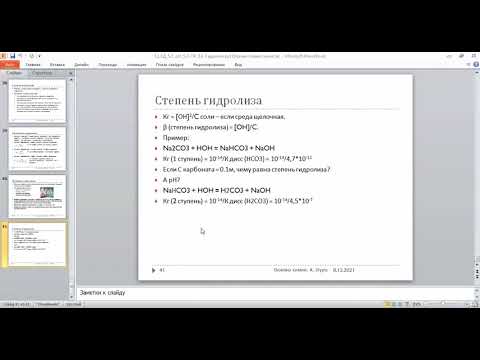
Гидролиз карбоната натрия включает две ступени:
Nа 2 СО 3 + H 2 O NаНСО 3 + NаОН
СО 3 2- + 2Na + + H 2 O НСО 3 — + ОН — + 2Na +
NаНСО 3 + Н 2 О NаОН + Н 2 СО 3
НСО 3 — + Na + + H 2 O Н 2 СО 3 + ОН — + Na +
Гидролиз — процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Fe(ОН) 2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота (Н 2 СО 3 ) — со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S↑
Cоли, полностью разлагаемые водой — Al 2 S 3 , нельзя получить по реакции обмена в водных растворах, так как вместо обмена протекает реакция совместного гидролиза:
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S↑ (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t°C =Al 2 S 3
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) и растворимые карбонаты/гидрокарбонаты.
При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl 2 + 2Na 2 CO 3 + H 2 O = Mg 2 (OH) 2 CO 3 + 4NaCl + CO 2
Обратите внимание: (соли Ca 2+ , Sr 2+ , Ba 2+ и Fe 2+ ) – в этом случае протекает обменный процесс:
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза ( совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H 2 S, SO 2 , CO 2 ):
2AlCl 3 + 3K 2 S +6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6KCl
2CrCl 3 + 3K 2 CO 3 + 3H 2 O = 2Сr(ОН) 3 + 3СO 2 + 6KCl
2AlCl 3 + 3Na 2 SO 3 + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3SО 2
2AlCl 3 + 3Na 2 S + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3H 2 S
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl 3 + 3K 2 CO 3 + 3H 2 O = 2Fe(ОН) 3 + 3СO 2 + 6KCl
Обратите внимание: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl 3 + 3K 2 S (изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl,
SOCl 2 + 2 H 2 O = H 2 SO 3 + 2HCl,
PCl 5 + 4 H 2 O = H 3 PO 4 + 5HCl,
CrO 2 Cl 2 + 2H 2 O = H 2 CrO 4 + 2HCl,
PCl 5 + 8NaOH = Na 3 PO 4 + 5NaCl + 4H 2 O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl 3 + 3H 2 O = H 3 PO 4 + 3HCl
Примеры реакций гидролиза
(NH 4 ) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4 ) 2 CO 3 +H 2 O↔NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O↔NH 4 OH+H 2 CO 3
Реакция раствора слабощелочная pH>7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH)>К д (H 2 CO 3 )
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O↔NH 4 OH+СH 3 COOH
Реакция раствора нейтральная pH=7, т.к К д (CH 3 COOН)=К д (NH 4 OH)
K 2 HPO 4 – гидроортофосфат калия — соль, слабой кислоты и сильного основания. Растворима. Гидролизуется по аниону. Число ступеней – 2.
1 ступень: K 2 HPO 4 +H 2 O↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O↔H 3 PO 4 +KOH
Реакция раствора 1 ступени слабощелочная pH=8,9, так как в результате гидролиза в растворе накапливаются ионы OH — и процесс гидролиза преобладает над процессом диссоциации ионов HPO 4 2- , дающим ионы H + (HPO 4 2- ↔H + +PO 4 3- )
Реакция раствора 2 ступени слабокислая pH=6,4, так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHCO 3 = Na + + HCO 3 — (I)
HCO 3 — ↔ H + + CO 3 2- (II)
Константа диссоциации по второй ступени — это К 2 угольной кислоты, равная 4,8∙10 -11 .
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O↔H 2 CO 3 +NaOH
HCO 3 — +H 2 O↔H 2 CO 3 +OH — , константа которого равна
K г =K w /K 1 (H 2 CO 3 )=1∙10 -14 /4,5∙10 -7 =2,2∙10 -8 .
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду.
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
NaHSO 3 = Na + + HSO 3 — (I)
HSO 3 — ↔ H + + SO 3 2- (II)
Константа диссоциации по второй ступени — это К 2 сернистой кислоты, равная 6,2∙10 -8 .
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O↔H 2 SO 3 +NaOH
HSO 3 — +H 2 O↔H 2 SO 3 +OH — , константа которого равна
K г =K w /K 1 (H 2 SO 3 )=1∙10 -14 /1,7∙10 -2 =5,9∙10 -13 .
В этом случае константа диссоциации больше константы гидролиза, поэтому раствор NaHSO 3 имеет кислую среду.
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 + + 2H 2 O↔NH 3 . H 2 O + H 3 O +
CN – + H 2 O↔HCN + OH –
NH 4 CN +H 2 O ↔ NH 4 OH+ HCN
К д (HCN) =7.2∙10 -10 ; К д (NH 4 OH) =1.8∙10 -5
Ответ: Гидролиз по катиону и аниону, т.к. K o > K к , слабощелочная среда, pH > 7
💥 Видео
Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Гидролиз солейСкачать

Гидролиз Разбор задачиСкачать
Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Гидрокарбонат натрия (питьевая сода)Скачать

Гидролиз солейСкачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

Взаимопревращение карбонатов и гидрокарбонатовСкачать

ГидролизСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидрокарбонат натрия и лакмусСкачать

ЕГЭ. Химия. Гидролиз.Скачать
