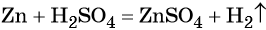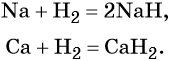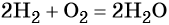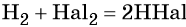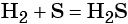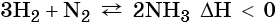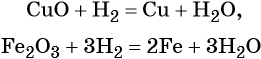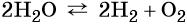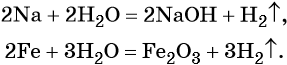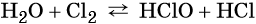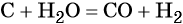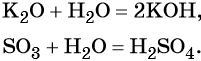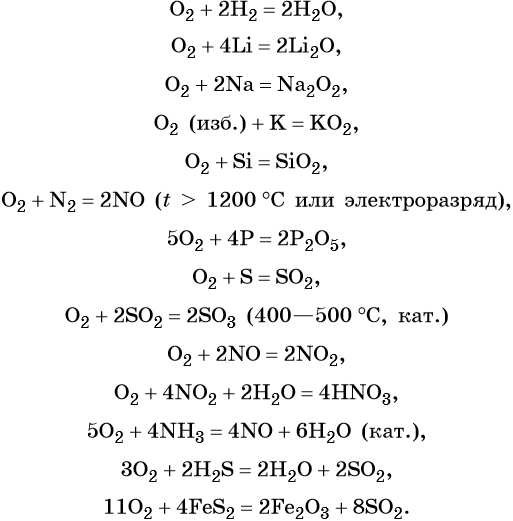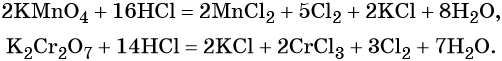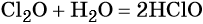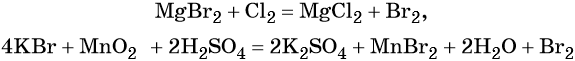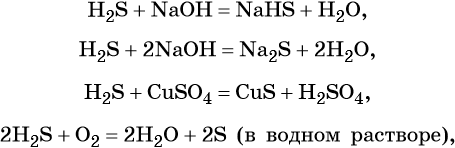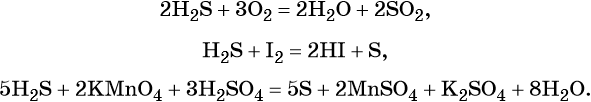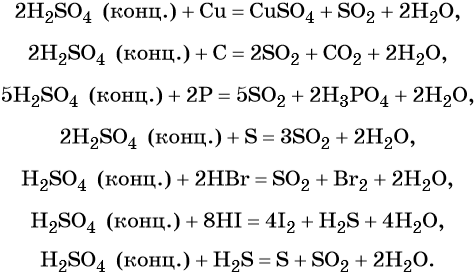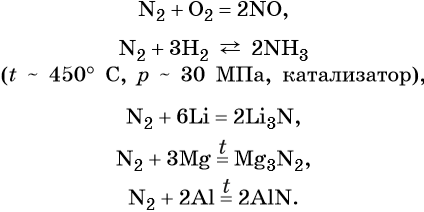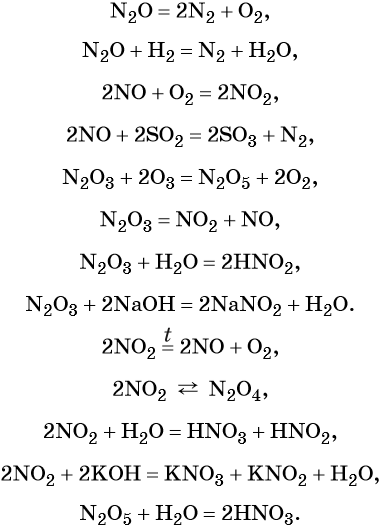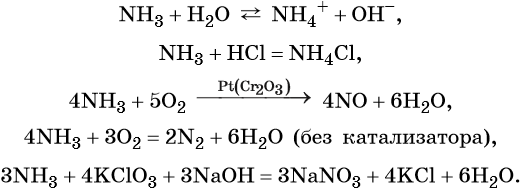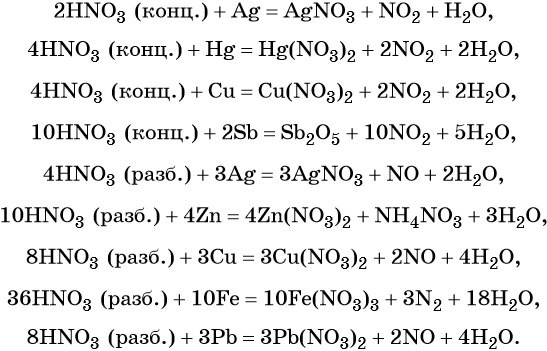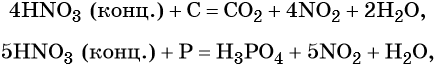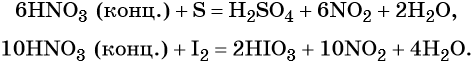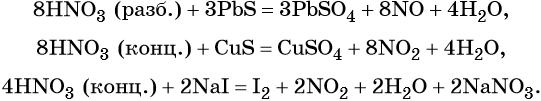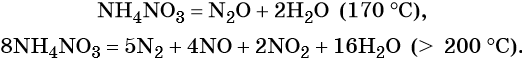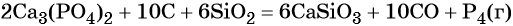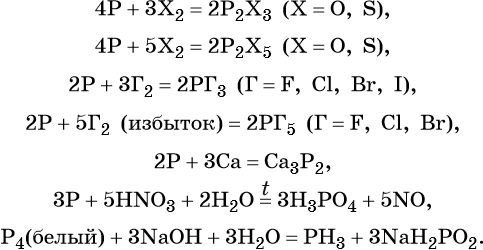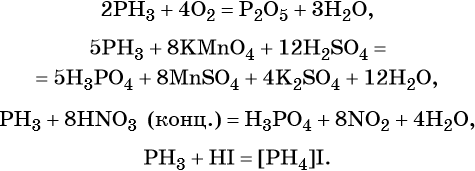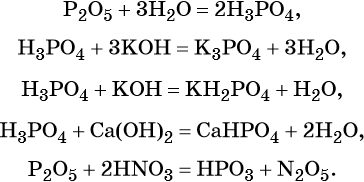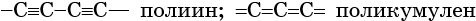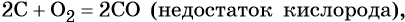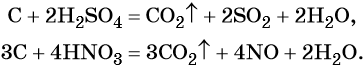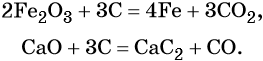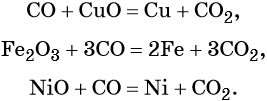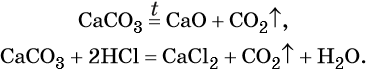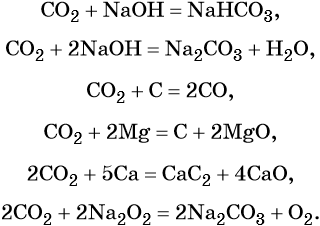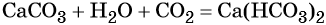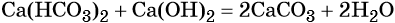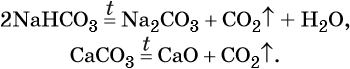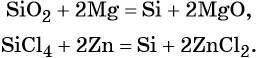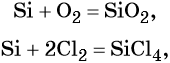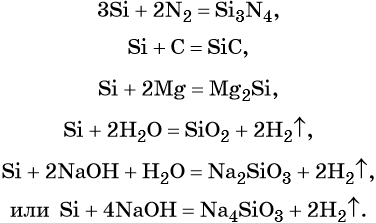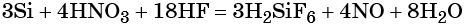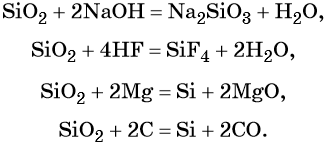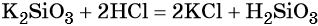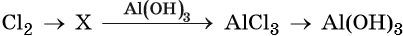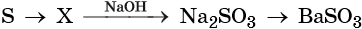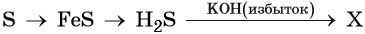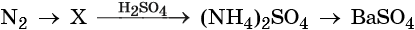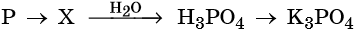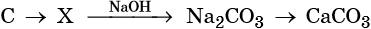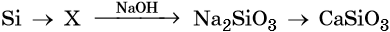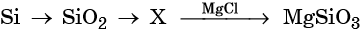- Кремний
- Положение в периодической системе химических элементов
- Электронное строение кремния
- Физические свойства, способы получения и нахождение в природе кремния
- Качественные реакции
- Соединения кремния
- Способы получения кремния
- Химические свойства
- Бинарные соединения кремния
- Силициды металлов
- Силан
- Карбид кремния
- Галогениды кремния
- Оксид кремния (IV)
- Физические свойства и нахождение в природе
- Химические свойства
- Кремниевая кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Силикаты
- Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
- Водород
- Кислород
- Галогены
- Фосфор
- Углерод
- Кремний
- Тренировочные задания
- Химические свойства фосфора
- Фосфор и соединения
- Химические свойства
- 🔥 Видео
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Видео:Фосфор. 9 класс.Скачать

Водород
Химический элемент водород занимает особое положение в периодической системе Д.И. Менделеева. По числу валентных электронов, способности образовывать в растворах гидратный ион H + он сходен с щелочными металлами, и его следует поместить в I группу. По числу электронов, необходимых для завершения внешней электронной оболочки, значению энергии ионизации, способности проявлять отрицательную степень окисления, малому атомному радиусу водород следует поместить в VII группу периодической системы. Таким образом, размещение водорода в той или иной группе периодической системы в значительной мере условно, но в большинстве случаев его помещают в VII группу.
Электронная формула водорода 1s 1 . Единственный валентный электрон находится непосредственно в сфере действия атомного ядра. Простота электронной конфигурации водорода отнюдь не означает, что химические свойства этого элемента просты. Напротив, химия водорода во многом отличается от химии других элементов. Водород в своих соединениях способен проявлять степени окисления +1 и –1.
Существует большое количество методов получения водорода. В лаборатории его получают взаимодействием некоторых металлов с кислотами, например:
Водород можно получить электролизом водных растворов серной кислоты или щелочей. При этом происходит процесс выделения водорода на катоде и кислорода на аноде.
В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива и коксового газа.
Простое вещество водород, H2, представляет собой горючий газ без цвета и запаха. Температура кипения –252,8 °C. Водород в 14,5 раза легче воздуха, мало растворим в воде.
Молекула водорода устойчива, обладает большой прочностью. Из-за высокой энергии диссоциации распад молекул H2 на атомы происходит в заметной степени лишь при температуре выше 2000 °C.
Для водорода возможны положительная и отрицательная степени окисления, поэтому в химических реакциях водород может проявлять как окислительные, так и восстановительные свойства. В тех случаях, когда водород выступает в качестве окислителя, он ведёт себя подобно галогенам, образуя аналогичные галогенидам гидриды (гидридами называют группу химических соединений водорода с металлами и менее электроотрицательными, чем он, элементами):
По окислительной активности водород существенно уступает галогенам. Поэтому ионный характер проявляют лишь гидриды щелочных и щёлочноземельных металлов. Ионные, а также комплексные гидриды, например, являются сильными восстановителями. Их широко используют в химических синтезах.
В большинстве реакций водород ведёт себя как восстановитель. При нормальных условиях водород не взаимодействует с кислородом, однако при поджигании реакция протекает со взрывом:
Смесь двух объёмов водорода с одним объёмом кислорода называют гремучим газом. При контролируемом горении происходит выделение большого количества тепла, и температура водородно-кислородного пламени достигает 3000 °С.
Реакция с галогенами протекает в зависимости от природы галогена по-разному:
С фтором такая реакция идёт со взрывом даже при низких температурах. С хлором на свету реакция также протекает со взрывом. С бромом реакция идёт значительно медленнее, а с йодом не доходит до конца даже при высокой температуре. Механизм этих реакций радикальный.
При повышенной температуре водород взаимодействует с элементами VI группы — серой, селеном, теллуром, например:
Очень важной является реакция водорода с азотом. Эта реакция обратима. Для смещения равновесия в сторону образования аммиака используют повышенное давление. В промышленности данный процесс осуществляют при температуре 450—500 °С, давлении 30 МПа, в присутствии различных катализаторов:
Водород восстанавливает многие металлы из оксидов, например:
Данную реакцию используют для получения некоторых чистых металлов.
Огромную роль играют реакции гидрирования органических соединений, которые широко используют как в лабораторной практике, так и в промышленном органическом синтезе.
Сокращение природных источников углеводородного сырья, загрязнение окружающей среды продуктами сгорания топлива повышают интерес к водороду как к экологически чистому топливу. Вероятно, водород будет играть важную роль в энергетике будущего.
В настоящее время водород широко применяют в промышленности для синтеза аммиака, метанола, гидрогенизации твёрдого и жидкого топлива, в органическом синтезе, для сварки и резки металлов и т. д.
Вода H2O, оксид водорода, является важнейшим химическим соединением. При нормальных условиях вода — бесцветная жидкость, без запаха и вкуса. Вода — самое распространённое вещество на поверхности Земли. В человеческом организме содержится 63—68 % воды.
Вода является стабильным соединением, её разложение на кислород и водород происходит лишь под действием постоянного электрического тока или при температуре около 2000 °C:
Вода непосредственно взаимодействует с металлами, стоящими в ряду стандартных электронных потенциалов до водорода. Продуктами реакции в зависимости от природы металла могут быть соответствующие гидроксиды и оксиды. Скорость реакции в зависимости от природы металла также изменяется в широких пределах. Так, натрий вступает в реакцию с водой уже при комнатной температуре, реакция сопровождается выделением большого количества тепла; железо реагирует с водой при температуре 800 °С.
Вода может вступать в реакцию со многими неметаллами, так, при обычных условиях вода обратимо взаимодействует с хлором:
При повышенной температуре вода взаимодействует с углем с образованием так называемого синтез-газа — смеси оксида углерода (II) и водорода:
При обычных условиях вода реагирует со многими основными и кислотными оксидами с образованием оснований и кислот соответственно:
Реакция идёт до конца, если соответствующее основание или кислота растворимы в воде.
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Кислород
Химический элемент кислород расположен во 2-м периоде VIA подгруппе. Его электронная формула 1s 2 2s 2 2p 4 . Простое вещество кислород — газ без цвета и запаха, мало растворим в воде. Сильный окислитель. Его характерные химические свойства:
Реакции простых и сложных веществ с кислородом часто сопровождаются выделением тепла и света. Такие реакции называют реакциями горения.
Кислород широко используется практически во всех областях химической промышленности: для производства чугуна и стали, производства азотной и серной кислоты. Огромное количество кислорода потребляется в процессах тепловой энергетики.
В последние годы обострилась проблема сохранения запасов кислорода в атмосфере. До настоящего времени единственным источником, пополняющим запасы атмосферного кислорода, является жизнедеятельность зелёных растений.
Видео:Химия 9 класс: Оксид кремнияСкачать

Галогены
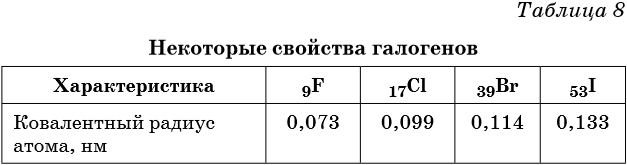
В VIIА группе находятся фтор, хлор, бром, йод и астат. Эти элементы называют также галогенами (в переводе — рождающие соли).
На внешнем энергетическом уровне всех этих элементов находятся 7 электронов (конфигурации ns 2 np 5 ), наиболее характерные степени окисления –1, +1, +5 и +7 (кроме фтора).
Атомы всех галогенов образуют простые вещества состава Hal2.
Галогены являются типичными неметаллами. При переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства падают, происходит уменьшение окислительных и увеличение восстановительных свойств.
Физические свойства галогенов приведены в таблице 8.
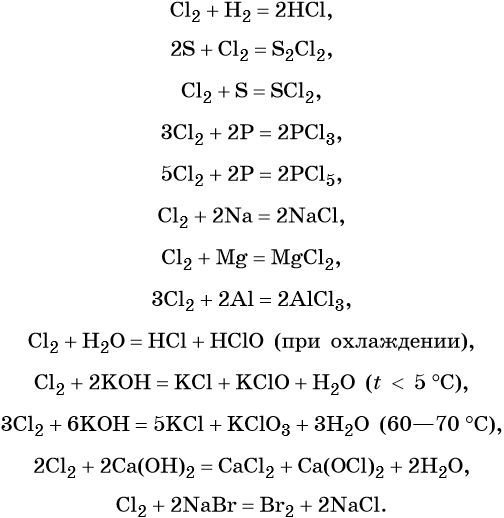
В химическом отношении галогены весьма активны. Их реакционная способность убывает с увеличением порядкового номера. Некоторые характерные для них реакции приведены ниже на примере хлора:
Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI.
Галогенводородные кислоты (за исключением HF) способны реагировать с такими сильными окислителями, как KMnO4, MnO2, K2Cr2O7, CrO3 и другими, с образованием галогенов:
Галогены образуют ряд оксидов, например, для хлора известны кислотные оксиды состава Cl2O, ClO2, ClO3, Cl2O7. Все эти соединения получают косвенными методами. Они являются сильными окислителями и взрывоопасными веществами.
Наиболее устойчивым из оксидов хлора является Cl2O7. Оксиды хлора легко реагируют с водой, образуя кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4, например:
В промышленности бром получают при вытеснении хлором из бромидов, а в лабораторной практике — окислением бромидов:
Простое вещество бром является сильным окислителем, легко вступает в реакции со многими простыми веществами, образуя бромиды; вытесняет йод из йодидов.
Простое вещество йод, I2, представляет собой чёрные с металлическим блеском кристаллы, которые возгоняются, т. е. переходят в пар, минуя жидкое состояние. Йод мало растворим в воде, но довольно хорошо растворяется в некоторых органических растворителях (спирт, бензол и т. д.).
Йод является довольно сильным окислителем, способным к окислению ряда металлов и некоторых неметаллов.
Химический элемент сера расположен в 3-м периоде VIA подгруппе. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 4 . Простое вещество сера — неметалл жёлтого цвета. Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Её характерные химические свойства:
Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
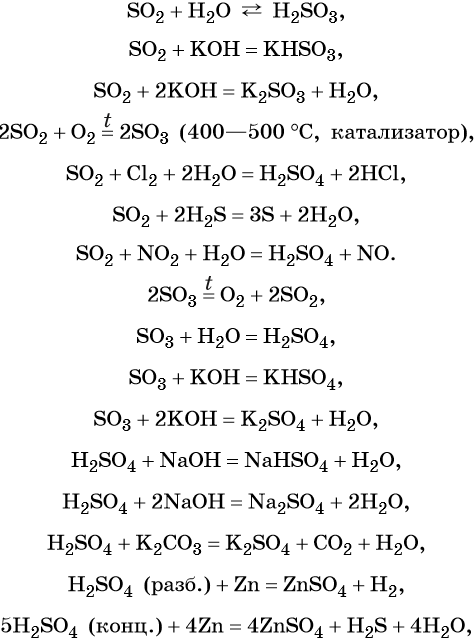
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует слабая, существующая только в растворе сернистая кислота H2SO3; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции:
Серная кислота в больших количествах производится в промышленности. Все промышленные методы производства серной кислоты основаны на первоначальном получении оксида серы (IV), его окислении в оксид серы (VI) и взаимодействии последнего с водой.
Химический элемент азот — находится во 2-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 3 . В своих соединениях азот проявляет степени окисления –3, –2, +1,+2, +3, +4, +5.
Простое вещество азот — газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.
Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO, являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе реакции диспропорционирования.
Химические свойства оксидов азота:
Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; температура кипения –33,7 °C, температура плавления –77,8 °C. Аммиак хорошо растворим в воде (700 объёмов NH3 на 1 объём воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:
Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это слабая кислота, её соли называют нитритами.
Кроме того, азот образует очень сильную азотную кислоту HNO3. Особенностью азотной кислоты является то, что при её окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония, например:
В реакциях с неметаллами концентрированная азотная кислота ведёт себя как сильный окислитель:
Также азотная кислота способна окислять сульфиды, йодиды и т. д.:
Подчеркнём ещё раз. Запись уравнений окислительно-восстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
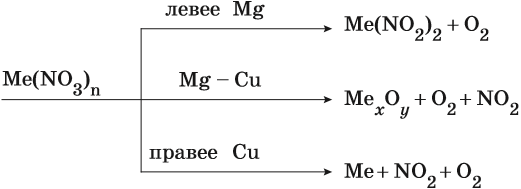
Соли азотной кислоты называют нитратами. Все нитраты хорошо растворимы в воде. Нитраты термически нестабильны и при нагревании легко разлагаются.
Особые случаи разложения нитрата аммония:
Общие закономерности термического разложения нитратов:
Видео:Уравнивание реакций горения углеводородовСкачать

Фосфор
Химический элемент фосфор расположен в 3-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 3 .
Простое вещество фосфор существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Чёрный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углём и песком при 1500 °C:
В приведённые ниже реакции вступают любые модификации фосфора, если нет особых оговорок:
Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:
Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трёхосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Углерод
Химический элемент углерод расположен во 2-м периоде, главной подгруппе IV группы периодической системы Д.И. Менделеева, его электронная формула 1s 2 2s 2 2p 2 , наиболее характерные степени окисления –4, +2, +4.
Для углерода известны стабильные аллотропные модификации (графит, алмаз, аллотропия строения), в виде которых он встречается в природе, а также полученные лабораторным путём карбин и фуллерены.
Алмаз — кристаллическое вещество с атомной координационной кубической решёткой. Каждый атом углерода в алмазе находится в состоянии sp 3 -гибридизации и образует равноценные прочные связи с четырьмя соседними атомами углерода. Это обуславливает исключительную твёрдость алмаза и отсутствие в обычных условиях электропроводности.
В графите атомы углерода находятся в состоянии sp 2 -гибридизации. Атомы углерода объединены в бесконечные слои из шестичленных колец, стабилизированные ω-связью, делокализованные в пределах всего слоя. Этим объясняется металлический блеск и электрическая проводимость графита. Углеродные слои объединены в кристаллическую решётку в основном за счёт межмолекулярных сил. Прочность химических связей в плоскости макромолекулы значительно больше, чем между слоями, поэтому графит довольно мягок, легко расслаивается и химически несколько активнее алмаза.
В состав древесного угля, сажи и кокса входят очень мелкие кристаллы графита с очень большой поверхностью, которые называют аморфным углеродом.
В карбине атом углерода находится в состоянии sp-гибридизации. Его кристаллическая решётка построена из прямолинейных цепочек двух видов:
Карбин представляет собой порошок чёрного цвета с плотностью 1,9—2,0 г/см 3 , является полупроводником.
Аллотропные модификации углерода могут переходить друг в друга при определённых условиях. Так, при нагревании без доступа воздуха при температуре 1750 °С алмаз переходит в графит.
В нормальных условиях углерод весьма инертен, однако при высоких температурах он вступает в реакции с различными веществами, причём самой реакционноспособной формой является аморфный углерод, менее активен графит, а самый инертный — алмаз.
Реакции, характерные для углерода:
Углерод устойчив к действию кислот и щелочей. Только горячие концентрированные азотная и серная кислоты могут окислить его до оксида углерода (IV):
Углерод восстанавливает многие металлы из их оксидов. При этом в зависимости от природы металла образуются либо чистые металлы (оксиды железа, кадмия, меди, свинца), либо соответствующие карбиды (оксиды кальция, ванадия, тантала), например:
Углерод образует два оксида: CO и CO2.
Оксид углерода (II) CO (угарный газ) представляет собой бесцветный газ без запаха, плохо растворимый в воде. Это соединение является сильным восстановителем. Он горит на воздухе с выделением большого количества теплоты, благодаря чему CO является хорошим газообразным топливом.
Оксид углерода (II) восстанавливает многие металлы из их оксидов:
Оксид углерода (II) является несолеобразующим оксидом, с водой и щелочами он не реагирует.
Оксид углерода (IV) CO2 (углекислый газ) представляет собой бесцветный, без запаха, негорючий газ, малорастворимый в воде. В технике его обычно получают термическим разложением CaCO3, а в лабораторной практике — действием на CaCO3 соляной кислоты:
Оксид углерода (IV) является кислотным оксидом. Его характерные химические свойства:
Оксиду углерода (IV) соответствует очень слабая двухосновная угольная кислота H2CO3, которая не существует в чистом виде. Она образует два ряда солей: средние — карбонаты, например карбонат кальция CaCO3, и кислые — гидрокарбонаты, например Ca(HCO3)2 — гидрокарбонат кальция.
Карбонаты переходят в гидрокарбонаты под действием избытка углекислого газа в водной среде:
Гидрокарбонат кальция превращается в карбонат под действием гидроксида кальция:
Гидрокарбонаты и карбонаты разлагаются при нагревании:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Кремний
Химический элемент кремний находится в 3-м периоде IVА группе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 2 , наиболее характерные степени окисления –4, +4.
Кремний получают восстановлением его оксида магнием или углеродом в электрических печах, а кремний высокой чистоты — восстановлением SiCl4 цинком или водородом, например:
Кремний может существовать в кристаллической или аморфной форме. В обычных условиях кремний довольно устойчив, причём аморфный кремний более реакционноспособен, чем кристаллический. Для кремния наиболее устойчива степень окисления +4.
Реакции, характерные для кремния:
Кремний не реагирует с кислотами (за исключением HF), пассивируется кислотами-окислителями, но хорошо растворяется в смеси плавиковой и азотной кислот, что можно описать уравнением:
Оксид кремния (IV), SiO2 (кремнезём), в природе встречается в основном в виде минерала кварца. В химическом отношении довольно устойчив, проявляет свойства кислотного оксида.
Свойства оксида кремния (IV):
Кремний образует кислоты переменного содержания SiO2 и H2O. Соединение состава H2SiO3 в чистом виде не выделено, но для упрощения допускается его запись в уравнениях реакций:
Видео:Разбор реакции: получение фосфора. 31 задание | ХИМИЯ ЕГЭ | Лия Менделеева и Юля НеонСкачать

Тренировочные задания
1. Водород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом
2) серой и хромом
3) оксидом углерода (II) и соляной кислотой
4) азотом и натрием
2. Верны ли следующие утверждения о водороде?
А. Перекись водорода можно получить сжиганием водорода в избытке кислорода.
Б. Реакция между водородом и серой идёт без катализатора.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Кислород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) фосфором и цинком
3) оксидом кремния (IV) и хлором
4) хлоридом калия и серой
4. Верны ли следующие утверждения о кислороде?
А. Кислород не реагирует с хлором.
Б. Реакция кислорода с серой даёт SO2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Фтор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) аргоном и азотной кислотой
3) оксидом углерода (IV) и неоном
4) водой и натрием
6. Верны ли следующие утверждения о фторе?
А. Реакция избытка фтора с фосфором приводит к PF5.
Б. Фтор реагирует с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Хлор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом
2) фосфором и серной кислотой
3) оксидом кремния (IV) и неоном
4) бромидом калия и серой
8. Верны ли следующие утверждения о хлоре?
А. Пары хлора легче воздуха.
Б. В заимодействие хлора с кислородом приводит к оксиду хлора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Бром при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) фосфором и железом
2) фосфором и серной кислотой
3) оксидом кремния (IV) и хлором
4) бромидом калия и серой
10. Верны ли следующие утверждения о броме?
А. Бром не вступает в реакцию с водородом.
Б. Бром вытесняет хлор из хлоридов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Йод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) фосфором и кальцием
3) оксидом кремния (IV) и хлором
4) хлоридом калия и серой
12. Верны ли следующие утверждения о йоде?
А. Раствор йода обладает бактерицидными свойствами.
Б. Йод реагирует с хлоридом кальция.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Сера при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и железом
2) фосфором и оксидом цинком
3) оксидом кремния (IV) и хлором
4) хлоридом калия и бромидом натрия
14. Верны ли следующие утверждения о сере?
А. При сплавлении серы и кальция образуется CaS.
Б. При реакции серы с кислородом образуется SO2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Азот при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) литием и хлоридом кальция
2) хлором и оксидом кальция
3) оксидом кремния (IV) и хлором
4) литием и кальцием
16. Верны ли следующие утверждения об азоте?
А. В промышленности реакцию азота и водорода осуществляют под высоким давлением в присутствии катализатора.
Б. При взаимодействии азота и натрия образуется Na3N.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Фосфор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и сульфидом кальция
2) хлором и кислородом
3) оксидом углерода (IV) и серой
4) серой и оксидом цинка
18. Верны ли следующие утверждения о фосфоре?
А. Реакция фосфора с хлором идёт только в присутствии катализатора.
Б. При реакции фосфора с избытком серы образуются только P2S3.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Углерод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кальцием и сульфатом бария
2) хлором и неоном
3) оксидом фосфора (V) и серой
4) серой и гидроксидом цинка
20. Верны ли следующие утверждения об углероде?
А. При взаимодействии углерода с натрием образуется карбид состава Na2C2.
Б. Углерод реагирует с оксидом кальция с образованием CaC2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Кремний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и гидроксидом натрия
2) хлором и неоном
3) оксидом фосфора (V) и серой
4) серой и гидроксидом цинка
22. Верны ли следующие утверждения о кремнии?
А. При взаимодействии кремния с углеродом образуется карбид состава SiC.
Б. Кремний реагирует с магнием с образованием Mg2Si.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
25. Установите соответствие между реагирующими веществами и продуктами реакций.
26. Установите соответствие между реагирующими веществами и продуктами реакций.
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Cl2 + Fe →
Б) Cl2 + Cr →
В) Cl2 (изб.) + P →
28. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaClO3 + NaCl + H2O
2) NaCl + NaClO + H2O
3) NaClO3 + NaCl
4) NaCl + Br2
5) NaClBr
29. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaClI
2) NaBrO + NaBr
3) NaBrO3 + NaBr + H2O
4) NaBrO + NaBr + H2O
5) NaBr + I2
30. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaBr + NaBrO3 + H2O
2) NaBr + NaBrO + H2O
3) I Br
4) H2SO4 + HBr
5) HBr + SO3
31. Установите соответствие между реагирующими веществами и продуктами реакций.
32. Установите соответствие между реагирующими веществами и продуктами реакций.
33. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) S + Na →
Б) S + HI →
В) S + NaOH →
34. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) S + Cl2 (недост.) →
Б) S + HNO3 (конц.) →
В) S + O2 →+
35. Установите соответствие между реагирующими веществами и продуктами реакций.
36. Установите соответствие между реагирующими веществами и продуктами реакций.
37. Установите соответствие между реагирующими веществами и продуктами реакций.
38. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P + Br2 (недост.) →
Б) P + Li
В) P + HNO3 (конц.) →
39. Установите соответствие между реагирующими веществами и продуктами реакций.
40. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) C + H2O →
Б) C + HNO3 →
В) C + S →
41. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Si + O2 →
Б) Si + S →
В) S i + Mg →
42. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Si + Cl2 →
Б) Si + C →
В) Si + NaOH →
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
51. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
52. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
53. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
54. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Видео:Химия 9 класс (Урок№20 - Кремний и его соединения. Стекло. Цемент.)Скачать

Химические свойства фосфора

Средняя оценка: 4.8
Всего получено оценок: 275.
Средняя оценка: 4.8
Всего получено оценок: 275.
Фосфор – жизненно важный элемент из пятой группы периодической таблицы Менделеева. Химические свойства фосфора зависят от его модификации. Наиболее активным веществом является белый фосфор, окисляющийся на воздухе. Фосфор имеет две валентности (III и V) и три степени окисления – +5, +3, -3.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Фосфор и соединения
Фосфор имеет три аллотропические модификации, отличающиеся химическими и физическими свойствами:
Под фосфором в химических реакциях чаще всего понимают белый фосфор (P4). Красный фосфор вступает в реакции при определённых условиях. Например, реагирует с водой при нагревании и под давлением. Чёрный фосфор практически инертен.

Фосфор реагирует с простыми и сложными веществами, образуя:
- фосфин;
- фосфорную кислоту;
- фосфиды;
- оксиды.
Фосфин (РН3) – плохо растворимый в воде ядовитый газ, аналог аммиака. В отсутствии кислорода при нагревании разлагается на простые вещества – фосфор и водород.
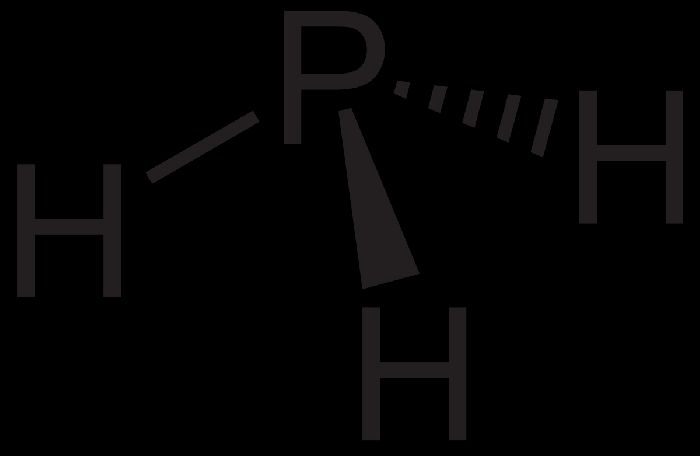
Фосфорная или ортофосфорная кислота (H3PO4) образуется при взаимодействии фосфора или оксида фосфора (V) с водой.
Фосфиды – соли, образующиеся при взаимодействии с металлами или неметаллами. Они неустойчивы и легко разлагаются под действием кислот или воды.
Фосфор может образовывать два оксида – P2O3 и P2O5.
H3PO4 – кислота средней силы, проявляющая амфотерные свойства при взаимодействии с сильной кислотой. Фосфорная кислота образует фосфаты.
Видео:9 класс. Урок 5. Фосфор. Строение и свойства.Скачать

Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
Вещество
Реакция
Особенности
Уравнение
При избытке O2 образует оксид фосфора (V)
🔥 Видео
Химия фосфора | Химия ЕГЭ 2022 | УмскулСкачать

32 задание. Соединения фосфораСкачать

Фосфор. Химические свойстваСкачать

Кремний и его соединения: химические свойства #кремний #химшкола #неметаллы #егэхимияСкачать

Соединения фосфораСкачать

Ортофорфорная кислота. Соли фосфорной кислоты. 9 класс.Скачать

Химия фосфора | Химия ЕГЭ | УмскулСкачать

Переход аллотропных модификаций фосфораСкачать

Химия. 9 класс. Фосфор. Соединения фосфора /03.03.2021/Скачать