Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
- Алкены
- Химические свойства алкенов
- Реакции присоединения
- Реакции окисления
- Готовые работы на аналогичную тему
- Реакции полимеризации
- Реакции замещения
- 🌟 Видео
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
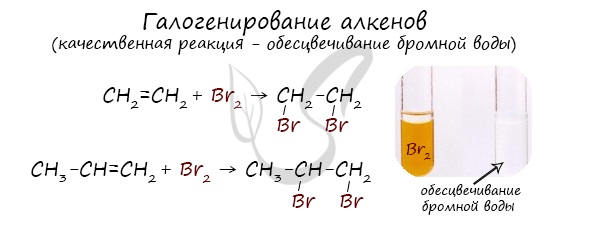
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
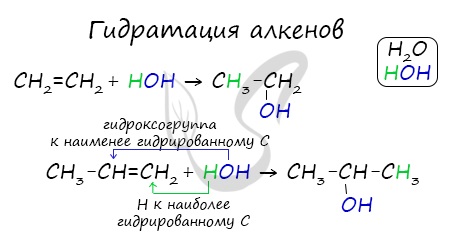
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
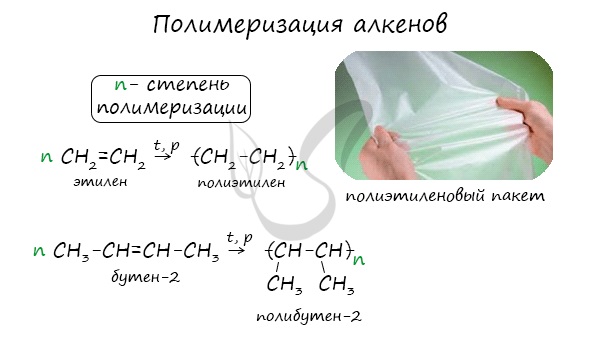
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
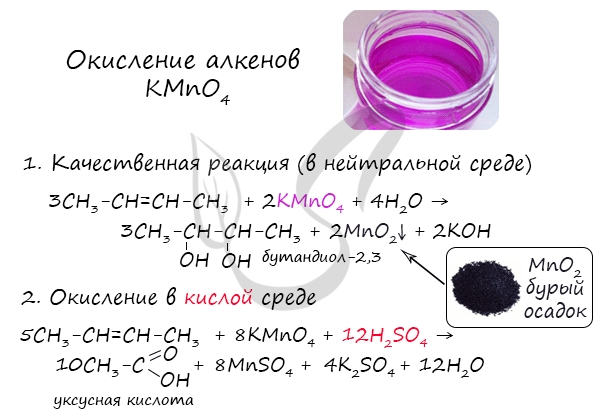
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
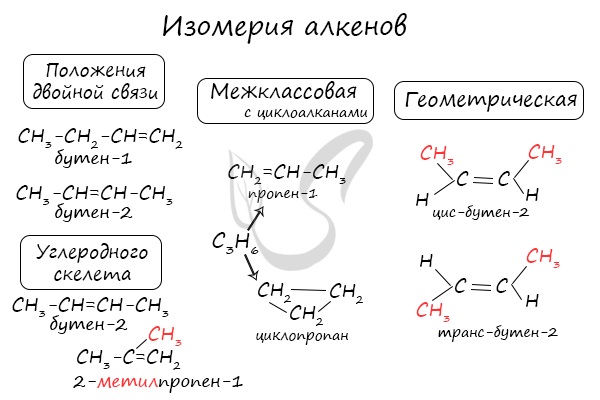
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Видео:Химические свойства алкеновСкачать

Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
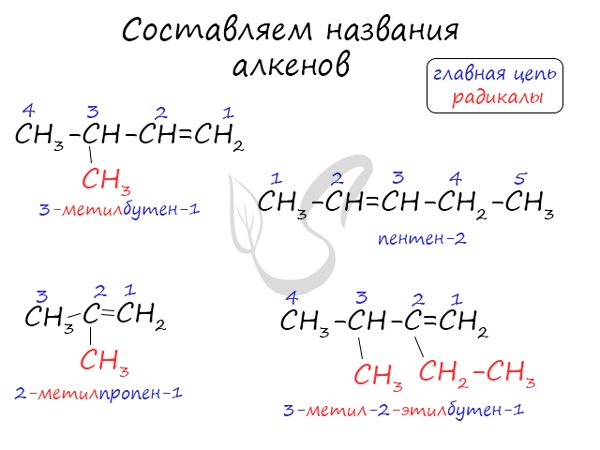
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства алкенов
Вы будете перенаправлены на Автор24
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны. Алкены легко вступают в реакции окисления, присоединения а также способны к алильному радикальному замещению.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции присоединения
Гидрирование Присоединение водорода (реакция гидрирования) к алкенам проводят в присутствии катализаторов. Чаще всего используют измельченные металлы — платину, никель, палладий и др. В результате образуются соответствующие алканы (насыщенные углеводороды).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Присоединение галогенов. Алкены легко при обычных условиях вступают в реакции с хлором и бромом с образованием соответствующих дигалогеналканов, в которых атомы галогена находятся у соседних атомов углерода.
При взаимодействии алкенов с бромом наблюдается обесцвечивание желто-бурой окраски брома. Это одна из старейших и самых простых качественных реакций на ненасыщенные углеводороды, поскольку аналогично реагируют также алкины и алкадиены.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Присоединение галогеноводородов. При взаимодействии этиленовых углеводородов с галогеноводородами ($HCl$, $HBr$) образуются галогеналканы, направление реакции зависит от строения алкенов.
В случае этилена или симметричных алкенов реакция присоединения происходит однозначно и ведет к образованию только одного продукта:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
В случае несимметричных алкенов возможно образование двух разных продукта реакции присоединения:
На самом деле в основном образуется только один продукт реакции. Закономерность направлении прохождения таких реакций установил российский химик В.В. Марковников в 1869 Она носит название правило Марковникова. При взаимодействии галогеноводородов с несимметричными алкенами атом водорода присоединяется по месту разрыва двойной связи в наиболее гидрированного атома углерода, то есть до того, что соединен с большим количеством атомов водорода.
Данное правило Марковников сформулировал на основе экспериментальных данных и только значительно позже оно получило теоретическое обоснование. Рассмотрим реакцию пропилена с хлористым водородом.
Одной из особенностей $p$-связи является его способность легко поляризоваться. Под влиянием метильной группы (положительный индуктивный эффект + $I$) в молекуле пропена электронная плотность $p$-связи смещается к одному из атомов углерода (= $CH_2$). Вследствие этого на нем возникает частичный отрицательный заряд ($delta -$). На другом атоме углерода двойной связи в соответствии возникает частичный положительный заряд ($delta +$).
Такое распределение электронной плотности в молекуле пропилена определяет место будущей атаки протоном. Это — атом углерода метиленовой группы (= $CH_2$), который несет частичный отрицательный заряд $delta-$. А хлор, соответственно, атакует атом углерода с частичным положительным зарядом $delta+$.
Как следствие, основным продуктом реакции пропилена с хлористым водородом является 2-хлорпропан.
Гидратация алкенов происходит в присутствии минеральных кислот и подчиняется правилу Марковникова. Продуктами реакции являются спирты
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Присоединение алканов к алкенам в присутствии кислотного катализатора ($HF$ или $H_2SO_4$) при низких температурах приводит к образованию углеводородов с большей молекулярной массой и часто используется в промышленности для получения моторного топлива
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Реакции окисления
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета:
Окисление перманганатом калия $KM_nO_4$ (реакция Е. Вагнера)
При окисления алкенов слабым раствором $KM_nO_4$ в слабощелочной среде образуются гликоли
$3CH_2=CH_2 + 2KM_nO_4 + 4H_2O → 3HO–CH_2–CH_2–OH + 2KOH + 2M_nO_2$
Данная реакция имеет стереоселективный характер, так как обусловлена образованием на промежуточных стадиях сложных цикличних эфиров.
Окисление пероксидом водорода в присутствии осмий (VIII) оксида
Продуктом данной реакции аналогично реакции Вагнера будет гликоль
$ CH_2=CH_2 + HO–OH → HO–CH_2–CH_2–OH$
Окисление органическими пероксидами (реакция М. Прилежаева)
Реакция М. Прилежаева — это синтез окиси этилена окислением олефинов гидропероксидами кислот, или надкислотами такими как надмуравьиная $HCOOH$, надбензойная $C_6H_5COOH$ и тому подобные.
Реакцию проводят смешиванием реагентов растворенных в инертном растворителе (гексан, бензол, хлороформ и др.) При температуре от -10 ° C до 60 ° C.
Окисление молекулярным кислородом
При окислении алкенов кислородом без катализатора происходит разрыв $beta$-связи $C-H$ с образованием гидропероксидов, которые раскладываются на спирты и альдегиды. Если использовать катализатор $Ag$, то продуктами реакции будут окись этилена (органические оксиды)
Реакция алкенов с озоном является наиболее важным методом окислительного расщепления алкенов по двойной связи. Ее используют для определения строения алкена. Данная реакция идет селективно по двойной связи с образованием пероксида водорода, альдегидов или кетонов.
В условиях реакции образованные альдегиды способны окисляться до соответствующих карбоновых кислот.
Окисление в присутствии солей палладия
Во время окисления алкенов в присутствии солей палладия $Pd$ (II) и воды образуются карбонильные соединения (альдегиды или кетоны). Например, этилен окисляется до этаналя. Данная реакция протекает в кислой среде и является промышленным способом добывания ацетальдегида
$2CH_2=CH_2 + O_2 → 2CH_3COH$
Готовые работы на аналогичную тему
Видео:Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать

Реакции полимеризации
Молекулы алкенов способны присоединяться при определенных условиях друг к другу с раскрытием $pi$-связей и образования димеров, триммеров или высокомолекулярных соединений — полимеров. Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионому механизму. Как инициаторы полимеризации применяют кислоты, перекиси, металлы и др. Реакцию полимеризации осуществляют также под действием температуры, облучения, давления. Типичным примером является полимеризация этилена с образованием полиэтилена
Видео:Химические свойства алкенов | Химия 10 класс | УмскулСкачать

Реакции замещения
Реакции замещения для алкенов не являются характерными. Однако при высоких температурах (свыше 400 ° C) реакции радикального присоединения, что носят обратимый характер, и подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 02 06 2021
🌟 Видео
ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

2.3. Алкены: Химические свойстваСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Галогенирование алкановСкачать

Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Алканы и алкены характерные реакцииСкачать

Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать

Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

реакция алюминия с хлоромСкачать