- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
- Составьте уравнения реакций восстановления меди из оксида меди (II) углеродом и оксидом углерода (II)?
- Ск углерода необходимо для восстановления 20 г оксида меди?
- Найти массу меди, которая получится при восстановлении углеродом m = 3, 6г оксида меди (II)?
- При восстановлении 40 г оксида меди (II) оксидом углерода (II) было получено 28 г меди?
- Сколько граммов свободной меди может быть получено из 20 г оксида меди 2 при восстановлении ее 8, 4г оксида углерода 2?
- Напишите уравнение реакции оксида углерода(||) с оксидом меди(||)?
- Напишите уравнение реакции восстановление углем меди из оксида меди?
- Напишите по 3 уравнения реакций получения : оксида меди (II), оксида углерода (IV), оксида алюминия?
- Оксид меди(I) + оксид углерода(II) запишите уравнение реакции и составьте электронный баланс?
- ПОМОГИТЕ?
- Составьте уравнения реакций восстановления :1)меди из оксида меди(2), углеродом и оксидов углерода(2)2)кадмия из оксида кадмия и марганца из оксида марганца(4)водородом3) железа из оксида железа(3) и ?
- Получение меди
- Способы получения меди
- Получение меди электролизом
- Получение оксида меди
- Получение сульфата меди
- Получение хлорида меди
- Получение глицерата меди
- Получение нитрата меди
- Получение сульфида меди
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Видео:8 класс. Химия. Как получить оксид меди (ll).Скачать

Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Видео:Опыты по химии. Взаимодействие водорода с оксидом меди (II)Скачать

Составьте уравнения реакций восстановления меди из оксида меди (II) углеродом и оксидом углерода (II)?
Химия | 5 — 9 классы
Составьте уравнения реакций восстановления меди из оксида меди (II) углеродом и оксидом углерода (II).
2СuO + C = 2Cu + CO2
CuO + CO = Cu + CO2.
Видео:Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

Ск углерода необходимо для восстановления 20 г оксида меди?
Ск углерода необходимо для восстановления 20 г оксида меди?
Видео:Восстановление оксида меди углём / isolation of copper by its oxide with carbonСкачать

Найти массу меди, которая получится при восстановлении углеродом m = 3, 6г оксида меди (II)?
Найти массу меди, которая получится при восстановлении углеродом m = 3, 6г оксида меди (II).
Видео:Восстановление меди водородом из оксида меди (II)Скачать

При восстановлении 40 г оксида меди (II) оксидом углерода (II) было получено 28 г меди?
При восстановлении 40 г оксида меди (II) оксидом углерода (II) было получено 28 г меди.
Чему равна массовая доля выхода продукта реакции?
Видео:Реакция обмена между оксидом меди и серной кислотойСкачать

Сколько граммов свободной меди может быть получено из 20 г оксида меди 2 при восстановлении ее 8, 4г оксида углерода 2?
Сколько граммов свободной меди может быть получено из 20 г оксида меди 2 при восстановлении ее 8, 4г оксида углерода 2.
Видео:Качественная реакция на оксид медиСкачать

Напишите уравнение реакции оксида углерода(||) с оксидом меди(||)?
Напишите уравнение реакции оксида углерода(||) с оксидом меди(||).
Видео:Получение оксида меди(1) - Cu2O. Реакция сульфата меди и сульфита натрия. Реакция CuSO4 и Na2SO3Скачать

Напишите уравнение реакции восстановление углем меди из оксида меди?
Напишите уравнение реакции восстановление углем меди из оксида меди.
Видео:Оксид меди II и алюминийСкачать

Напишите по 3 уравнения реакций получения : оксида меди (II), оксида углерода (IV), оксида алюминия?
Напишите по 3 уравнения реакций получения : оксида меди (II), оксида углерода (IV), оксида алюминия.
Видео:6 Восстановление оксида меди водородомСкачать

Оксид меди(I) + оксид углерода(II) запишите уравнение реакции и составьте электронный баланс?
Оксид меди(I) + оксид углерода(II) запишите уравнение реакции и составьте электронный баланс.
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
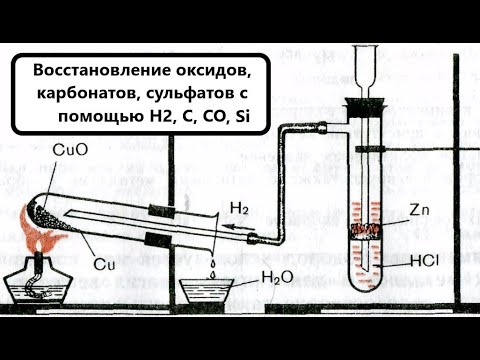
ПОМОГИТЕ?
Напишите уравнения реакций восстановления меди оксидом углерода (II) и водородом из оксида меди (II).
Обозначте степени окисления атомов, укажите переход электронов, а так же окислитель и восстановитель.
Видео:Разложение дигидроксикарбоната меди (ll), получение оксида меди (ll)Скачать

Составьте уравнения реакций восстановления :1)меди из оксида меди(2), углеродом и оксидов углерода(2)2)кадмия из оксида кадмия и марганца из оксида марганца(4)водородом3) железа из оксида железа(3) и ?
Составьте уравнения реакций восстановления :
1)меди из оксида меди(2), углеродом и оксидов углерода(2)
2)кадмия из оксида кадмия и марганца из оксида марганца(4)водородом
3) железа из оксида железа(3) и хрома из оксида хрома(3) алюминием.
Вы открыли страницу вопроса Составьте уравнения реакций восстановления меди из оксида меди (II) углеродом и оксидом углерода (II)?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Найдем сперва сколько грамм весит 1 моль. D(метан) = х / 16 Делим х на 16, так как метан весит 16. И вот подставим значения. 2, 5 = х / 16 Х = 40 Нашли что вещество весит 40 грамм. Напишем реакцию горения для сгорания 10 грамм этого вещетва , то ..
Ca + 2H₂O = Ca(OH)₂ + H₂↑ Ca + SiO₂(t) = CaO + Si CaO + SiO₂ (t) = CaSiO₃ 5Ca + 2CO₂(t) = CaC₂ + 4CaO Ca + 2HCl = CaCl₂ + H₂↑ 3Ca + N₂(t) = Ca₃N₂ Ca + H₂(t) = CaH₂.
N = m / M = 5, 34 / 132, 5 = 0, 04г / моль 3 — 2 х — 0, 04 это пропорция х = 0, 06г / моль V = n * Vm = 0, 06 * 22, 4 = 1, 344л.
2Mg + H2O — MgO + H2 Cu + HCl = = = > CuCl2 + H2(протекает при 600 — 700 гр Цельсия, реакция идет с HCl в газовом состоянии, а не с жидким HCl) 4Li + O2 = 2Li2O Cu + CI₂ = CuCI₂ Mg + CuCl2 — > MgCl2 = Cu 2Al + 3Fe2SO4 = Al2(SO4)3 + 6Fe Na2O + H2O = 2..
Налить воды и размешать. Сахар растворится в воде и опустится на дно, бензин поднимется наверх. Вставляем трубочку и. . Если это, конечно, не бак автомобиля.
Отфильтровать через тряпку или водой промыть. Сахар в бензине не растворим, кстати.
Это пероксид водорода. H2O2 H — O — O — H Разложение пероксида водорода : 2H2O2 = O2 + 2H2O в присутствии катализатора MnO2 Бурное выделение кислорода, иногда разложение сопровождается взрывом.
Потому что, Это как чешуя. Он выдергивает (старые )свои перья, на новые.
Видео:Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Получение меди
Медь или купрум, названа так в честь острова Кипр, где нашли крупное ее месторождение. Это один из первых металлов, освоенных человеком. Медный век – удивительная эпоха, в которую обиход человека был наполнен медными орудиями и предметами быта, он продолжался с IV до III тысячелетия до н. э.
Видео:Как сделать оксид меди из медного купороса. 🧪Скачать

Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.
В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.
Совсем по-другому протекают реакции получения меди методом окислительного обжига. Этим методом обогащают медные руды, в составе которых имеется существенное количество серы. Для реализации этой технологии необходимо нагреть руду до температуры 700–8000 градусов. Под действием таких высоких температур происходит окисление сульфидов, и объем серы в медной руде снижается почти в два раза. Следующим этапом является расплавление обогащенной руды в отражательных или шахтных печах при температуре 14500. Результатом этого расплава является образование штейна – сплава, который состоит из сульфидов меди и железа.
Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.
Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
Видео:Восстановление оксида меди водородомСкачать

Получение меди электролизом
Электролиз меди является одним этапов химико-физических процессов, которому подвергают руду, чтобы получить медь. Примечательно, что для получения 1 тонны чистой меди, потребуется переработать как минимум 200 тонн медной руды.
Сама процедура обработки медной руды – это многоступенчатый и очень сложный процесс, который состоит из 7 стадий. Самой последней и является электролиз меди.
Руду после добычи необходимо измельчить в особых машинах. Далее происходит процесс флотации, в результате которого, как мы знаем, формируется концентрат с сохранением минералов меди. После этого происходит обжиг при высоких температурах в специальных печах. Шихту, полученную в процессе обжига, помещают в печь для плавки, где она становится штейном, который в свою очередь оправляют на конвертирование. Продукт, полученный после этих процессов, называют черновой медью, где 2-3% объема занимают примеси. В качестве примесей выступают цинк, железо, или сера. Их удаляют реакцией окисления. На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
Чтобы осуществить процесс электролиза меди понадобится специальное оборудование, а именно емкости, которые заполняют водным раствором сульфата меди с содержанием свободной серной кислоты. В результате проведения электролиза, мы получим осадок чистой меди на катодах. А все, что окажется на дне ванны, принято называть шламом. Он является сырьем для получения благородных металлов.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
В воде оксид меди не растворяется и не вступает в реакции с ней. Обладает слабыми амфотерными свойствами с преобладанием основных.
С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
Результатом сплавления оксида меди со щелочами является образование купратов:
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
Видео:🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.Скачать
![🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.](https://i.ytimg.com/vi/sP6je5DSl9c/0.jpg)
Получение сульфата меди
Получить сульфат меди можно тремя реакциями:
растворить CuO в H2SO4
в присутствии концентрированной серной кислоты с медью, обязательно при нагревании
методом взаимодействия Cu2O с разбавленной серной кислотой
Видео:Получение оксида меди IIэкспериментСкачать

Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.
Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.
Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
- CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0. Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Видео:Элементный состав углеводородовСкачать

Получение глицерата меди
Качественная реакция для выявления присутствия глицерина в растворах осуществляется в присутствии сульфата меди (II) и раствора гидроксида натрия. В результате реакции образуется глицерат меди – комплексное соединение сине-василькового оттенка.
Химическую реакцию проводят следующим образом:
- к раствору сульфата меди (II) приливают раствор гидроксида натрия, в результате чего происходит окрашивание раствора в синий цвет. Таким образом, наблюдаем выпадения осадка гидроксида меди (II)
- после этого добавляем несколько мл глицерина и перемешиваем раствор. Образовавшийся осадок растворяется с образованием комплексного соединения оттенка индиго. Это и есть глицерат меди.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение нитрата меди
Получение нитрата меди Cu(NO3)2 довольно увлекательное занятие. А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
Получение сульфида меди
Сульфид меди(II) или моносульфид меди — CuS, является неорганическим бинарным соединением двухвалентной меди с серой. Он верного цвета, в воде не растворяется , также как и в разбавленных растворах кисло. В природе его можно встретить в виде редкого минерала ковеллина.
Получение сульфида меди осуществляется при помощи прямого взаимодействия элементов, а также в результате обменной реакции солей двухвалентной меди с водорастворимыми сульфидами.
- Na2S+CuSO4=CuS+Na2SO4
- CuCl2 + H2S —> CuS + 2HCl
- 2CuS + H2 —>Cu2S + H2S. Эта реакция протекает в условиях высокой температуры от 600 до 700 oC
Получение сухим методом дает сульфиду меди возможность проводить электрический ток. Когда отметка термометра достигает 400 °C, наблюдается заметное разложение сульфида.
















