- Аналитические приборы для контроля и регулирования технологических процессов, мониторинга окружающей среды
- Электроды для потенциометрических измерений
- Потенциал стеклянного электрода определение активности ионов водорода
- Внутренний хлорсеребряный электрод и буферный раствор — определенный потенциал
- Потенциал стеклянного электрода, анализируемый раствор
- Уравнение Нернста для измерения рН можно записать в виде
- pH электроды не запаянной конструкции
- pH электроды запаянной конструкции
- электроды измерительные (стеклянные, мембранные, редоксметрические) и вспомогательные (сравнения).
- в лабораторных условиях:
- в промышленных условиях:
- специальные электроды:
- Осуществляется продажа ионоселективных стеклянных электродов:
- Преимущества стеклянных электродов
- Электрод сравнения 2-го разряда ЭСО-01
- Электролитический ключ: изменение диффузионного потенциала при переносе из кислоты в щелочь не превышает ± 1 мВ
- При проведении измерений необходимо соблюдать следующие условия:
- Уравнение нернста для рн стеклянного электрода
- ПРИНЦИП ИЗМЕРЕНИЯ рН С ПОМОЩЬЮ СТЕКЛЯННОГО ЭЛЕКТРОДА
- 🔥 Видео
Видео:Лекция 85 Стеклянный электродСкачать

Аналитические приборы для контроля и регулирования технологических процессов, мониторинга окружающей среды
Производство лабораторных измерительных приборов было организовано в конце 1950-х годов предприятием специализирующееся на выпуске специализированных аналитических приборов. Оборудование предназначенное для контроля и регулирования технологических процессов, мониторинга окружающей среды, а также электродных систем для потенциометрических измерений.
Предприятие приборостроительной отрасли специализирующимся на выпуске лабораторных электродов и промышленных электродов.
Электроды для потенциометрических измерений
Проектирование, изготовлением различных моделей электродов для потенциометрических измерений.
При потенциометрическом (электрометрическом) методе определения активности ионов в растворе необходима электродная система, состоящая из двух электродов:
- измерительный (стеклянный) электрод, который погружается в исследуемый раствор, изменение состава которого сказывается на потенциале этого электрода,
- вспомогательный электрод (сравнения), имеющий постоянный потенциал.
Потенциал стеклянного электрода определение активности ионов водорода
Теория возникновения потенциала на примере стеклянного электрода при определении активности ионов водорода.
Стеклянный (измерительный) электрод — это система, включающая небольшой сосуд из стекла с помещенным в него внутренним буферным раствором и токоотводом . Сосуд имеет горловину из изолирующего стекла, на конце которой напаян шарик (мембрана) из специального электродного стекла, обладающего заметной электропроводностью. Токоотводом может служить внутренний хлорсеребряный электрод.
Стекло проводит электричество благодаря тому, что в нем могут мигрировать ионы щелочных металлов (натрия или лития), входящие в состав при его синтезе.
Внутренний хлорсеребряный электрод и буферный раствор — определенный потенциал
- На границе токоотвода (внутренний хлорсеребряный электрод) и внутреннего буферного раствора возникает совершенно определенный потенциал.
- Потенциал возникает и на границе стеклянной мембраны с внутренним раствором.
- В ходе измерений внутренний раствор, а значит, и сумма внутренних потенциалов остаются постоянными.
Видео:Стеклянные электродыСкачать

Потенциал стеклянного электрода, анализируемый раствор
Происхождение потенциала стеклянного электрода можно представить так. Когда электрод помещается в анализируемый раствор, в поверхностные слои электродного стекла из анализируемого раствора интенсивно проникают ионы водорода, вытесняя ионы содержащегося в стекле щелочного металла. Энергетическое состояние ионов в стекле и в растворе различно. Это приводит к тому, что ионы водорода так распределяются между стеклом и раствором, что поверхности этих сред (фаз) приобретают противоположные заряды, а между стеклом и анализируемым раствором возникает разность потенциалов.
Величина этой разности потенциалов зависит от рН, потому что стремление ионов водорода перейти в стекло зависит от их концентрации в растворе. Чем она больше, тем больше это стремление. Возникающая разность потенциалов так направлена, что она уменьшает стремление ионов водорода переходить в стекло. При определенной концентрации ионов водорода в растворе между стремлением их переходить в стекло и электрическим силами, которые приходится преодолевать, установится равновесие. При этом переход ионов Н + из раствора в стекло будет осуществляться с той же скоростью, что и обратный переход из стекла в раствор.
Для измерения величины потенциала стеклянного электрода используется вспомогательный электрод (сравнения).
Потенциал вспомогательного электрода при измерении рН практически не меняется, так он зависит от концентрации ионов хлора, которая около системы Ag / AgCL (если электрод хлорсеребряный) задана и остается постоянной. Вспомогательный электрод соединен с анализируемым раствором электролитическим ключом с раствором хлористого калия. Роль этого ключа — обеспечивать проведение тока между исследуемым раствором и вспомогательным электродом, стабилизировать и свести к минимуму потенциал на этой границе.
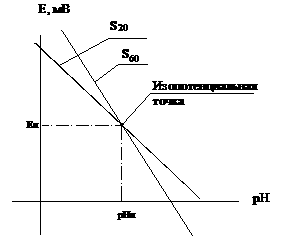
Графически зависимость э.д.с. электродной системы, состоящей из стеклянного и вспомогательного электродов, от величины рН представляет собой прямую линию (рисунок 1).
В очень кислых растворах могут наблюдаться «кислотные ошибки», в очень щелочных — «щелочные ошибки», т.е. кривая отклоняется от линейного хода. Положение этих отклонений зависит от состава стекла и природы ионов.
На кривой зависимости э.д.с. от величины рН имеется точка (область), соответствующая такой концентрации определяемого иона, при которой потенциал электрода не зависит от температуры. Это изопотенциальная точка (рисунок 1).
Рисунок 1. График зависимости э.д.с. электродной системы от величины рН
Уравнение этой прямой (Нернста)
Е — разность потенциалов между измерительным (стеклянным) электродом и вспомогательным электродом, мВ;
Е0 — константа, зависящая в основном от свойств электрода сравнения (стандартный потенциал электрода), мВ;
S — крутизна электродной функции электрода (Нернстовский угловой коэффициент наклона)

R — газовая постоянная, Дж?моль –1 ? К –1 ;
n — заряд иона с учетом его знака;
F — Число Фарадея, Кл/моль;
N — абсолютная температура, ºК;
а — активность соответствующего иона.
Видео:Электродные потенциалы металлов. Электроды сравненияСкачать

Уравнение Нернста для измерения рН можно записать в виде
Еи, рНи — номинальные значения координат изопотенциальной точки электродной системы, состоящей из стеклянного (измерительного) и вспомогательного электродов, соответственно, мВ, рН;
рН t — значение рН буферного раствора при температуре t , ºС;
St — крутизна водородной характеристики в мВ/рН при температуре t ºС, рассчитанная по формуле

t — температура анализируемой среды, ºС;
Крутизна электродной системы St зависит от температуры; при температуре 25ºС и десятикратном изменении активности определяемого иона она равна 59,16 мВ для однозарядных ионов и 29,56 для двухзарядных ионов. Однако обычно крутизна электродной функции меньше теоретического значения, что обусловлено присутствием мешающих примесей или старением жидкостного электрода.
Для удобства оценки реальной крутизны электродной системы St реал, как правило, используют безразмерный коэффициент К S , учитывающий отклонение реальной величины крутизны от теоретического значения;

St реал — реальное значение крутизны электродной функции, мВ/рН;
St — теоретическое значение крутизны электродной функции, рассчитанное по формуле (4), мВ/рН.
Коэффициент К S , в основном равный 0,8…1,2, позволяет учитывать отклонение крутизны электродной системы St реал от теоретического значения.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

pH электроды не запаянной конструкции
Производство и выпуск простейших электродов не запаянной конструкции (рисунок 2) только для измерения величины рН в узком диапазоне.
Рисунок 2. Электрод не запаянной конструкции
В лабораторных стеклянных электродах не запаянной конструкции, особенно при перепадах температур анализируемой среды, может нарушаться герметичность, внутренний буферный раствор взаимодействует не только со стеклом корпуса электрода, но и и другими материалами, которые обеспечивают герметичность (резина, смола и др.). В результате этого внутренний раствор меняет свой состав, что ведет к быстрому изменению контрольного потенциала электрода и изменению координат изопотенциальной точки.
В настоящее время мы выпускаем более сложные стеклянные электроды запаянной конструкции не только для измерения величины рН в широком диапазоне от -0,5 до 14 рН, но и для измерения других ионов.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

pH электроды запаянной конструкции
Выпуск электродов запаянной конструкции.
Рисунок 3. Электрод запаянной конструкции
Преимущества электродов запаянной конструкции (рисунок 3). Внутренний буферный раствор, заполняющий корпус электрода, находится в запаянной стеклянной колбе, он не соприкасается ни с какими другими материалами, кроме стекла, и поэтому сохраняет свой состав даже при резких перепадах температур анализируемой среды, в результате чего потенциал электрода длительное время остается практически без изменений, что положительно сказывается на работоспособности электродов.
Видео:Лекция 4 Уравнение Нернста. Электрохимическое равновесиеСкачать

электроды измерительные (стеклянные, мембранные, редоксметрические) и вспомогательные (сравнения).
Проектирование и выпуск электродов для потенциометрических измерений как измерительные (стеклянные, мембранные, редоксметрические), так и вспомогательные (сравнения).
Для измерения величины рН предлагаем использовать модели электродов по области назначения в лабораторных условиях, в промышленных условиях, специальные электроды:
Видео:Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

в лабораторных условиях:
- электроды запаянной конструкции ЭСЛ-43-07, ЭСЛ-43-07СР, ЭСЛ-45-11 для температур от 0 до 40 ºС;
- электроды запаянной конструкции ЭСЛ-63-07, ЭСЛ-63-07СР, ЭСЛ-15-11 для температур от 25 до 100 ºС;
- комбинированные стеклянные лабораторные электроды ЭСКЛ-08М.1 , ЭСКЛ-08М для температур от 0 до 50 ºС, изменение диффузионного потенциала на электролитическом ключе вспомогательного электрода при переносе электрода из кислоты в щелочь не превышает ±1 В;
Видео:Потенциометрический принцип измерения рНСкачать

в промышленных условиях:
- электроды запаянной конструкции ЭСП-04-14 для температур от 0 до 40 ºС;
- электроды запаянной конструкции ЭСП-01-14 для температур от 25 до 100 ºС;
- электрод запаянной конструкции ЭСП-31-06 для температур от 70 до 150 ºС;
- электрод запаянной конструкции ЭС-71-11 — стерилизуемый, диапазон измерения величины рН от -0,5 до 12 рН при 25 ºС (электрод без стерилизации можно использовать для температур от 15 до 80 ºС). Электродное стекло, используемое для изготовления электрода ЭС-71-11, позволяет производить измерения в растворах с величиной рН до -0,5 рН (в растворах, содержащих серную кислоту);
Видео:Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

специальные электроды:
- электрод 5М2.840.019 запаянной конструкции — для анализаторов АН-72529/60,
- электрод 5М2.840.074 запаянной конструкции — для анализаторов АС-7932.
Видео:Уравнение НернстаСкачать
Осуществляется продажа ионоселективных стеклянных электродов:
- электроды стеклянные ЭСЛ-51-07, ЭСЛ-51-07СР запаянной конструкции — для измерения активной концентрации ионов натрия Na + и ионов серебра Ag + ,
- электрод стеклянный ЭС-10-07 запаянной конструкции — для измерения активной концентрации ионов натрия Na + , в комплекте с приборами типа р N а-205 измеряет активную концентрацию ионов натрия в химически обессоленной воде и конденсате пара котлов высокого давления ;
- электрод сульфидсеребряный ЭСС-01 — для определения концентрации сульфид-иона S –2 в промышленных условиях, в том числе в сульфатных щелоках целлюлозно-бумажного производства, а также для измерения активной концентрации ионов серебра Ag + ,
- и ионоселективные мембранные электроды:
- электрод аргентитовый ЭА-2 — для измерения активности сульфидных ионов (величины р S ) и может быть применен в промышленных датчиках при автоматическом контроле концентрации сульфидных ионов р S в водных растворах; применяется в выпускаемых нами сигнализаторах СЦ-2,
- электроды мембранные ЭМ- I -01, ЭМ- I -01СР — для измерения активной концентрации ионов I – ,
- электроды мембранные ЭМ- CN -01, ЭМ- CN -01СР — для измерения активной концентрации ионов CN – ; могут применяться в химической и золотодобывающей промышленности, при анализе и очистки сточных вод гальванических цехов, на обогатительных фабриках, в процессах флотации с применением цианистых солей; применяется в выпускаемых нами сигнализаторах СХ-2,
- электроды мембранные ЭМ- Cl -01, ЭМ- Cl -01СР — для измерения активной концентрации ионов Cl ; могут применяться в химической промышленности при контроле технологических процессов, при анализе и очистке сточных вод гальванических цехов, в научных исследованиях, медицине,
- электроды мембранные ЭМ- NO 3-07, ЭМ- NO 3-07СР — для измерения активной концентрации ионов NO – 3; могут применяться для анализа почв, продукции растениеводства, пищевой промышленности; могут быть использованы в лабораторной практике в различных отраслях промышленности, биологии, медицины, охраны окружающей среды,
Для измерения окислительно-восстановительных потенциалов выпускаем электроды, как с использованием драгоценных металлов, так и со специальным электродным стеклом: ЭПВ-1, ЭПВ-1СР, ЭТП-02, ЭПЛ-02, ЭО-01 .
- Электроды ЭПВ-1, ЭПВ-1СР, ЭПЛ-02 являются наиболее распространенными электродами. В обратимых окислительно-восстановительных системах позволяют проводить определение концентраций компонентов до 10 –5 н. В сравнении с электродом ЭТП-02 имеют меньшую чувствительность к примесям и большой срок службы, в особенности при повышенных температурах и в средах, содержащих твердые частицы. Однако газообразные кислород и водород, каталитические яды оказывают влияние на потенциал электрода. Электроды имеют ограничения по шкале окислительных потенциалов, прежде всего в области сред с низкими окислительными потенциалами из-за обратимой системы Н2 / Н + на платине.
- Электрод ЭТП-02 обладает высокой чувствительностью и малой поляризуемостью за счет того, что индикаторная часть выполнена из мелкодисперсной платины. Это позволяет в ряде случаев проводить измерения в малобуферных растворах систем. Высокая чувствительность электрода из-за активности мелкодисперсной платины к газообразным водороду и кислороду, а также к ядам (соединениям серы, мышьяка, ртути) ограничивает его использование в разбавленных растворах и растворах, содержащих газообразные водород и кислород, каталитические яды.
- Электрод ЭО-01 (с электронно-проводящим электродным стеклом) в большинстве растворов обратимых редокс систем имеет меньшие токи обмена, чем платиновая проволока. Как и с электродами ЭПВ-1, с электродом ЭО-01 можно проводить определение концентраций в обратимых системах вплоть до концентраций 10 –5 н, но время установления равновесных потенциалов несколько больше. Для электрода ЭО?01 не характерны каталитические эффекты, не проявляется влияние газообразных кислорода и водорода. Электрод позволяет производить измерения в растворах со слабо выраженными окислительно-восстановительными свойствами (в растворах с относительно низкой буферной емкостью). Из-за сравнительно невысокой химической устойчивости электродного стекла ограничена область применения электрода ЭО-01 по величине рН (от 3 до 11 рН при прямых потенциометрических измерениях).
Видео:Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Преимущества стеклянных электродов
Измерительные стеклянные электроды с внутренним заполнением — запаянной конструкции , о преимуществах электродов запаянной конструкции говорилось ранее.
Кроме того, для исключения влияния статического электричества на показания измерительных высокоомных лабораторных электродов: ЭСЛ-43-07, ЭСЛ-43-07СР,
ЭСЛ-63-07, ЭСЛ-63-07СР, ЭСЛ-45-11, ЭСЛ-15-11, ЭСЛ-51-07, ЭСЛ-51-07СР, ЭС-10-07, а также ЭСП-31-06, ЭС-71-11 мы используем не только бесшумный экранированный коаксиальный кабель с сопротивлением изоляции более 10 12 Ом, но и экранируем внутреннюю часть электрода металлическим экраном, что уменьшает дрейф потенциала.
В эксплуатационных документах мы указываем линейный диапазон ионной характеристики электродов не только для температур 25 ºС (20 ºС), но и для максимальных температур анализируемой среды (требование государственных стандартов) , что позволяет потребителю правильно выбрать необходимый для своих условий электрод, в то время как другие изготовители нормируют линейный диапазон ионной характеристики только для температуры 25 ºС.
В нормативных и эксплуатационных документах на измерительные электроды мы указываем оптимальные диапазоны по температуре анализируемой среды и пределам измерений, что позволяет потребителю правильно выбрать электрод для обеспечения длительной эксплуатации электродов без ухудшения их характеристик.
Для всех стеклянных рН — электродов мешающими ионами являются ионы щелочных металлов — в основном ион натрия, поэтому мы нормируем верхние значения линейного диапазона водородной характеристики рН-электродов при мешающем влиянии ионов натрия, равном 0,1 моль/л (требование государственных стандартов) .
В отсутствии мешающих ионов большинство стеклянных рН электродов имеют линейную функцию вплоть до рН = 14.
Кроме измерительных электродов предлагаются вспомогательные электроды (сравнения) как для промышленных условий, так и для лабораторных.
Это лабораторные электроды ЭВЛ-1М3.1, ЭВЛ-1М4 , электроды промышленные ЭВП-08 , ЭХСВ-1 , электроды 5М2.840.072 5М2.840.072 для лабораторных анализаторов АН?7529/60 и АС-7932.
Видео:011 Электрохимия 4 уравнение НернстаСкачать

Электрод сравнения 2-го разряда ЭСО-01
Осущетствляется выпуск единственного на постсоветском пространстве образцового электрода сравнения 2-го разряда ЭСО-01 .
Вспомогательные электроды (сравнения): ЭВЛ-1М3.1, ЭВЛ-1М4, ЭВП-08,
ЭХСВ-1, ЭСО-01 , выпускаемые заводом, являются насыщенными хлорсеребряными, поэтому потенциал электродов стабильный, не зависит от изменения концентрации внутреннего раствора при изменении температуры, температурный коэффициент потенциала электродов не меняет свой знак в зависимости от температуры раствора.
Потенциалообразующая часть лабораторных электродов расположена в верхней части корпуса электродов и не погружается в контролируемый раствор, поэтому влияние температуры контролируемого раствора минимально.
Через электролитический ключ вспомогательного электрода осуществляется связь вспомогательного электрода с анализируемым раствором. На электролитическом ключе возникает диффузионный потенциал. Диффузионный потенциал вспомогательного электрода различается в зависимости от конструкции электролитического ключа и скорости истечения электролита через электролитический ключ. При низкой или неравномерной скорости истечения электролита через ключ меняется диффузионный потенциал, что приводит к неправильным измерением. При проведении точных измерений надо заботиться о постоянстве диффузионных потенциалов.
Практика утверждает, что при использовании ключей с небольшой скоростью истечения диффузионный потенциал нестабилен. Причиной нестабильности диффузионного потенциала керамических ключей моет быть также закупорка пор солевого мостика грязью, осадками или кристаллами хлористого калия. Изменение диффузионного потенциала на керамическом ключе может достигать 12 мВ.
Видео:Nernst equation for single electrode 🔥 #electrochemistry #educationalshortvideo #nernstequationСкачать

Электролитический ключ: изменение диффузионного потенциала при переносе из кислоты в щелочь не превышает ± 1 мВ
В лабораторных вспомогательных электродах ЭВЛ-М3.1, ЭВЛ-1М4, а также комбинированных лабораторных электродах ЭСКЛ-08М, ЭСКЛ-08М.1 электролитический ключ выполнен таким образом, что изменении диффузионного потенциала на ключе при переносе электрода из кислоты в щелочь (и наоборот) не превышает ± 1 мВ , что важно при проведении точных анализов.
Использование электродов с керамическими ключами при проведении анализов с использованием магнитной мешалки и потенциометрическом титровании также проблематично, так как наблюдается дрейф потенциала и невозможно определить конечную точку титрования.
При использовании электродов: вспомогательных ЭВЛ-1М3.1, ЭВЛ-1М4 и комбинированных электродов ЭСКЛ-08М, ЭСКЛ-08М.1 указанные дефекты не наблюдаются.
Если вытекающий из вспомогательных лабораторных электродов раствор КС l является мешающим (например, для измерения ионов Cl – ), то предприятие выпускает:
- специальный электролитический ключ 1Е5.184.412 для электрода ЭВЛ-1М3.1;
- электролитическую ячейку 1Е5.184.307 для электрода ЭВЛ-1М4.
Конструкция ключа (ячейки) практически исключает попадание в исследуемые растворы хлористого калия, вытекающего из вспомогательных электродов. Эти ключи (ячейки) очень просто отмыть от заливаемого в них раствора и можно использовать для многих вспомогательных электродов.
При таких измерениях в соответствии с рисунком 4 измерительный электрод (1) помещается в стакан (3) с анализируемым раствором (2) непосредственно, а вспомогательный электрод (4) — через электролитический ключ (ячейку) (5). Тип раствора, заливаемого при этом в электролитический ключ (ячейку) (5), определяется указаниями в паспортах на применяемые измерительные ионоселективные электроды или исследователем.
Рисунок 4. Проведение измерений в растворах, если вытекающий раствор К Cl является мешающим
- Измерительный электрод;
- Анализируемый раствор;
- Стакан;
- Вспомогательный электрод ЭВЛ-1М3.1 или ЭВЛ-1М4;
- Электролитический ключ 1Е5.184.412 для электрода ЭВЛ-1М3.1 или электролитическая ячейка 1Е5.184.307 для электрода ЭВЛ-1М4.
При проведении измерений необходимо соблюдать следующие условия:
- уровень раствора в электролитическом ключе (5) должен быть выше уровня анализируемого раствора (2) в стакане (3),
- уровень раствора KCl в электроде (4) должен быть выше уровня раствора в электролитическом ключе (5).
Серийно выпускаемые электроды можно использовать и для проведения измерений в пробах малого объема .
Для этого мы выпускаем специальные ячейки для микроизмерений (рисунок 5), которые входят в комплект поставки приборов таких приборов, как И-160.
Рисунок 5. Проведение измерений в пробах малого объема (микроизмерения)
- Вспомогательный электрод ЭВЛ-1М3.1 или ЭВЛ-1М4;
- Специальная крышка;
- Стакан;
- Измерительный электрод;
- Микродоза — анализируемый раствор;
- Электролитический ключ 5М5.129.001.
Они представляют собой стакан (3) с крышкой (2), в которой имеются отверстия для установки вспомогательного электрода (1), термометра или термокомпенсатора и электролитического ключа (6).
Электролитический ключ для микроизмерений (6) имеет форму цилиндра со сферическим дном, в нижней части которого имеется небольшое удлинение с впаянной нитью, обеспечивающей электрическую связь электролитического ключа со вспомогательным электродом.
В соответствии с рисунком 5 микродоза (анализируемый раствор) и рабочая часть измерительного электрода помещаются в полую часть ключа (6), а вспомогательный электрод погружается в стакан (3), заполненный насыщенным раствором KCl. Уровень раствора KCl в стакане (3) должен быть таким, чтобы обеспечивать надежный контакт с нитью электролитического ключа (6), а уровень анализируемого раствора в ключе (6) — выше уровня раствора КС l в стакане.
- Электроды соответствуют основополагающим стандартам по электродной продукции:
- Все электроды внесены в реестры средств измерений республики Беларусь и Российской Федерации, многие электроды внесены в реестры средств измерений Украины и Казахстана.
- Осущетслена большая работа по созданию и внедрению на предприятии системы высокоэффективных методов управления производством и получен Сертификат соответствия международным стандартам серии ИСО 9000.
Наличие собственных уникальных производств изготовления электродов, основанных на современных технологиях, процесс подготовки производства, выбора материалов, строжайшее соблюдение техпроцессов, отработанных в течение десятилетий, пооперационный контроль каждой операции при изготовлении электродов, тщательный подбор кадров позволяет изготавливать продукцию высокого качества.
Отлаженное производство как измерительных, так и вспомогательных электродов для потенциометрических измерений с технологией, отработанной и усовершенствованной в течение десятилетий
Практически все производители электродной продукции на территории Российской Федерации регулярно закупают различные модели электродов.
Видео:4 3 Электрохимический потенциалСкачать

Уравнение нернста для рн стеклянного электрода
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
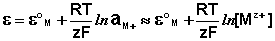
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
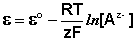
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
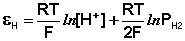
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
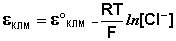
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
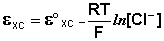
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
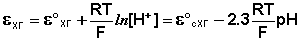
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
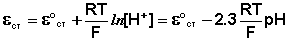
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
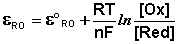
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
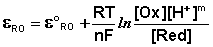
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
Видео:Уравнение Нернста #shortsbetaСкачать

ПРИНЦИП ИЗМЕРЕНИЯ рН С ПОМОЩЬЮ СТЕКЛЯННОГО ЭЛЕКТРОДА
Для измерения рН составляют ячейку из стеклянного (индикаторного) электрода и хлорсеребряного электрода сравнения. Потенциал стеклянного электрода зависит от концентрации иона водорода в испытуемом растворе в соответствии с уравнением Нернста:
Потенциал электрода сравнения представляет собой постоянную величину. Измеряемая ЭДС ячейки преобразуется на шкале прибора, называемого рН-метром или иономером, в виде значений рН.

1 – асбестовое волокно, обеспечивающее контакт с испытуемым раствором; 2 – внешний раствор KCl (нас.); 3 – крошечное отверстие для контакта; 4 – внутренний раствор KCl (нас.), AgCl (т); 5 – отверстие для ввода раствора KCl; 6 – стеклянная рН-чувствительная мембрана; 7– 0,1 М раствор HCl, насыщенный AgCl; 8– серебряная проволока; 9 – стеклянная трубка; 10– изоляция; 11– токоотвод
Настройка прибора с буферным раствором
Перед измерением прибор настраивают в соответствии с инструкцией. Настройку рН-метра проводят по трем буферным растворам с рН 4,01; 6,86; 9,18, приготовленным из стандарт-титров. Показания прибора отсчитывают не ранее, чем через 1,5 мин после погружения электродов в измеряемую среду, после прекращения дрейфа измерительного прибора.
Методика работы на приборе рН-121
1. Подключают рН-метр к сети 220 В. При этом загорается контрольная лампочка. Прибору дают прогреться в течение 25 минут.
2. Ручкой «ТЕМПЕРАТУРА РАСТВОРА» устанавливают по верхней шкале прибора температуру раствора, рН которого измеряют. Клавиша «0, t» при этом должна быть нажата.
3. Периодическую проверку рН-метра или иономера производят по одному или нескольким буферным растворам. Если используют один буферный раствор, то рекомендуется, чтобы его рН находился в том же диапазоне измерения, что и рН испытуемого раствора.
4. Индикаторный электрод перед каждым погружением в измеряемые растворы тщательно промывают дистиллированной водой и осторожно удаляют воду с его поверхности фильтровальной бумагой.
5. В стаканчик наливают соответствующий стандартный буферный раствор и опускают в него электрод.
6. Нажимают клавишу диапазона измерений, а затем клавишу «рН». Ручкой «КАЛИБРОВКА» устанавливают стрелку прибора на отметку, соответствующую значению рН буферного раствора при данной температуре.
7. Проверяют показания прибора по другим стандартным буферным растворам. Ошибки измерений не должны превышать 0,05 рН.
8. Для измерения рН испытуемого раствора (клавиша «0, t» нажата) электрод пометают в стаканчик с испытуемым раствором. Нажимают клавишу диапазона «-1 ÷ 14» и отмечают показание стрелки по нижней шкале. После нажатия клавиши на соответствующий диапазон измерений проводят более точный отсчет показаний по верхней шкале прибора.
9. По окончании работы при нажатом положении клавиши «0, t» прибор отключают от сети. Электрод осторожно промывают дистиллированной водой и оставляют погруженным в воду.
Приготовление водной вытяжки из почвы
Пробу на анализ из коробки отбирают шпателем или ложкой, предварительно перемешав почву на всю глубину коробки, Из пакетов почву высыпают на ровную поверхность, тщательно перемешивают и распределяют слоем толщиной не более 1 см. Пробу на анализ отбирают не менее, чем из пяти мест.
Пробы почвы массой 30 г, взвешенные с погрешностью не более 0,1 г, помещают в конические колбы. К пробам приливают дозатором или цилиндром по 150 мл дистиллированной воды. Почву с водой перемешивают в течение 3 мин на взбалтывателе и оставляют на 5 мин для отстаивания. Допускается пропорциональное изменение массы пробы почвы и дистиллированной воды при сохранении отношения между ними 1:5 и погрешности дозирования не более 2 %.
Часть почвенной суспензии объемом 15-20 см, сточной или природной воды сливают в химический стакан вместимостью 50 см 3 и используют для измерения рН. Показания прибора считывают так же, как при его настройке. Во время работы настройку прибора периодически проверяют по буферному раствору с рН 6,86.
Допускаемые относительные отклонения при доверительной вероятности Р = 0,95 от среднего арифметического результатов повторных анализаторов при выборочном статистическом контроле составляют 0,2 единицы рН.
Для измерения рН питьевой воды электроды помещают в стаканчик с образцом. Нажимают клавишу диапазона «-1 ÷ 14» и отмечают показание стрелки по нижней шкале. После нажатия клавиши на соответствующий диапазон измерений проводят более точный отсчет показаний по верхней шкале прибора.
Природная вода имеет щелочную реакцию среды, что обусловлено содержанием в ней анионов НСО3 — , СО3 2- , ОН — . Основным компонентом щелочности природных вод при рН 8,3 являются анионы НСО3 — , а при рН 8,3 компонентами общей щелочности, в зависимости от рН, анионы НСО3 — , СО3 2- , ОН. Потенциометрическому определению рН воды не мешают мутность, взвеси, присутствие свободного хлора, окислителей или восстановителей или же повышенное содержание солей в пробе.
ЛИТЕРАТУРА
1. Практическое руководство по физико-химическим методам анализа/ Под ред. И.П. Алимарина, В.И. Иванова. — М.: Изд-во Моск. ун-та,1987. — 208 с.
2. Почвы. Методы определения удельной проводимости, рН и плотного остатка водной вытяжки. ГОСТ 26423-85. -С.2, 4, 6. Введ. 01.01.85.
3. Методические указания к выполнению лабораторных работ по аналитической химии / Сост.: И.А. Шевчук, Т.Н. Симонова, Л.Я. Енальева и др. — Донецк: ДонГУ, 1988. — С. 28-31.
4. Методические указания к выполнению работ по электрохимическим методам анализа. Потенциометрическое титрование (для студентов дневной, и вечерней форм обучения) / Сост.: И.А. Шевчук, Л.Я. Енальева. — Донецк: ДонГУ, 1988. — С. 9-10.
🔥 Видео
Определение концентрации фторидов и нитратов с помощью ионо-селективного электродаСкачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Электроды и гальванические элементыСкачать

Физическая химия 2 Электрохимия — Лекция 14 — Селективные электроды. Классификация цепейСкачать