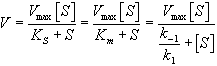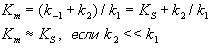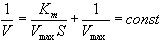Уравнения Михаэлиса-Ментен и Лайнуивера-Берка
Общую теорию ферментативной кинетики и зависимость активности фермента от субстрата.описали Л.Михаэлис и М.Л.Ментен, выразив его в своем уравнении. Бриггс и Холдейн усовершенствовали их уравнение, введя введя в него константу Михаэлиса (Km), определяемую экспериментально.
Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата. Так как пользоваться графиком, построенным в прямых координатах V и [S] для точных расчетов неудобно, то Г.Лайнуивер и Д.Бэрк преобразовали уравнение Бриггса–Холдейна в обратные координаты.
Уравнение Михаэлиса-Ментен
Уравнение Лайнуивера-Бэрка
На самом деле уравнение Михаэлиса-Ментен в данном виде предложили Бриггс и Холдейн, но в честь основоположников оно носит название Михаэлиса-Ментен.
Выделяют три основных решения уравнения Михаэлиса-Ментен:
1. Концентрация субстрата равна величине константы Михаэлиса ([S] = Km).
В этом случае, решая уравнение Михаэлиса-Ментен, получаем, что скорость реакции V будет равна половине максимальной Vmax.(V = ½ Vmax).
В математическом смысле Km соответствует концентрации субстрата при которой скорость реакции равна половине максимальной. Ее биологический смысл заключается в характеристике сродства фермента к субстрату, а именно: увеличение величины Кm означает снижение сродства фермента к субстрату.
2. Концентрация субстрата значительно больше Km ([S] >> Km). В этом случае величиной Km можно пренебречь, при решении получим, что скорость реакции максимальна (плато на графике).
3. Концентрация субстрата значительно меньше Km ([S]
Видео:USMLE Step 1 - Фармакология: кинетика ферментов | уравнение Михаелиса - Ментена и не толькоСкачать

Методы определения Км и Vmax
Константу Михаэлиса можно определить из графика Михаэлиса (рис.2.2.1), найдя графическим способом максимальную скорость и соответствующую величину концентрации субстрата, при которой скорость ферментативной реакции будет вдвое меньше Vmax. Эта величина [S] и будет Км. Таким способом можно определить только приблизительную величину константы Михаэлиса из-за трудности точного графического определения Vmax.
Более удобными являются методы, в которых осуществлена линеаризация уравнения Михаэлиса-Ментен, т. е. гиперболическая зависимость v от [S] переведена в линейную.
Для того чтобы построить такой график, необходимо определить в одинаковых условиях при различных концентрациях субстрата и [E]= const начальные скорости ферментативной реакции.
Метод Лайнуивера-Берка. Один из способов линеаризации уравнения Михаэлиса-Ментен предложили Лайнуивер и Берк (Lineweaver H., Burk D.). Это так называемый метод двойных обратных величин. Для линеаризации необходимо взять обратные величины от левой и правой частей уравнения (3), в результате чего оно преобразуется в уравнение вида,
согласно которому между величинами, обратными начальной скорости (1/v, v -1 ) и концентрации субстрата (1/[S], [S] -1 ) соблюдается линейная зависимость, если механизм реакции подчиняется изложенным выше представлениям (рис.2.2.3).
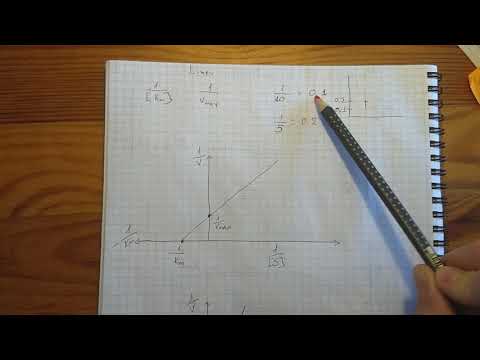
Рис. 2.2.3. График зависимости 1/v от 1/[S] (график Лайнуивера-Берка)
Экспериментальная прямая пересекает ось абсцисс в точке (-1/[S] = 1/Км), а ось ординат – в точке (1/v = 1/Vмах). Тангенс угла наклона равен Км/Vмах. Этим широко пользуются для определения параметров Км и Vмах, характеризующих связывающую и каталитическую функции ферментов.
Метод Хайнса-Вульфа. В этом случае преобразуется уравнение Лайнуивера-Берка путем умножения правой и левой частей на концентрацию субстрата.
Графическая зависимость приведена на рис.2.2.4.
Рис. 2.2.4. График зависимости [S]/v от [S] (график Хайнса-Вульфа)
Это прямая с наклоном 1/Vmax, отсекающая на осях [S]/v и [S] отрезки Км/ Vmax и – Км соответственно.
Метод Иди-Хофсти. При одном из таких графических преобразований в так называемом графике Иди-Хофсти(pиc.2.2.5) строят график зависимости v от v/[S]. В этом случае точка пересечения прямой, полученной путем наилучшей линейной аппроксимации экспериментальных точек, с осью ординат соответствует Vmax, а тангенс угла наклона равен – Km. Данный способ линеаризации приведен на рис. 2.2.5.
Рис. 2.2.5. График зависимости v от v/[S] (график Эди-Хофсти)
Метод Эйзенталя и Корниш-Боудена. Много позднее Эйзенталь и Корниш-Боуден предложили иной метод графического представления результатов исследования кинетики ферментативных реакций – так называемый прямой линейный график. Уравнение Михаэлиса-Ментен они преобразовали в виде зависимости Vmax от Км:
Для любой пары значений [S] и v можно построить зависимость Vmax от Км. Она представляет прямую с наклоном, равным v/[S], и отрезками, отсекаемыми на осях Км и Vmax, соответственно равными -[S] v. Если провести прямые для нескольких пар значений [S] и v, то эти прямые пересекутся в одной точке, координаты которой дадут единственные значения Vmax от Км, удовлетворяющие всем парам значений [S] и v (рис.2.2.6).
Преимущества такого графика очевидно: для его построения не требуется никаких расчетов, он позволяет очень просто выявить ошибочные данные (иакие прямые будут выпадать из основной совокупности прямых).
Уравнение Михаэлиса лежит в основе всех кинетических исследований ферментативных реакций, так как оно позволяет рассчитать количественные характеристики ферментов и проводить анализ их ингибирования. Величины Кm и Vmax являются важнейшими характеристиками ферментов и их можно определить, используя линеаризованные формы уравнения Михаэлиса-Ментен.
В заключении необходимо отметить, что графические методы для определения V и Кm не являются оптимальными. В настоящее время данные ферментативной кинетики обрабатывают быстрее и более объективно с помощью компьютерных программ.
Процессы, приводящие к денатурации фермента, могут иметь различную физико-химическую природу. Конформация белковой молекулы в растворе зависит от двух показателей – величины рН и температуры. Повышение температуры приводит к нарушению системы слабых связей, стабилизирующих белковую молекулу. Длительное воздействие повышенной температуры приводит к необратимым изменениям структуры фермента, сопровождающимся потерей активности (тепловая денатурация).
Каждый фермент характеризуется соответствующим зарядом, создаваемым ионогенными группами аминокислотных остатков. При очень низких или высоких значениях рН изменение степени ионизации функциональных групп может приводить к необратимым нарушениям нативной конформации молекулы фермента с разрушением структуры активного центра.
Конформационные изменения в белковой молекулу сопровождаются изменениями спектров поглощения и флуоресценции ароматических аминокислот – тирозина и триптофана в ультрафиолетовой области спектра (
290 нм), что позволяет отслеживать изменения в структуре фермента. Обратимые конформационные, вызванные изменением температуры или концентрацией протонов водорода, осуществляются в течение 10 -4 – 10 -1 с, необратимые денатурационные изменения в зависимости от условий – в течение 1-10 3 мин. Более подробный анализ кинетики денатурации ферментов рассмотрен в Теме 5 учебного пособия по самостоятельной работе.
Видео:Биохимия | Кинетика ферментативных реакций: константа Михаэлиса и график Лайнуивера-БеркаСкачать

Уравнение лайнуивера берка и его графическое выражение
МЕХАНИЗМ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
| | Три стадии процесса: 1) E + S —— ES (K = k1/k-1) (БЫСТРАЯ) 2) ES —— EP (k2)(медленная) 3) EP —- E + P Таким образом, в момент равновесия скорости образования и исчезновения энзимсубстратного комплекса (ES) равны: E + S —- ES —— EP — E + P |
ВЛИЯНИЕ НА НАЧАЛЬНУЮ СКОРОСТЬ РЕАКЦИИ КОНЦЕНТРАЦИЙ ФЕРМЕНТА [E] и СУБСТРАТА [S].
| | [E]- ЗАВ-ТЬ ЛИНЕЙНАЯ, [S]- ЗАВ-ТЬ ГИПЕРБОЛИЧЕСКАЯ. (Это значит, что при малых S- порядок первый, далее переходит в нулевой). Пунктиром на графике зависимости скорости от концентрации фермента показано влияние ферментных ядов (ингибиторов), проявляющееся в медленном нарастании скорости реакции до момента, пока не будет преодолено влияние яда повышением количества энзима. |
УРАВНЕНИЕ МИХАЭЛИСА — МЕНТЕН
При формулировке кинетического выражения для скорости ферментативной реакции Бриггс и Холдейн (Briggs & Haldane, 1925) сделали три допущения:
1) Стационарное состояние реакции в момент равновесия, когда скорости образования и расходования ES равны;
2) Весь фермент в условиях насыщающих концентраций субстрата превращается в энзимсубстратный комплекс ES;
3) Если весь фермент в виде ES, то скорость реакции максимальна и Vmax=k2[ES].
Образование ES: [ES]=k1[S][E] (I)
Расходование ES: [ES]=k-1[ES]+k2[ES] (II)
Приравнивая выражения (I) и (II) и сокращая обе части на k1 получаем:
[S][E] = [ES](k-1 + k2)/k1 = [ES]Km, где Km = (k-1 + k2)/k1
Выразим равновесную концентрацию [E] через начальную [Eo]: [E] = [Eo] — [ES]
[S]([Eo]-[ES])= [ES]Km, переносим [S] в правую часть выражения и делим обе части на [ES]:
[Eo]/[ES]=Km/[S]+1= (Km+[S])/[S] (III)
Поскольку трудно (если не невозможно) измерить [ES], произведем замену с учетом того, что в насыщающих концентрациях [S] весь [Eo] перейдет в [ES] и максимальная скорость при этом будет равна Vmax=k2[ES]=k2[Eo].
В это же время скорость реакции равна V=k2[ES]. Через отношение этих скоростей выразим [Eo]/[ES]:
V/Vmax= [ES]/[Eo]
В уравнении (III) произведем замену отношения [Eo]/[ES] на Vmax/V и получаем:
V = Vmax[S]/(Km+[S])
Это и есть уравнение Михаэлиса-Ментен. Название было закреплено за ними, несмотря на то, что Леонор Михаэлис и Мод Ментен только постулировали положение о том, что фермент обратимо связывается с субстратом (1913). Основу ферментативной кинетики положил Виктор Генри в 1903 году, впервые предположивший зависимость между концентрациями субстрата и фермента в ферментативных реакциях.
Графическая зависимость для уравнения имеет вид:
| Константа Михаэлиса измеряется в молях на литр и бывает от 10 -2 до 10 -7 , чем меньше Кm, тем активнее фермент. При V=1/2Vmax, имеем Km = [S]. Однако, определение Vmax затруднительно по асимптоте. Для устранения этого неудобства ХАНС ЛАЙНУИВЕР и ДИН БЭРК приравняли обратные зависимости левой и правой частей уравнения. |
Графическое выражение для скорости реакции в координатах Лайнуивера-Бэрка имеет вид прямой линии, отсекающей на оси Х значение -1/Km, а на оси Y- значение 1/V max:
ВЛИЯНИЕ ТЕМПЕРАТУРЫ И рН НА АКТИВНОСТЬ ФЕРМЕНТА
В общем, для ферментов имеется связь константы скорости и температуры, выражаемая: 2,3 lgK = B- Ea/RT, где Еа- энергия активации, В-частота столкновений.
Однако, указанная зависимость прямолинейна лишь на ограниченном отрезке, так как с ростом температуры наблюдается денатурация фермента.
Зависимость активности фермента от рН также проходит через максимум. Кислотность среды влияет на заряды в молекуле фермента и, тем самым, на его способность к связыванию субстрата.
Единицы активности:
Е (станд. ед) — количество Ф., которое превращает 1 мкМоль субстрата за 1 мин.
КАТАЛ- кол-во Ф., превращающее субстрат со скоростью 1 Моль/сек.
1 КАТАЛ = 60 000 000 Е.
2) НЕОБРАТИМЫЕ (КАК ПРАВИЛО- НЕПРИРОДНОГО ПРОИСХОЖДЕНИЯ — NaF (ингибитор фосфатаз), п-хлормеркурибензоат (связывает группировки -SH), диизопропилфторфосфат (протеиназ и эстераз)- эти ингибиторы действуют необратимо.
ОБРАТИМЫЕ ИНГИБИТОРЫ- клеточные метаболиты и типы ингибирования
а) КОНКУРЕНТНОЕ ингибирование
б) НЕКОНКУРЕНТНОЕ ингибирование
в) БЕСКОНКУРЕНТНОЕ ингибирование
а) КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ- когда за активный центр фермента вместе с субстратом конкурирует ИНГИБИТОР:
Е + I = EI Ki = [E][I] / [EI], чем меньше Ki, тем сильнее ингибитор.
| | Так, малоновая (1), щавелевоуксусная (2) и глутаровая (3) кислоты ингибируют фермент СУКЦИНАТДЕГИДРОГЕНАЗУ, субстратом которой является янтарная кислота (4) (СУКЦИНАТ), так как они сходны по строению с субстратом: |
| | Другой пример. Сульфаниламидные антибактериальные препараты имеют сходное строение с парааминобензойной кислотой и являются конкурентными ингибиторами в синтезе бактериями фолиевой кислоты (фактора роста бактерий). У человека нет такого метаболического пути и в лечебных дозах они не влияют на жизнедеятельность человека, оказывая общий БАКТЕРИОСТАТИЧЕСКИЙ эффект (нарушая в некоторой степени деятельность кишечной микрофлоры): |
2) НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ПРОЯВЛЯЕТСЯ ПРИ СВЯЗЫВАНИИ ИНГИБИТОРА С ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но при этом меняется структура активного центра и связь с субстратом становится невозможной.
E + I —> EI , EI + S —-> (невозможно)
3) БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ — результат присоединения ингибитора ТОЛЬКО ПОСЛЕ образования ЭНЗИМСУБСТРАТНОГО КОМПЛЕКСА:
E + S = ES ES + I = ESI
ОПРЕДЕЛЕНИЕ ТИПА ИНГИБИРОВАНИЯ
1) КОНКУРЕНТНЫЙ ИНГИБИТОР увеличивает Кm и не изменяет V max.
2) НЕКОНКУРЕНТНЫЙ ингибитор не изменяет Кm и снижает V max.
3) БЕСКОНКУРЕНТНЫЙ ингибитор в одинаковой степени снижает Кm и V max:
Некоторые продукты ферментативных реакций также выступают в роли ингибиторов. Так, глюкоза ингибирует фермент Г-6-фосфатазу:
Глюкозо-6-фосфат + Н 2 О — Глюкоза + Н 3 РО 4
Ингибирование избытком субстрата наблюдается в ряде случаев в результате блокирования активного центра по схеме:
1) ПУТЕМ ЗАЩИТЫ Ф. ОТ ИНАКТИВИР. ВЛИЯНИЙ
2) ПУТЕМ ВОЗДЕЙСТВИЯ НА СУБЪЕДИНИЦЫ БЕЛКОВ Ф.
Ферменты-протеинкиназы имеют 4-ную структуру, состоят их 2-х субъед- каталитической и регуляторной. Активатор воздействует на регуляторную, а в результате обнажается каталитическая субъединица:
Аллостерическими эффекторами называют ингибиторы (отрицательные эффекторы) и активаторы (положительные эффекторы) энзимов, регулирующие активность ферментов в широких пределах, не затрагивая при этом активного центра, поскольку воздействуют на него опосредованно, присоединясь к молекуле фермента ВНЕ активного центра. Они способны управлять конформацией активного центра таким образом, что присоединение субстрата либо облегчается значительно, либо вовсе становится невозможным:
1) Структура аллостерических эффекторов отлична от природного субстрата фермента.
2) Высокоспецифичны
3) Катализируют фермент первой цепи процесса.
Среди аллостерических эффекторов различают эффекторы V-типа, которые подобно неконкурентным ингибиторам (см. выше) изменяют значение Vmax:
и эффекторы К-типа, изменяющие значение Km, как это свойственно конкурентным ингибиторам:
Для ферментов с аллостерической регуляцией, а также и для ферментов с четвертичной структурой, состоящих из нескольких субединиц, характерны сигмоидальные (S-образные) кинетические кривые.
КООПЕРАТИВНЫЙ ЭФФЕКТ
Характерен для ферментов, имеющих 2 и более субъединиц. Присоединение субстрата или эффектора к одной из субъединиц облегчает последующие присоединения к оставшимся субъединицам. Типичный пример кооперативного эффекта- перенос кислорода молекулами гемоглобина.
ПРОФЕРМЕНТЫ
Неактивная форма Ф. Активация осуществляется удалением части полипептидной цепи, обнажению активного центра, при помощи специфических ферментов. Биологический смысл- в месте продукции Ф. мог бы вызвать нежелательные последствия (переваривание и т.д.).
ИЗОФЕРМЕНТЫ
отличные по структуре, но выполняющие одну и ту же функцию. Изоферментами, в частности, существуют алкогольдегидрогеназа и целых 5 изомеров лактатдегидрогеназы. Изоферменты могут различаться по каталитической активности, несмотря на то, что катализируют одну и ту же реакцию. Так, в клетках печени человека различаются цитоплазматическая ацетальдегиддегидрогеназа (низкоактивная, с высоким значением Km) и митохондриальная ацетальдегиддегидрогеназа (AcDH), с малым значением Km. Последнее обстоятельство является биохимической причиной непереносимости алкоголя у коренного населения Юго-Восточной Азии, которое связано с практическим отсутствием у них (по генетическим причинам) митохондриальной AcDH и превращение образовавшегося из этанола ацетальдегида осуществляется у них малоактивной цитоплазматической AcDH.
ПРИМЕНЕНИЕ ФЕРМЕНТОВ В ДИАГНОСТИКЕ И ДРУГИХ ОБЛАСТЯХ
Ферментные препараты и регуляторы их активности находят все более широкое применение в различных областях медицины, промышленности и науки.
В медицине используются энизимы, как терапевтические средства:
— СТРЕПТОКИНАЗА- смесь энзимов из семейства Streptococcus, активизирующих ПЛАЗМИНОГЕН и образование ПЛАЗМИНА, приводящее к растворению ФИБРОЗНЫХ ТРОМБОВ в кровеносных сосудах. Рекомбинантный тканевый активатор плазминогена rh-tPA производится генно-инженерным способом на E.Coli и вводится человеку.
— АСПАРАГИНАЗА используется в терапии ЛЕЙКЕМИИ взрослых. Опухолевые клетки нуждаются в АСПАРАГИНЕ, который они извлекают из плазмы крови. Внутривенное введение (i.v.) аспарагиназы снижает содержание аспарагина и замедляет рост раковых клеток. К сожалению, достижение высоких терапевтических доз таким способом невозможно.
ЭНЗИМЫ, КАК ДИАГНОСТИЧЕСКИЕ ПОКАЗАТЕЛИ
| |