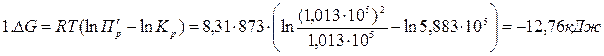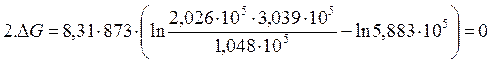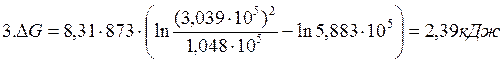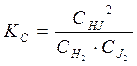Гетерогенные реакции – реакции, в которых компоненты находятся в разных фазах.
Для гетерогенных реакций константа равновесия (Кр) определяется толь через парциальные давления газообразных веществ и не зависит от количества твердых и жидких веществ.
Например, для реакции CaCO3(тв)=CaO(тв)+СО2(г) константа равновесия запишется в виде: 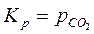
Расчет химического равновесия. Термическая диссоциация
Процесс подготовки расплавов связан с применением технологий рафинирования жидкого металла. При этом очень часто в качестве газов окислителей примесей используют молекулярный хлор и водяной пар. Взаимодействие с примесями вышеназванных газов происходит по реакции: 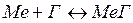
При этом примеси в виде солей металла или оксида, в зависимости от применяемого газа-окислителя, переходят в шлак или газовую фазу. Важной характеристикой эффективности применения газов является их термическая диссоциация.
Термическая диссоциация – разложение вещества под действием температуры. Количественно термическая диссоциация характеризуется степенью диссоциации (α), которая представляет собой отношение числа распавшихся молекул к числу молекул до распада( 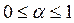
В ходе термической диссоциации происходит увеличение числа частиц. Отношение общего числа частиц после диссоциации к числу молекул до диссоциации называется коэффициентом диссоциации (i). Степень диссоциации связана с коэффициентом диссоциации уравнением:
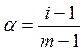
где m – коэффициент, показывающий, во сколько раз увеличивается число частиц в процессе термической диссоциации.

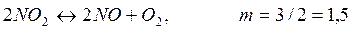
Пример 2.1. При 390ºС и и 1,013·10 5 Па 0,0157 моль NO2 занимают объем 0,001 м 3 , причем NO2 частично диссоциирует на NO и О2 по реакции: 2NO2+O2=2NO3. Рассчитайте Кр и КС этой реакции.
Решение:
1. Для вычисления коэффициента термической диссоциации воспользуемся уравнением: 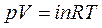
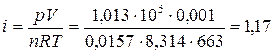
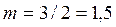
2. Рассчитаем степень термической диссоциации:
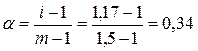
3. Согласно уравнению реакции:
| 2NO | O2 | 2NO2 | |
| состав исходной смеси | n | ||
| состав равновесной смеси | 2nα | nα | 2n(1-α) |
Сумма моль всех компонентов в смеси:
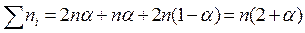
Парциальные давления компонентов в момент равновесия равны:
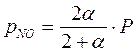
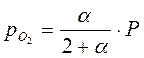
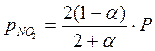
4. Константа равновесия реакции Кр равна:
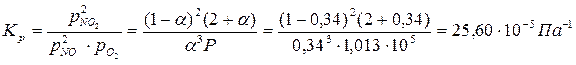
5. Рассчитаем КС по уравнению (2.8): 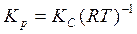
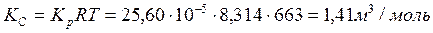
Пример 2.2. Определите Кр для реакции: 2SO2+O2=2SO3, если при 1000К и 1,013·10 5 Па из исходной смеси, содержащей 1 моль SO2 и 0,6 моль O2, при достижении равновесия образовалось 0,22 моль SO3.
Решение:
Согласно уравнению реакции, на образование 0,22 моль SO3 израсходовано 0,22 моль SO2 и 0,22/2=0,11 моль O2.
| 2SO2 | O2 | 2SO3 | |
| состав исходной смеси | 0,6 | ||
| состав равновесной смеси | 1-0,22=0,78 | 0,6-0,11=0,49 | 0,22 |
Сумма моль всех компонентов в смеси:
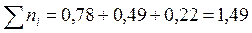
Парциальные давления компонентов в момент равновесия равны:
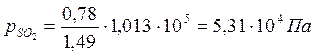
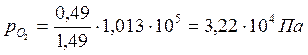
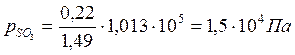
Константа равновесия реакции Кр равна:
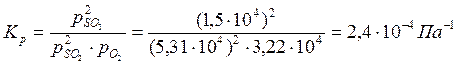
Пример 2.3. Степень диссоциации фосгена по реакции 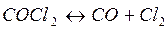
| Вариант | 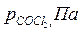 | 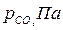 | 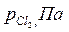 |
| 1,013·10 5 | 1,013·10 5 | 1,013·10 5 | |
| 1,048·10 5 | 2,026·10 5 | 3,039·10 5 | |
| 1,048·10 5 | 3,039·10 5 | 3,039·10 5 |
Решение:
1.Определяем константу равновесия реакции:
| СOCl2 | CO | CO2 | |
| состав равновесной смеси | n (1 – α) | nα | nα |
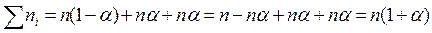
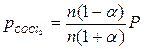
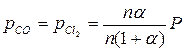
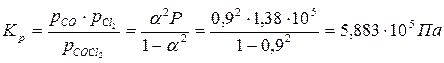
2. Направление процесса определяем по уравнению изотермы химической реакции (2.2):
Следовательно, в первом случае процесс возможен в прямом направлении; во втором случае система находится в состоянии равновесия; в третьем случае процесс диссоциации фосгена не возможен, но возможен обратный процесс образования фосгена из оксидов.
Пример 2.4. Вычислите константу равновесия для процесса выплавки углеродистой стали 20Л при температуре 1610ºС если температурная зависимость энергии Гиббса имеет вид 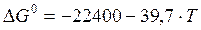
Решение:
Стандартная энергия Гиббса реакции связана с константой равновесия 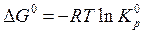
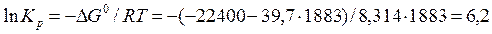
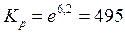
Вопросы для самоконтроля
1. Перечислите основные признаки химического равновесия.
2. Каким образом можно определить направление процесса по изотерме химической реакции.
3. Приведите различные способы выражения константы равновесия. Каким образом они связаны между собой?
4. Каким образом давление и температура оказывает влияние на химическое равновесие. Приведите примеры.
5. Каким образом рассчитывают химическое равновесие?
ФАЗОВОЕ РАВНОВЕСИЕ
Основные понятия и определения
Фазовые равновесия – равновесия в гетерогенных системах, в которых не происходит химического взаимодействия, а имеет место лишь переход компонентов из одной фазы в другую или другие.
Фаза – гомогенная часть гетерогенной системы, находящаяся в одном и том же агрегатном (и модификационном) состоянии, обладающая одинаковыми свойствами и имеющая четкую границу раздела, при переходе через которую свойства системы меняются скачком.
Независимые компоненты – составляющие вещества, наименьшее число которых необходимо для однозначного выражения состава каждой фазы при любых условиях существования системы.
Если в системе нет химического взаимодействия между компонентами, то число независимых компонентов равно общему числу компонентов системы. Так для смеси, состоящей из газообразных водорода, гелия и аргона между которыми нет химического взаимодействия, число независимых компонентов равно числу составляющих веществ, то есть трем.
При наличии химического взаимодействия между компонентами в системе число независимых компонентов системы равно общему числу компонентов минус число уравнений, связывающих равновесные концентрации компонентов:
В смеси трех газов HJ, H2 и J2 (гомогенная однофазная система) возможна реакция 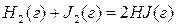
Поэтому, зная концентрации двух составляющих веществ, (например HJ и Н2), можно определить концентрацию третьего (J2). Следовательно, для данного случая число независимых компонентов равно двум: К=3-1=2. Если концентрации водорода и йода в равновесной смеси одинаковы ( 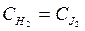
Число степеней свободы (вариантность системы) –число независимых переменных (температура, давление, концентрация), которые можно изменять в некоторых пределах так, чтобы число и природа фаз оставались прежними.
Если число степеней свободы равно нулю (инвариантная система), то нельзя изменять внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызывало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах только одного из перечисленных параметров, и это не вызовет уменьшения или увеличения числа фаз.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Химическое равновесие
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Особенности кинетики гетерогенных реакций
Особенности кинетики гетерогенных реакций.
Химические реакции, протекающие на границе раздела фаз, называют гетерогенными. Гетерогенные процессы широко распространены в природе и часто используются на практике. Примерами могут служить процессы растворения, кристаллизации, испарения, горение твердого топлива, окисления металлов, реакции, идущие на поверхности твердых катализаторов.
Примерами некоторых типов гетерогенных реакций служат:
1) реакции окисления металлов (Т1 + Г = Т2)
2) реакция разложения карбоната кальция (T1= T2 + Г)
3) реакции с участием трех твердых фаз ( Т1 + Т2 = Т3)
В гетерогенных реакциях можно выделить по меньшей мере три стадии: 1 – перенос реагирующих веществ к поверхности раздела фаз, т.е. в реакционную зону;
2 – собственно химическое взаимодействие;
3 – перенос продуктов реакции из реакционной зоны.
М.б. и другие стадии, например, адсорбция и десорбция; комплексооборазование и т.д.
Скорость процесса определяется лимитирующей (наиболее медленной) стадией. Если скорость собственно химического взаимодействия значительно больше скорости подвода реагентов к реакционной зоне и отвода продуктов от нее, то общая скорость процесса будет соответствовать скорости переноса реагентов и продуктов, она будет определяться процессами диффузии веществ.
Диффузия – это направленное перемещение вещества из области с большей концентрацией в область с меньшей концентрацией.
Предположим, что при низкой температуре лимитирующей стадией гетерогенного процесса является химическая реакция (кинетическая область). При повышении температуры константа скорости химической реакции быстро увеличивается, и начиная с некоторой температуры, когда скорость реакции станет больше скорости диффузии, лимитирующей стадией становится процесс диффузии (диффузионная область). Происходит переход из кинетической области гетерогенного процесса в диффузионную.
Зависимость логарифма скорости от температуры:
В промежуточной области ВС гетерогенная реакция контролируется как диффузией, так и химической реакцией на границе раздела фаз.
Скорость гетерогенной химической реакции измеряется изменением поверхностной концентрации одного из веществ (газа или жидкости), участвующих в реакции, за единицу времени
Концентрации веществ в твердом состоянии постоянны, поэтому в кинетическое уравнение реакций они не входят. Например, в реакции
CaCO3(т) = CaO(т) + CO2(г)
соударения меду молекулами СО2 могут происходить только на поверхности раздела фаз. В этом случае в выражение скорости реакции, согласно основному закону химической кинетики, в выражение скорости реакции будет входить только поверхностная концентрация СО2:
По этой ссылке вы найдёте полный курс лекций по математике:
ВОПРОС 7. Гетерогенные равновесия. Правило фаз.
При изучении различных систем важную роль играет понятие фазы. Как мы уже с вами говорили, фаза – это совокупность всех однородных частей системы, обладающих одинаковыми химическими свойствами и отделенная от остальных частей системы поверхностью.
На границе между двумя фазами всегда существует некоторая поверхность раздела, при переходе через которую многие свойства системы испытывают резкие скачкообразные изменения
Гетерогенные равновесия в процессах перехода вещества из одной фазы в другую, не сопровождающиеся изменением химического состава этого вещества, называются фазовыми равновесиями.
К таким равновесиям можно отнести состояния системы:
испарение конденсация; плавление кристаллизация;
сублимация кристаллизация и др.
Общим законом гетерогенных равновесий является правило фаз: в равновесной системе число фаз Ф, число степеней свободы С и число концентраций независимых компонентов К связаны простым соотношением С + Ф = К + n или С = К + n – Ф,
где n – число условий (температура среды, внешнее давление, магнитное поле, гравитационное поле и т.д.), которые могут влиять на равновесие в гетерогенной системе.
При исследовании гетерогенных равновесий в основном используют влияние на системы температуры среды и внешнего давления, тогда соотношение преобразуется в уравнение:
Для конденсированных систем, в которых практически отсутствует газовая фаза (например, в системе металл расплав, давление паров металла очень мало, им можно пренебречь и внешнее давление будет величиной постоянной), соотношение примет вид:
Компонентом называется химически однородная составная часть, которая после выделения из системы, может существовать в изолированном состоянии продолжительное время.
В трехфазной системе лед пар всего один компонент – Н2О.
В насыщенном водном растворе хлорида натрия (трехфазная система – кристаллический NaCl, насыщенный раствор NaCl, водяной пар) – два компонента: Н2О и NaCl. Ионы Na+ и Cl- компонентами не являются, т.к. не могут существовать в изолированном состоянии после их выделения из системы.
Возможно вам будут полезны данные страницы:
Компоненты подразделяются на независимые и зависимые. Концентрацию независимых компонентов можно задавать произвольно, концентрации зависимых компонентов определяются уравнениями реакций, протекающих в системе.
В системах, составные части которых реагируют друг с другом (химические системы), число независимых компонентов равно числу составных частей минус число обратимых реакций, протекающих в данной системе.
Система CaCO3 CaO + CO2 состоит из трех фаз (две твердые и одна газообразная), содержит три составные части и одну обратимую реакцию, число независимых компонентов будет:
3 (составные части) – 1 (обратимая реакция) = 2.
Следовательно, числа молей двух веществ можно изменять произвольно, концентрация третьего вещества — величина зависимая и определяется из уравнения реакции.
В физических системах, составные части которых не реагируют друг с другом, число независимых компонентов К равно числу составных частей системы. Например, в воздухе (смеси N2, O2, H2 и других газов) число независимых компонентов равно числу составляющих его газов.
Системы с одним независимым компонентом (К=1) называются однокомпонентными, с двумя независимыми компонентами (К=2) – двухкомпонентными и т.д.
| Количество концентраций независимых |
компонентов и условий, влияющих на равновесие в системе, которые можно произвольно увеличивать или уменьшать без изменения числа и вида фаз (без нарушения гетерогенного равновесия), составляет число степеней свободы С данной системы и рассчитывается по уравнению фаз.
Число степеней свободы определяет вариантность системы.
Системы без степеней свободы (С=0) называются безвариантными (инвариантными), системы с одной степенью свободы (С=1) – одновариантными (моновариантными), системы с двумя степенями свободы (с=2) – двухвариантными или бивариантными и т.д.
Например, охарактеризовать систему: FeO(k) + C(кокс) = Fe(k)+CO(г)
и определить ее вариантность.
1. Система химическая, равновесная.
2. Система гетерогенная
3. Число составных частей (компонентов) равно 4: FeO, C, Fe, CO. Каждое вещество можно выделить из системы и в изолированном виде оно может существовать сколько угодно долго.
4. Систему составляют 4 фазы: три твердых и одна газовая (Ф=4).
5. Число независимых компонентов равно 3 (4 составные части – 1 химическая реакция).
6. По уравнению определяем число степеней свободы:
С = К + 2 – ф = 3 + 2 – 4 = 1, т.е. система одновариантна. Следовательно, из всех условий, которые влияют на равновесие в системе, произвольно изменять можно только одно (температуру или давление).
Схематическая Р-t диаграмма воды, показывающая условия существования различных фаз.
При изучении фазовых равновесий широко применяется графический метод, при этом на основании опытных данных строят диаграммы состояния. Диаграмма состояния м.б. построена для любого вещества. Она позволяет определить условия, при которых будут устойчивы данная фаза или равновесие фаз. Рассмотрим диаграмму состояния воды, отвечающую трехфазной системе лед пар, в которой один компонент – вода (к=1). ханизм действия.
Электрохимическая защита эффективна в коррозионных средах с хорошей электрической проводимостью и основана на снижении скорости коррозии торможением анодных или катодных реакций путем поляризации (изменения потенциала) защищаемой конструкции (катода или анода) постоянным током.
В зависимости от вида поляризации различают катодную и анодную защиты.
Катодную поляризацию, а следовательно, и катодную защиту осуществляют двумя способами:
1) подключением защищаемой конструкции к отрицательному полюсу внешнего источника постоянного тока. Соответствующую разновидность катодной защиты называют защитой внешним (наложенным) потенциалом (рис.1).
2) Присоединением к защищаемой конструкции электрода («жертвенного» анода, или протектора), изготовленного из металла, имеющего меньший электродный потенциал, чем потенциал защищаемой конструкции. Разновидность катодной защиты в этом случае называют протекторной (гальванической) защитой, или защитой «жертвенным» анодом (рис.2).
Анодную защиту осуществляют присоединением защищаемой конструкции к положительному полюсу внешнего источника постоянного тока, а вспомогательного электрода — к отрицательному, при этом конструкция — анод, а электрод — катод. Анодная защита в отличие от катодной применима только к легкопассивируемым металлам.
Каждой фазе (трехфазной системы) отвечает определенное поле диаграммы, отделенное от полей других фаз линией.
На поле каждой фазы выберем по точке (1,2,3), которые характеризуют состояние фаз в данных условиях, и рассчитаем для этих состояний числа степеней свободы: С = К + 2 – Ф = 1 + 2 – 1 = 2. Это значит, что в каждом из этих состояний системы дивариантны. Он имеют две степени свободы: можно произвольно и независимо друг от друга изменять до определенного предела без нарушения фазового равновесия (без изменения числа и вида фаз) два условия. Например, для воды в состоянии 2 можно произвольно увеличивать или уменьшать Р и t до граничных линий, по достижении которых состояние фаз (фазового равновесия) нарушается (появляются новые фазы – лед и пар).
Граничные линии между полями на диаграмме характеризуют равновесие между двумя соседними фазами. Кривая ОА отвечает равновесию в системе вода пар, кривая ОВ – равновесию в системе лед вода, то есть каждая кривая соответствует двухфазной системе. Для каждого равновесия выберем по состоянию на диаграмме, обозначим эти состояния точками (I, II, III) и рассчитаем для каждого из них число степеней свободы: С = 1 + 2 – 2 = 1. Это значит, что все три системы в выбранных состояниях моновариантны (имеют по одной степени свободы), для них можно произвольно изменять только одно условие: температуру или давление. Например, для состояния II будем повышать температуру, оставив неизменным давление, то сразу же исчезнет жидкая фаза (фазовое равновесие нарушится). Чтобы это равновесие не нарушалось, вместе с ростом температуры должно повышаться давление и положение равновесия на диаграмме (точка II) сместится вверх по кривой ОС. В этом случае температура будет степенью свободы, а давление окажется зависимым от нее условием, т.е. не будет степенью свободы. Если произвольно менять давление, то температура станет зависимым условием.
В точке О пересекаются все три кривые. Эта точка отвечает равновесию между тремя фазами системы лед пар и называется тройной
точкой. Число степеней свободы системы в этом состоянии будет
С = 1 + 2 –3 = 0, т.е. система безвариантна, ни одно из ее условий менять нельзя. Стоит произвольно изменить хотя бы одно из условий — сразу же нарушится вазовое равновесие (исчезнут сразу две фазы). При одновременном изменении температуры и давления исчезнет одна фаза. Равновесие в этой системе возможно при определенных условиях:
Р= 610,5 Па, t = 0, 0099 0С.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🎥 Видео
Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Скорость химических реакций. 9 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Гетерогенное равновесиеСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Химия - решение типовых задач по теме "Химическая кинетика и химическое равновесие"Скачать

Задача на Константу равновесия (Кр) с дискриминантом. Химия. Олимпиада + ВУЗСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Скорость реакции. Химия – ПростоСкачать

Кинетика | Основные понятия | Олимпиадные задачи по химииСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Кинетика и равновесиеСкачать

Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих.Скачать

Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Задание 34 Варианты 4 (5, 6) Группа геометрических телСкачать

Уравнения и графики механических гармонических колебаний. Практ. часть - решение задачи. 11 класс.Скачать