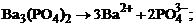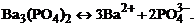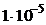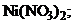Преобладание того или иного процесса определяется общей константой совмещенного равновесия, которая равна отношению произведения констант диссоциативного типа (т. е. ПР, К ионизации, К нестойкости комплекса) веществ, стоящих в левой части уравнения, к произведению констант диссоциативного типа веществ, стоящих в правой части уравнения. При наличии стехиометрических коэффициентов, константы возводятся в степени, равные этим коэффициентам. Константа равновесия (см.раздел 3.2.) показывает степень превращения исходных веществ в продукты. Если в состоянии равновесия преобладают продукты, константа равновесия имеет значение больше 1 Кравн> 1, равновесие смещено вправо, в сторону прямой реакции.И наоборот, если в состоянии равновесия преобладают исходные вещества, константа равновесия имеет значение меньше 1 Kравн 0 , находящихся в диапазоне от -30кДж/моль до 30кДж/моль при изменении концентрации возможно изменение знака ΔG 0 с минуса на плюс и наоборот. Такие реакции являются обратимыми. Им соответствуют значения Кравн, находящиеся в диапазоне от 10 –5 до 10 5 . Значения констант, выходящие за пределы этого диапазона, соответствуют практически необратимым реакциям. Реакции с Кравн> 1·10 5 , протекают только в прямом направлении, а реакции с Kравн –5 идут только в обратном направлении.
Примеры однотипных конкурирующих равновесий: Растворение осадка с образованием другого осадка
Запишем молекулярное уравнение реакции
Запишем полное ионное уравнение
PbCI2(к) + 2К + +2I — ⇄PbI2(к) + 2К + + 2Cl —
Запишем сокращенное ионное уравнение
Исходя из определения константы совмещенного равновесия, можно сразу записать, чему будет она будет равна. Это будет отношение ПР осадка в левой части уравнения к ПР осадка в правой части уравнения.
Для того, чтобы вывести константу совмещенного равновесия запишем константу равновесия данной реакции по закону действующих масс (в числителе стоят равновесные концентрации продуктов, в знаменателе равновесные концентрации исходных веществ, возведенные в степень стехиометрических коэффициентов, см. раздел 3.2.). Концентрация твердых веществ считается величиной постоянной и в константу равновесия не пишется. Пишем только концентрации ионов.
Кравн =[Cl — ] 2 /[I — ] 2 . Далее домножим и поделим на концентрацию конкурирующего иона [Pb 2+ ]
Кравн= [Pb 2+ ][Cl — ] 2 /[Pb 2+ ][I — ] 2 . В числителе и знаменателе получились ПР для солей соответственно из левой и правой частей уравнения (1)
Кравн> 1, близкак 1·10 5 , осадок PbCI2раствориться при добавлении избытка раствора KI.Происходит конкуренция за общий ион Pb 2+ . «Выигрывает» тот малорастворимый электролит, который имеет меньшее значение ПР.
Присутствие в биологических жидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых электролитов. В общем случае катион М + может образовывать два малорастворимых электролита с анионами А – и В – : МА и МВ. При ПР(MA) = ПР(MB) и равных исходных концентрациях А – и В – будет происходить одновременное образование МА и МВ в равных количествах. При ПР (MA) > ПР(MB) и сопоставимых концентрациях анионов происходит преимущественное образование МВ. Отсюда следует, что чем меньше ПР , тем раньше (т.е. при меньшей концентрации) начнет выпадать осадок.
Сравнение значений ПР возможно, если электролиты дают при диссоциации одинаковое число ионов. Например:
а) AgI, AgCl; б) CaSO4, BaSO4; в) Ag2CrO4, Ag2CO3; г) PbCl2, PbI2, д) Ca3(PO4)2, Ba3(PO4)2,Mg3(PO4)2.
Конкурирующие равновесия разных типов:
А) равновесие с образованием комплексных соединений;
Б) кислотно-основное равновесие;
А) Влияние равновесия с образованием комплексного соединения на гетерогенное равновесие. Чем прочнее образуется комплексное соединение, т.е.чем меньше Кнест. (см. раздел 10.3.), тем больше будет сдвинуто равновесие в сторону образования комплекса, т.е. растворения осадка.
AgCl(к) ⇄ Ag + + Cl – (насыщ р-р) ПР(AgCl) = 1,6 . 10 –10
Видео:гетерогенное равновесиеСкачать

Запишем молекулярное уравнение реакции
Запишем сокращенное ионное уравнение
Исходя из определения константы совмещенного равновесия, можно сразу записать, чему будет она будет равна. Это будет отношение ПР осадка левой части уравнения к К нест комплексного иона в правой части уравнения.
Для того, чтобы вывести константу совмещенного равновесия запишем константу равновесия данной реакции по закону действующих масс (в числителе стоят равновесные концентрации продуктов, в знаменателе равновесные концентрации исходных веществ, возведенные в степень стехиометрических коэффициентов). Концентрация твердых веществ считается величиной постоянной и в константу равновесия не пишется. Пишем только концентрации ионов и молекул аммиака.
Кравн = [[Ag(NH3)2] + ] . [Cl – ] / [NH3] 2 . Далее домножим и поделим на концентрацию конкурирующего иона [Ag + ]
ПР(AgCl) = [Ag + ] . [Cl – ]
Кравн = ПР(AgCl)/ Кнест.[Ag(NH3)2]+ = 1,6 . 10 –10 /5,89 . 10 –8 = 2,6 . 10 –3
Kравн 1·10 –5 , если через насыщенный раствор AgCl пропустить избыток аммиака , то это вызовет образование комплексного иона [Ag(NH3)2] + и осадок AgCl раствориться. Конкуренция за ион Ag + .
Б) Влияние кислотно-основного равновесия на гетерогенное равновесие. Растворимость труднорастворимых солей, образованных анионами слабых кислот, значительно зависит от рН раствора. Это обусловлено возникающими конкурирующими процессами за анион слабой кислоты между ионом металла и Н + . При определенном значении рН может произойти полное растворение осадка.
Пример1. Оксалат кальция растворяется в соляной кислоте.
1. Охарактеризуем константами диссоциативного типа все вещества, участвующие в равновесии оксалата кальция и щавелевую кислоту:
Щавелевая кислота является двухосновной кислотой, диссоциирует в две ступени и каждая ступень характеризуется своей константой ионизации:
Суммарное уравнение ионизации:
Характеризуется произведением двух констант ионизации:
2. Запишем уравнения реакций взаимодействия оксалата кальция с соляной кислотой в молекулярном виде
Запишем полное ионное уравнение
Запишем сокращенное ионное уравнение
Запишем константу совмещенного равновесия исходя из ее определения
3. Выведем и рассчитаем общую константу совмещенного равновесия для реакции(3)
Далее домножим и поделим на концентрацию конкурирующего иона [ C2O4 2- ]
Видео:Гетерогенные равновесияСкачать

Kравн –5 такие реакции в стандартных условиях не идут, поэтому в физиологических условиях почка образует нерастворимый оксалат кальция. Но оксалат кальция можно растворить in vitro в растворе соляной кислоты большой концентрации.
Пример 2.Оксалат кальция не растворяется в уксусной кислоте
1. Охарактеризуем константами диссоциативного типа все вещества, участвующие в равновесии оксалат кальция, щавелевую кислоту и уксусную кислоту:
Суммарное уравнение ионизации:
Характеризуется произведением двух констант ионизации:
2. Запишем уравнения реакций взаимодействия оксалата кальция с уксусной кислотой.
3. Запишем общую константу совмещенного равновесия для реакции исходя из определения. Учтем, что уксусная кислота в уравнение входит с коэффициентом 2. Значит, ее константу нужно возвести в квадрат
Кравн= ПР(CaC2O4)∙К 2 (CH3COOH ) / K1(H2C2O4) ∙ K2(H2C2O4) =
2,3·10 –9 ∙(1,74 ∙ 10 -5 ) 2 / 5,4 ∙10 -2 ∙ 5,4 ∙10 -5 =2,4 ∙ 10 -13
Kравн –5 оксалат кальция в уксусной кислоте не растворяется, равновесие невозможно протекает только обратная реакция.
В примерах 1 и 2 совмещаются протолитические и гетерогенные равновесия; объектом конкуренции является оксалат-ион C2O4 2– ; конкурирующие частицы ионы кальция Ca 2+ и H +
ТЕСТОВЫЕ ЗАДАНИЯ К ТЕМЕ VII
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ (ПР)
Выберите один правильный ответ
1. гетерогенное равновесие трудно растворимой соли Ва3(РО4)2 характеризует уравнение
1)
2)
3)
4)
2. теория ПР не применима Для соединения
1) AgJ 2) AgF 3) AgCl 4) AgBr
3. ПР А1(ОН)3 рассчитывается по уравнению:
1) ПР = [Al 3+ ]×[OH — ] 3
3) ПР = [Al] 3+ + 3[OH] —
4) ПР = [Al 3+ ] + [OH — ] 3
4. теория ПР справедлива для
Видео:Гетерогенное равновесие. РастворимостьСкачать

5. ПР соли Hg3(PO4)2 можно рассчитать по выражению
1)
2)
3)
4)
6. образование осадка СaSO4 возможно при значении ПК
1) 6×10 -7 2) 5×10 -3 3) 5,5×10 -8 4) 3,2×10 -6
7. Раствор, в котором ПК -16 2) 10 -30 3) 10 -25 4) 10 -39
10. Смешаны равные объемы 

1) 
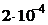

11. ПК труднорастворимой соли AgCl при смеше-нии 10 мл 0,01 моль/л раствора 
1) 


12. концентрация ионов 

1) 


13. Концентрация ионов 

1) 


14. концентрация ионов Са 2+ выше над осадком
15. растворимость CdS можно рассчитать по выражению
1) 
3) 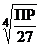
16. менее растворимо соединение
1) 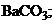
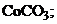

17. растворимость 

1) 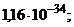


18. величина ПР гидроксида хрома (iii), выра-женная через растворимость S (моль/л) этого гидроксида
1) 

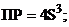
19. растворение осадка фосфата кальция возможно в кислоте
1) 


20. растворение 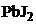
1) NaCl 2) 
21. растворение осадка 
1) 
3) 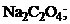
22. Осадок гидроксида никеля 
1) NaOH 2)
3) HCl 4)
23. Будет ли осадок иодида серебра растворяться в уксусной кислоте
1) Нет, Кр>1 2) Нет, Кр 1
Ответы к тесту на стр. 238
Гетерогенные равновесия (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Растворение осадка или сдвиг равновесия вправо может быть осуществлен с помощью любого метода уменьшения концентрации свободных ионов An+ или Bm– : 1) связыванием этих ионов в другой менее растворимый осадок, 2) связыванием ионов металла в комплекс, 3) связыванием аниона в малодиссоциированную кислоту, 4) окислением или восстановлением катиона или аниона.
Однотипные конкурирующие равновесия
В реальных системах редко приходится сталкиваться со случаями, когда имеет место только одно гетерогенное равновесие. Присутствие в биологических жидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых электролитов. В общем случае катион М+ может образовывать два малорастворимых электролита с анионами А– и В–: МА и МВ. При 

При 








C(

(Сделано допущение, что 
Благодаря этому самопроизвольно протекает процесс перевода малорастворимого соединения (CaSO4) в еще более малорастворимое соединение (SrSO4) :
При добавлении с системе, содержащей осадок МА (CaSO4) в равновесии с насыщенным раствором, иона, образующего еще более малорастворимый электролит МВ (SrSO4) , происходит переход МА ® МВ. Таким образом, конкуренцию за общий ион «выигрывает» тот малорастворимый электролит, который имеет меньшее значение 
Сравнение значений 
При рассмотрении однотипных конкурирующих гетерогенных равновесии с участием разнотипных электролитов (например, Са3(РО4)2 и CaSO4, математический аппарат значительно усложняется.
Конкурирующие равновесия разных типов
Параллельно с гетерогенными равновесиями в реальных системах могут иметь место:
— равновесие с образованием комплексных соединений (связывание ионов металла малорастворимого сильного электролита в комплекс)
Видео:Гетерогенное равновесие в системе осадок - насыщенный раствор малорастворимого сильного электролитаСкачать

— кислотно-основное равновесие (связывание аниона малорастворимого сильного электролита в малодиссоциированную кислоту)
— окислительно-восстановительное равновесие (окисление или восстановление ионов малорастворимого сильного электролита).
а) Влияние равновесия с образованием комплексного соединения
на гетерогенное равновесие.
Присутствие веществ, способных образовывать с ионами, входящими в состав осадка, прочные комплексные соединения, значительно изменяет условия образования осадка. Чем прочнее образуется комплексное соединение (чем меньше константа нестойкости), тем больше будет сдвинуто равновесие в сторону образования комплекса, т. е. растворения осадка.
В качестве примера рассмотрим систему из двух разнотипных равновесий:
I. AgCl ⇄ Ag+ + Cl–; 
II. [Ag(NH3)2]+ ⇄ Ag+ + 2NH3
Кнест. [Ag(NH3)2]+ = 6,8 × 10–8
Расчеты, выходящие за рамки настоящего пособия, указывают на то, что aAg+ над осадком в гетерогенной системе 1 гораздо больше, чем aAg+ в растворе, обусловленная диссоциацией комплексного иона. Из этого следует, что если через насыщенный раствор AgCl (гетерогенное равновесие I ) пропустить аммиак, то это вызовет образование комплексного иона [Ag(NH3)2]+ и как, следствие, возникнет новое равновесие, обусловленное диссоциацией комплексного иона [Ag(NH3)2]+ (равновесие II ). В результате образования комплексного иона активность ионов Ag+ в растворе уменьшится, что повлечет за собой растворение осадка AgCl . По мере добавления новых порций аммиака можно полностью растворить осадок AgCl .
В общем виде процесс растворения осадка в комплексообразующих реагентах (комплексантах ) можно выразить схемой:
МА – малорастворимый сильный электролит, Z – лиганд, [M(Z)n]+ – катион растворимой комплексной соли.
б) Влияние кислотно-основного равновесия
на гетерогенное равновесие.
Рассмотрим теперь с позиций химического равновесия растворение осадка с образованием малодиссоциированной слабой кислоты. Иначе говоря, это процесс растворения осадка в кислотах:
Растворяющую кислоту НХ считаем сильной и, следовательно, реакция растворения определяется двумя равновесными процессами: I – растворение малорастворимого сильного электролита МА (осадка) и II – диссоциация слабой кислоты НА.
С возрастанием 
в) Влияние окислительно-восстановительного равновесия
на гетерогенное равновесие.
Растворение осадков может происходить в результате изменения степени окисления какого-либо элемента, входящего в состав твердой фазы, т. е при протекании окислительно-восстановительных процессов. В этом случае растворимость осадка определяется соотношением 

Для осадка со свойствами восстановителя нужно подобрать достаточно сильный окислитель, а для осадка со свойствами окислителя – сильный восстановитель. Например, для растворения СаС2О4 лучше взять KMnO4 , чем I2 , так как 


Гетерогенные равновесия в жизнедеятельности организмов.
В организме человека образование костной ткани это наиболее важный гетерогенный процесс с участием неорганических соединений. Основным минеральным компонентом костной ткани является гидроксифосфат кальция Ca5(PO4)3OH . Часть ионов Ca2+ замещена ионами Mg2+ , а очень незначительная часть ионов OH– замещена ионами фтора, которые повышают прочность кости.
Образование Ca5(PO4)3OH из слабощелочных растворов в опытах “in vitro” можно объяснить следующим образом. Известно, что при физиологическом значении рН крови (7,4) в системе сосуществуют ионы 



Ca2+ + 
Затем образующееся соединение претерпевает следующие изменения:
Видео:гетерогенное равновесиеСкачать

3CaHPO4 + 2OH– + Ca2+ ⇄ Ca4Н(PO4)3 + 2H2O
Ca4H(PO4)3 + 2OH– + Ca2+ ⇄ Ca5(PO4)3ОН + Н2О
Растворимость в ряду CaHPO4 ® Ca4H(PO4)3 ® Ca5(PO4)3OH постоянно понижается, что и способствует образованию последнего соединения:


Несомненно, процессы осаждения фосфатов кальция, лежащие в основе формирования костной ткани в организмах, намного сложнее.
В плазме крови концентрация ионов кальция составляет 0,0025М, а фосфатов – 0,001М. В плазме только половина кальция находится в ионизированном состоянии, другая половина связана с белками. Если учесть, что при рН 7,4 только » 30% фосфатов находится в форме 




Клетки костной ткани могут легко ускорять либо отложение либо растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+ или 
Благодаря такому явлению, как изоморфизм, вместе с кальциевыми солями могут осаждаться в костной ткани соли и других катионов, близких по своим свойствам иону кальция: бериллия, стронция, бария.
Присутствие даже небольшого количества бериллия в окружающей среде приводит к заболеванию – бериллозу (бериллиевый рахит). Дело в том, что ионы Ве2+ вытесняют ионы Са2+ из костной ткани, вызывая ее размягчение.
Ионы стронция образуют нерастворимые соединения с теми же анионами, что и Са2+, термодинамические характеристики их очень близки. В природе существует феномен «дискриминации» стронция в пользу кальция: соотношение Ca/Sr в растениях в 2 раза больше, чем в почве, на которой они произрастают, но еще больше увеличивается (в 5-10 раз) в организме животных, потребляющих в пищу эти растения. Тем не менее, часть ионов Sr2+ включается в состав костной ткани. Избыток стронция вызывает ломкость костей (стронциевый рахит). Особую опасность представляет собой радионуклид стронций-90 (период полураспада 27,7 года, чистый b – излучатель). Источниками стронция-90 являются радиоактивная пыль, питьевая вода, растительная и молочная пища. Оседая в костях, Sr90 облучает костный мозг и нарушает костномозговое кроветворение.
В организме человека, помимо фосфатов, ионы Са2+ могут образовывать и другие малорастворимые соединения. При различных нарушениях обмена веществ могут локально повышаться концентрации некоторых ионов. Так, например, при повышении концентрации оксалат-ионов 
Основным принципом лечения мочекаменной болезни является извлечение из конкрементов (камней) кальция с переводом его в растворимые соединения. Наиболее принятым приемом такого извлечения является воздействие на камень тех или иных комплексообразователей, взаимодействующих с ионами двухвалентных металлов, входящими в состав камней. Примерами таких комплексообразователей являются этилендиаминтетрауксусная кислота (ЭДТА) и ее соли, а также лимонная кислота и ее соли.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ
1. Термодинамическая (
2. Взаимосвязь между растворимостью малорастворимого сильного электролита и его 
3. Условия образования и растворения осадков в гетерогенных системах.
4. Конкурирующие гетерогенные равновесия одного типа.
5. Конкурирующие гетерогенные равновесия разных типов (образование комплексных соединений, малодиссоциированной кислоты, окисление или восстановление одного из ионов малорастворимого соединения).
6. Гетерогенные равновесия в жизнедеятельности организмов. Условия образования фосфатов кальция в слабощелочных растворах.
7. Патология костной ткани (влияние Ве2+, Sr2+) и физико-химия патологического образования камней в организме.
Работа № 1 . Получение гетерогенных систем «осадок – раствор» и смещение
равновесия в гетерогенных системах «осадок – раствор»
Цель работы: приобрести навыки получения гетерогенных систем «осадок – раствор» и провести экспериментальные исследования смещения равновесия в гетерогенных системах «осадок – раствор».
Задание 1. Изучить условие образования осадка малорастворимого сильного электролита.
В 2 пробирки наливают по 2 мл раствора соли Са2+ с концентрацией 0,01 моль/л. В одну из пробирок добавляют 2 мл раствора Na2C2O4 , в другую 2 мл раствора Na2SO4 (концентрация каждого из растворов 0,01 моль/л). Отмечают изменения, происходящие в пробирках.
🎦 Видео
Химия, 12-й класс, Химическое равновесие в гетерогенных системах. Произведение растворимостиСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Гетерогенное равновесиеСкачать

Гетерогенное равновесиеСкачать

Произведение растворимостиСкачать

Лекция 7 TrimСкачать

Растворы. Гетерогенные равновесия (часть 2)Скачать

Биохимия: Обмен кальция и фосфатовСкачать

Химия, 12-й класс, Растворимость малорастворимого вещества и способы ее выражения...Скачать

Галиев Н - Механизмы образования камней из оксалатов и фосфатов кальцияСкачать

Лекция 7Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Растворы. Гетерогенные равновесия (часть 1)Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать