- Электролиз водных растворов солей
- Обсуждение: «Электролиз водных растворов солей»
- Составить уравнения процессов, протекающих при электролизе расплавов и растворов солей
- Правила составления окислительно-восстановительных реакций
- Электролиз растворов электролитов с инертными электродами
- Процессы, протекающие на катоде:
- Процессы, протекающие на аноде:
- Примеры:
- 📽️ Видео
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз водных растворов солей
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
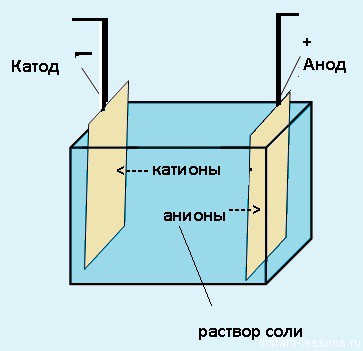
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
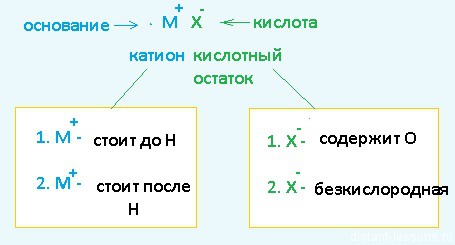
Разберем сначала катионы :
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH – Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu 2+ + 2е = Cu 0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды :
2Н2О + 2е = Н2+ 2ОН — Zn 2+ + 2e = Zn 0
Теперь анионы-кислотные остатки :
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H + Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl − — 1e = Cl2 0 Хлор выделяется на аноде - Исключение: F − — вместо него будет выделяться кислород.
Примеры:
1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
K(-): Cu 2+ + 2e = Cu 0
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu 2+ + 2e = Cu 0
анод (+): 2Cl − — 2e = 2Cl 0
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Обсуждение: «Электролиз водных растворов солей»
Здравствуйте. Очень благодарна вам за такое понятное объяснение темы.
У меня к Вам вопрос. В одном из заданий В3, где нужно было определить продукт на катоде, я столкнулась с такой проблемой. В одной из формул веществ был написан AlCl3. Продуктом на катоде я написала водород. Но в ответ к заданию был алюминий. Скажите в чём моя ошибка или это ошибка в тесте?
Водород — правильный ответ. В ответах к тренировочным тестам ЕГЭ очень часто бывают ошибки. Да и не только в ответах. В этом году, например, в заданиях пробных ЕГЭ быди ошибки!
1. Запишите все возможные процессы на аноде, установите потенциалы процессов.
2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь?
3. Выясните, меняется ли среда около анода, если да, то как и почему?
4. Запишите все возможные процессы на катоде, установите потенциалы процессов.
5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь.
6. Установите, меняется ли среда около катода, если да, то как и почему?
7. Запишите итоговую схему процесса электролиза.
0,1 M раствор CuSO4
pH = 5, катод – Al, анод – Сu
здесь решают задачи школьного уровня. Не сможем вам помочь
Видео:Электролиз. 10 класс.Скачать

Составить уравнения процессов, протекающих при электролизе расплавов и растворов солей
Задача 686.
Составить уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl2 с инертными электродами.
Решение:
а) Электролиз расплава едкого натра
В расплаве едкого натра содержатся ионы Na+ и OH-:
Ионы натрия восстанавливаются на катоде: NaOH ⇔ Na + + OH — .
На аноде ионы ОН — окисляются с образованием воды и кислорода:
2ОН — — 2 
Два атома кислорода, соединяясь друг с другом, образуют молекулу:
Таким образом, процесс окисления ионов ОН — можно выразить уравнением:
4ОН — — 4 
Умножив уравнение катодного процесса на четыре, и сложив его с анодным процессом, получим:
4Na + + 4OH — ⇔ 4Na + H2O + O2↑
у катода у анода
Процесс в целом можно выразить уравнением:
Таким образом, при электролизе расплава едкого натра у катода выделяется металлический натрий, а у анода – газообразный кислород и вода.
б) Электролиз расплава соли NiCl2 находятся ионы Ni 2+ и Cl — : NiCl2 ⇔ Ni 2+ + 2Cl — .
В расплаве соли NiCl2 находятся ионы Ni 2+ и Cl — :
Образующиеся ионы никеля восстанавливаются на катоде с образованием металлического никеля:
Ni 2+ + 2 
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые соединяясь друг с другом, образуют молекулу хлора:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение процесса:
Ni 2+ + 2Cl — = Ni + Cl2↑
у катода у анода
Таким образом, при электролизе расплава соли хлорида никеля (II) на катоде выделяется металлический никель, а на аноде – газообразный хлор.
Задача 687.
Составить схемы электролиза водных растворов Н2SO4, CuCl2, Pb(NO3)2 с платиновыми электродами.
Решение:
а) Электролиз водного раствора Н2SO4
Стандартный потенциал системы: 2Н + + 2 
2Н2О + 2 
Поскольку, отвечающий этой системе стандартный электродный потенциал (1,23В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему:
2SO4 2- — 2 
Ионы SO4 2- , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве. Умножая уравнение катодного процесса на два и складывая его с уравнением анодного процесса, получаем суммарное уравнение реакции электролиза серной кислоты:
Таким образом, одновременно с выделением водорода у катода и кислорода у анода образуется вода (катодное пространство) и серная кислота (анодное пространство). После приведения членов в обеих частях равенства получим:
2H2O — 4 
у катода у анода
Вывод:
При электролизе раствора серной кислоты происходит разложение воды на катоде и аноде, в результате чего происходит выделение водорода (в катодном пространстве) и кислорода (в анодном пространстве), а серная кислота остаётся без изменения.
б) Электролиз водного раствора CuCl2
Медь располагается в ряду активности после водорода, поэтому на катоде восстанавливается металл:
Катод (–): Cu 2+ + 2ē = Cu 0
На аноде будет происходить электрохимическое окисление ионов Cl-, приводящее к выделению хлора:
Анод (+): 2Cl – — 2ē = 2Cl – → Cl2↑.
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно выше, чем стандартный потенциал (+1,23 В), характеризующий систему
Вывод:
Таким образом, при электролизе водного раствора хлорида меди на катоде выделяется медь, на аноде – хлор.
в) Электролиз водного раствора Рb(NO3)2
Рb(NO3)2 – соль средней активности металла и кислородсодержащей кислоты. Стандартный электродный потенциал электрохимической системы:
Pb 2+ + 2 

Pb 2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
Ионы NO3 — , движущиеся при гидролизе к аноду, будут накапливаться в анодном пространстве. Умножим уравнение катодного процесса на два и сложим его с уравнением анодного процесса, получим суммарное уравнение:
2Pb 2+ + 2H2O = 2Pb + O2↑ + 4H +
у катода у анода
Приняв во внимание, что одновременно происходит накопление ионов NO3 — в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Вывод:
При электролизе водного раствора нитрата свинца на катоде выделяется свинец, на аноде – газообразный кислородрд, в растворе образуется азотная кислота (анодное пространство).
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Правила составления окислительно-восстановительных реакций
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:ЭлектролизСкачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
📽️ Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Электролиз расплавов и растворов. 10 класс.Скачать

Электролиз расплавов и растворов. 1 часть. 10 класс.Скачать

Взаимодействие металлов с серной и азотной кислотами (H2SO4, HNO3)Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

91. Электролиз. Задачи (часть 2)Скачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать