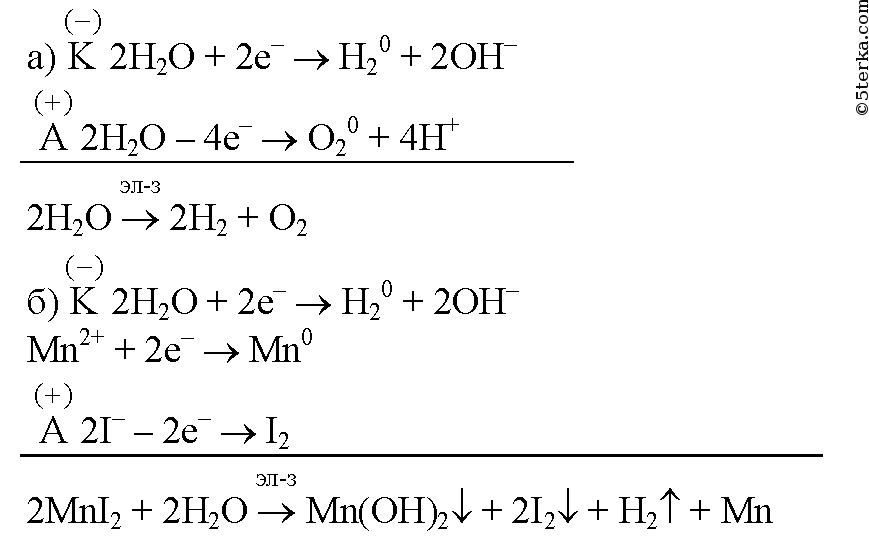задача №24
к главе «Глава 4. Вещества и их свойства. §18. Металлы».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
- Составьте уравнения электролиза водных растворов солей K3PO4 и MnI2?
- Составьте уравнение электролиза водного раствора карбоната калия?
- Назовите продукты электролиза : раствора MnI₂?
- Составьте уравнения электролиза водных растворов следующих солей (электроды графитовые) :а) K3PO4б) Zn(NO3)2в) MnI2г) PtSO4д) SnPr2?
- ПОМОГИТЕ ПОЖАЛУЙСТААА))))?
- Уравнение электролиза раствора соли, нитрата магния?
- Напишите уравнения реакций, которые протекают при электролизе расплава и водного раствора хлорида кальция?
- При электролизе водного раствора соли на аноде выделился хлор, а в растворе образовался гидроксид бария?
- Составить уравнения анодного и катодного процессов при электролизе водного раствора соли NaI с инертными электродами?
- Какой процесс протекает на катоде при электролизе водного раствора смеси солей CuSO4 и NaCl?
- 2. При электролизе на инертных электродах водного раствора хлорида бария не получится : а) H2 ; б) Ba ; в) Cl2 ; г) Ba(OH)2?
- Правила составления окислительно-восстановительных реакций
- Электролиз растворов электролитов с инертными электродами
- Процессы, протекающие на катоде:
- Процессы, протекающие на аноде:
- Примеры:
- 📽️ Видео
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Составьте уравнения электролиза водных растворов солей K3PO4 и MnI2?
Химия | 10 — 11 классы
Составьте уравнения электролиза водных растворов солей K3PO4 и MnI2.
1катод ( — ) 2Н2О + 2е — > ; H2 + 2OH
анод ( + ) 2H2O — 4e — > ; O2 + 4H
2катод ( — ) 2H2O + 2e — > ; H2 + 2OH
анод ( + ) 2I — 2e — > ; I2
2MnI2 + 2H2O — > ; Mn(OH)2(стрелка вниз) + 2I2(стрелка вниз) + H2(стрелка вверх) + Mn.
Видео:Электролиз. 10 класс.Скачать

Составьте уравнение электролиза водного раствора карбоната калия?
Составьте уравнение электролиза водного раствора карбоната калия.
Видео:Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Назовите продукты электролиза : раствора MnI₂?
Назовите продукты электролиза : раствора MnI₂.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Составьте уравнения электролиза водных растворов следующих солей (электроды графитовые) :а) K3PO4б) Zn(NO3)2в) MnI2г) PtSO4д) SnPr2?
Составьте уравнения электролиза водных растворов следующих солей (электроды графитовые) :
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

ПОМОГИТЕ ПОЖАЛУЙСТААА))))?
Почему калий нельзя получить электролизом водных растворов солей?
Ответ поясните с помощью уравнений реакций.
Как можно получит калий с помощью электролиза ?
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Уравнение электролиза раствора соли, нитрата магния?
Уравнение электролиза раствора соли, нитрата магния?
Видео:Урок 187 (осн). Применения электролизаСкачать

Напишите уравнения реакций, которые протекают при электролизе расплава и водного раствора хлорида кальция?
Напишите уравнения реакций, которые протекают при электролизе расплава и водного раствора хлорида кальция.
Можно ли получить металлический кальций электролизом водных растворов его солей?
Видео:Электролиз расплавов и растворов. 10 класс.Скачать

При электролизе водного раствора соли на аноде выделился хлор, а в растворе образовался гидроксид бария?
При электролизе водного раствора соли на аноде выделился хлор, а в растворе образовался гидроксид бария.
Запишите формулу соли.
Видео:🔥 Получение водорода. Какой электролит лучше? Тест и сравнение разных растворов.Скачать

Составить уравнения анодного и катодного процессов при электролизе водного раствора соли NaI с инертными электродами?
Составить уравнения анодного и катодного процессов при электролизе водного раствора соли NaI с инертными электродами.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Какой процесс протекает на катоде при электролизе водного раствора смеси солей CuSO4 и NaCl?
Какой процесс протекает на катоде при электролизе водного раствора смеси солей CuSO4 и NaCl.
Видео:Электролиз растворов. 3 часть. 10 класс.Скачать
2. При электролизе на инертных электродах водного раствора хлорида бария не получится : а) H2 ; б) Ba ; в) Cl2 ; г) Ba(OH)2?
2. При электролизе на инертных электродах водного раствора хлорида бария не получится : а) H2 ; б) Ba ; в) Cl2 ; г) Ba(OH)2.
Составьте схему электролиза раствора этой соли.
На этой странице находится вопрос Составьте уравнения электролиза водных растворов солей K3PO4 и MnI2?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
Метан СН₄ и углекислый газ СО₂ — газообразные соединения углерода. Метан относится к классу органических веществ, а так же к классу летучих водородных соединений ; ауглекислый газ — неорганических, а так же к классу оксидов. Сходство : Химические с..
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

Правила составления окислительно-восстановительных реакций
Видео:Электролиз. Как составлять уравнения электролиза водных растворов солей.Скачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:ХИМИЯ 11 класс : Электролиз растворовСкачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
📽️ Видео
Урок 299. Применение электролизаСкачать

САМЫЙ ПРОСТОЙ СПОСОБ ПОЛУЧИТЬ ЗОЛОТО ИЗ РАСТВОРА.(ЭЛЕКТРОЛИЗ)...GOLDEN CHANNEL...Скачать

Задачи №34 с электролизом. ЕГЭ по химииСкачать

ЭлектролизСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать