- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Электролиз растворов и расплавов солей (2 ч)
- Пожалуйста, помогите составить уравнения электролиза веществ?
- Хлорид натрия + нитрат серебра ; бромид натрия + нитрат серебра ; иодид калия + нитрат серебра?
- Помогите?
- Выполните реакции между растворами следующих веществ а) нитрат серебра и хлорид натрия б)нитрат магния и карбонат калия Написать уравнение реакции и указать полную и сокращённую ионные формы?
- Составить молекулярные и ионно — молекулярные уравнения реакций в растворах между : ¬ а) хлоридом кальция и карбонатом натрия, б) нитратом серебра и бромидом калия?
- Взаимодействие хлорида натрия с нитрат серебра?
- А) Нитрат серебра + хлорид железа (|||) = хлорид серебра + Нитрат железа (|||)б) Фосфорная кислота + гидроксид натрия = фосфат натрия + вода * Решите пожалуйста))❤?
- Напишите молекулярные, полные и сокращенные ионные уравнения реакций между веществами :А)гидроксидом калия и серной кислотойБ)нитратом серебра и хлоридом кальцияВ)карбонатом натрия и азотной кислотой?
- Реакция осуществима между растворами солей1)карбоната калия и хлорида натрия2)карбоната натрия и сульфата калия3)хлорида алюминия и нитрата серебра4)сульфата натрия и хлорида калия?
- При электролизе водных растворов хлорида бария, хлорида меди(II), ионида калия, нитрата серебра, сульфида натрия на катоде выделяется только металл ?
- 1) Определите, какие продукты образуются на катоде и на аноде в случае электролиза водного раствора : а) нитрата меди( II) б) бромида натрия в) сульфата магния г) иодида калия?
- 🎦 Видео
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Электролиз. 10 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6ded9a62eaad1ead • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Опыты по химии. Электролиз раствора хлорида медиСкачать

Электролиз растворов
и расплавов солей (2 ч)
Цели первого урока: научить писать схемы электролиза растворов и расплавов солей и применять полученные знания для решения расчетных задач; продолжить формирование навыков работы с учебником, тестовыми материалами; обсудить применение электролиза в народном хозяйстве.
П л а н п е р в о г о у р о к а
1. Повторение изученных способов получения металлов.
2. Объяснение нового материала.
3. Решение задач из учебника Г.Е.Рудзитиса, Ф.Г.Фельдмана «Химия-9» (М.: Просвещение, 2002), с. 120, № 1, 2.
4. Проверка усвоения знаний на тестовых заданиях.
5. Сообщение о применении электролиза.
Цели первого урока: научить писать схемы электролиза растворов и расплавов солей и применять полученные знания для решения расчетных задач; продолжить формирование навыков работы с учебником, тестовыми материалами; обсудить применение электролиза в народном хозяйстве.
ХОД ПЕРВОГО УРОКА

Запись уравнений соответствующих реакций:

Электролиз – это окислительно-восстановительный процесс, происходящий на электродах при пропускании электрического тока через расплав или раствор электролита.
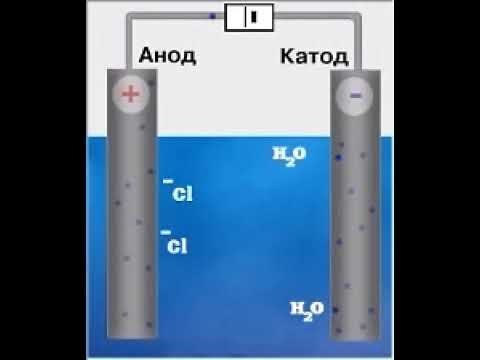
Электролиз расплава хлорида натрия:
NaCl 
катод (–) (Na + ): Na + + е = Na 0 ,
анод (–) (Cl – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
2NaCl = 2Na + Cl2
Электролиз раствора хлорида натрия:
NaCl 
H2O 
катод (–) (Na + ; Н + ): H + + е = H 0 , 2H 0 = H2
анод (+) (Cl – ; OН – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2 

Электролиз раствора нитрата меди(II):
Cu(NO3)2 
Н2O 
катод (–) (Cu 2+ ; Н + ): Cu 2+ + 2е = Cu 0 ,
анод (+) ( OН – ): OH – – е = OH 0 ,
2Cu(NO3)2 + 2H2O = 2Cu 

Эти три примера показывают, почему электролиз проводить выгоднее, чем осуществлять другие способы получения металлов: получаются металлы, гидроксиды, кислоты, газы.
Мы писали схемы электролиза, а теперь попробуем написать сразу уравнения электролиза, не обращаясь к схемам, а только используя шкалу активности ионов:
Примеры уравнений электролиза:
2HgSO4 + 2H2O = 2Hg 

Na2SO4 + 2H2O = Na2SO4 + 2H2 

2LiCl + 2H2O = 2LiOH + H2 


Задача 1. При электролизе раствора хлорида меди(II) масса катода увеличилась на 8 г. Какой газ выделился, какова его масса?
CuCl2 + H2O = Cu + Cl2 



Ответ. Газ – хлор массой 8,875 г.
Задача 2. При электролизе водного раствора нитрата серебра выделилось 5,6 л газа. Сколько граммов металла отложилось на катоде?
4AgNO3 + 2H2O = 4Ag + O2 



m(Ag) = 1•107 = 107 г.
Ответ. 107 г серебра.

Вариант 1
1. При электролизе раствора гидроксида калия на катоде выделяется:
а) водород; б) кислород; в) калий.
2. При электролизе раствора сульфата меди(II) в растворе образуется:
а) гидроксид меди(II);
б) серная кислота;
3. При электролизе раствора хлорида бария на аноде выделяется:
а) водород; б) хлор; в) кислород.
4. При электролизе расплава хлорида алюминия на катоде выделяется:
а) алюминий; б) хлор;
в) электролиз невозможен.
5. Электролиз раствора нитрата серебра протекает по следующей схеме:
а) AgNO3 + H2O 


б) AgNO3 + H2O 


в) AgNO3 + H2O 


Вариант 2
1. При электролизе раствора гидроксида натрия на аноде выделяется:
а) натрий; б) кислород; в) водород.
2. При электролизе раствора сульфида натрия в растворе образуется:
а) сероводородная кислота;
б) гидроксид натрия;
3. При электролизе расплава хлорида ртути(II) на катоде выделяется:
а) ртуть; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора нитрата ртути(II) протекает по следующей схеме:
а) Hg(NO3)2 + H2O 


б) Hg(NO3)2 + H2O 


в) Hg(NO3)2 + H2O 


Вариант 3
1. При электролизе раствора нитрата меди(II) на катоде выделяется:
а) медь; б) кислород; в) водород.
2. При электролизе раствора бромида лития в растворе образуется:
б) бромоводородная кислота;
в) гидроксид лития.
3. При электролизе расплава хлорида серебра на катоде выделяется:
а) серебро; б) хлор; в) электролиз невозможен.
4. При электролизе раствора хлорида алюминия алюминий выделяется на:
а) катоде; б) аноде; в) остается в растворе.
5. Электролиз раствора бромида бария протекает по следующей схеме:
а) BaBr2 + H2O 

б) BaBr2 + H2O 
в) BaBr2 + H2O 

Вариант 4
1. При электролизе раствора гидроксида бария на аноде выделяется:
а) водород; б) кислород; в) барий.
2. При электролизе раствора йодида калия в растворе образуется:
а) йодоводородная кислота;
б) вода; в) гидроксид калия.
3. При электролизе расплава хлорида свинца(II) на катоде выделяется:
а) свинец; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора сульфида натрия протекает по следующей схеме:
а) Na2S + H2O 


б) Na2S + H2O 


в) Na2S + H2O 

| Вариант | Вопрос 1 | Вопрос 2 | Вопрос 3 | Вопрос 4 | Вопрос 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |

1. Для защиты металлических изделий от коррозии на их поверхность наносят тончайший слой другого металла: хрома, серебра, золота, никеля и т.д. Иногда, чтобы не расходовать дорогие металлы, производят многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тонкий слой никеля, а на него – слой хрома.
При нанесении покрытий на металл электролизом они получаются ровными по толщине, прочными. Таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией.
2. Кроме защиты от коррозии гальванические покрытия придают красивый декоративный вид изделиям.
3. Другая отрасль электрохимии, близкая по принципу к гальваностегии, названа гальванопластикой. Это процесс получения точных копий различных предметов. Для этого предмет покрывают воском и получают матрицу. Все углубления копируемого предмета на матрице будут выпуклостями. Поверхность восковой матрицы покрывают тонким слоем графита, делая ее проводящей электрический ток.
Полученный графитовый электрод опускают в ванну с раствором сульфата меди. Анодом служит медь. При электролизе медный анод растворяется, а на графитовом катоде осаждается медь. Таким образом получается точная медная копия.
С помощью гальванопластики изготавливают клише для печати, грампластинки, металлизируют различные предметы. Гальванопластика открыта русским ученым Б.С.Якоби (1838).
Изготовление штампов для грампластинок включает нанесение тончайшего серебряного покрытия на пластмассовую пластинку, чтобы она стала электропроводной. Затем на пластинку наносят электролитическое никелевое покрытие.
Чем следует сделать пластинку в электролитической ванне – анодом или катодом?
(О т в е т. Катодом.)
4. Электролиз используют для получения многих металлов: щелочных, щелочно-земельных, алюминия, лантаноидов и др.
5. Для очистки некоторых металлов от примесей металл с примесями подключают к аноду. Металл растворяется в процессе электролиза и выделяется на металлическом катоде, а примесь остается в растворе.
6. Электролиз находит широкое применение для получения сложных веществ (щелочей, кислородсодержащих кислот), галогенов.
 |
 |