Видео:Коррозия металла. Химия – ПростоСкачать

Как правильно решать задачи на атмосферную коррозию
Задание 281.
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Олово имеет менее отрицательный стандартный электродный потенциал (-0,14 В), чем железо (-0,44 В), поэтому оно является катодом, железо – анодом. При контакте олова и железа в атмосфере разрушаться будет железо:
Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Цинк имеет более отрицательный стандартный электродный потенциал (-0,763 В), чем железо (-0,44 В), поэтому он является анодом, железо – катодом.
Анодный процесс: Zn0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Zn 2+ с гидроксид-ионами ОН – образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Задание 282.
Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Решение:
Стандартный электродный потенциал для полуреакции Cu 0 — 2 
Анодный процесс: Zn 0 — 2 
Катодный процесс: 2Н + + 2 
Ионно-молекулярная форма процесса:
Zn 0 + 2H + = Zn 2+ + Н20↑
Таким образом, при опускании в раствор разбавленной кислоты медной пластинки, контактирующей с цинковой пластинкой, наблюдается выделение пузырьков газообразного водорода, так как протекает реакция:
Zn 0 + 2H + = Zn 2+ + Н20 ↑
Задание 283.
Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Коррозия лужёного железа в атмосферных условиях. Стандартный электродный потенциал системы: Sn 0 — 2 

Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Коррозия лужёной меди в атмосферных условиях. Олово имеет более отрицательный стандартный электродный потенциал (-0,14 В), чем медь (+0,34 В), поэтому оно является анодом, мед – катодом. При контакте олова и меди в атмосфере разрушаться будет олово:
Анодный процесс: Sn 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Sn 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Sn(OH)2.
Видео:Электрохимическая коррозияСкачать

Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:


Так как 
 |
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4)
Составляем схему коррозионного ГЭ:
А (-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На К(+) 2H + + 2ē = H2 1
 |
Zn + 2H + = Zn 2+ + H2 — суммарное ионно-молекулярное уравнение процесса коррозии;
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
Составляем схему коррозионного ГЭ:
А (-) Zn │ HCl + O2 │ Fe (+) K
А (-) Zn │ H + + O2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:


На A (-) Zn – 2ē = Zn 2+ 2

2Zn + 4H + + O2 = 2Zn 2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10 -3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

| РЕШЕНИЕ: Для составления схемы ГЭ необхо-димо знать величины электродных потенциалов металлов – цинка и хрома. По таблице 11.1 определяем стан-дартные электродные потенциалы металлов: |
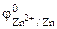
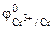
Хлорид цинка диссоциирует по уравнению:

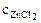

α = 1 (ZnCl2 – сильный электролит), 

Хлорид хрома (III) диссоциирует по уравнению:
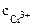
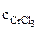
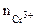
α = 1 (CrCl3 – сильный электролит), 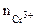
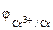
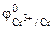
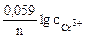

Так как 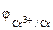
Составляем уравнения электродных процессов и суммарной токообразующей реакции:


На A(-)Cr – 3ē = Cr 3+ 2
На К(+)Zn 2+ + 2ē = Zn 3
2Cr + 3Zn 2+ = 2Cr 3+ + 3Zn — суммарное ионно-молекулярное уравнение токообразующей реакции
2Cr + 3ZnCl2 = 2CrCl3 + 3Zn — суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
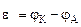


2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni 2+ = Fe 2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆fG 0 (298К, Me n + ) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
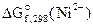

Дано: 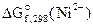 = -64,4 кДж/моль = -64,4 кДж/моль  = -84,94 кДж/моль Т = 298 К = -84,94 кДж/моль Т = 298 К  ε 0 — ? Кс — ? ε 0 — ? Кс — ? | РЕШЕНИЕ: На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов: |


На К(+)Ni 2+ + 2ē = Ni 1 — восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель.
Составляем схему ГЭ:
А(-) Fe │ Fe 2+ ║ Ni 2+ │ Ni(+)K
Рассчитываем стандартное напряжение ГЭ:
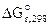
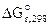

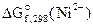
= -84,94-(-64,4) = -20,54 кДж,
ε 0 =
z = 2, F = 96500 Кл/моль.
Рассчитываем константу равновесия токообразующей реакции (Кc).
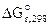
lgKс =
Ответ: ε 0 = 0,106В, Kс = 3981.
3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см 2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см 3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10 -3 г. Плотность железа равна 7,9 г/см3 .
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

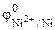
Так как 
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A Fe – 2ē = Fe 2+

Fe + 2H + = Fe 2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии.

| Рассчитываем объемный показатель коррозии KV по формуле: KV =  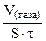 , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. , см 3 /м 2 ∙час. При расчете KV принимаем: S – [м 2 ], τ — [час], V(газа) – [см 3 ]. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, V(газа) = 
Тогда, KV = 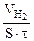
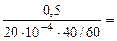
10 -4 – коэффициент пересчета, см 2 в м 2 .
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 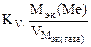
В процессе коррозии разрушению подвергается железо и выделяется водород.
Мэк(Ме) = Мэк(Fe) = 
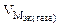

Km = 
Ответ: KV = 375 см 3 /м 2 ∙час, Km = 0,94 г/м 2 ∙час.

| Рассчитываем весовой показатель коррозии Km по формуле: Km =  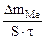 , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла , г/м 2 ∙час. Коррозии подвергается железо. Тогда потеря массы металла  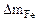 . . |
При расчете Km принимаем: 
Тогда: Km = 


Рассчитываем глубинный показатель коррозии по формуле:
П = 

Ответ: Km = 0,925 г/м 2 ∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Таблица 11.1. Процессы протекающие на катоде при электролизе водных растворов
 В В | Катио-ны в вод- ном рас- творе | Зоны | Процессы на катоде |
| -3,02 -2,99 -2,93 -2,92 -2,90 -2,89 -2,87 -2,71 -2,34 -1,67 | Li + , Rb + , Cs + K + , Ba 2+ , Sr 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ | I | Катионы этих металлов на катоде не восстанавли-ваются, а концентри-руются в околокатодном пространстве (католите). На катоде восстанавливаются только молекулы воды: 2Н2О + 2ē = 2ОН — + Н2 |
| -1,05 -0,76 -0,74 -0,44 -0,40 -0,28 -0,26 -0,14 -0,13 | Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+ | II | 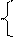 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 На катоде параллельно протекают два процесса: Ме n + + nē = Me 2Н2О + 2ē = 2ОН — + Н2 |
| 0,00 | Н + | При электролизе кислоты 2Н + + 2ē = Н2 | |
| +0,20 +0,23 +0,34 +0,80 +0,83 +0,85 +1,20 | Sb 3+ , Bi 3+ , Cu 2+ , Ag + , Pd 2+ , Hg 2+ , Pt 2+ | III | Восстанавливаются только ионы этих металлов Ме n + + nē = Me |
Таблица 11.2. Последовательность окисления анионов на инертном аноде в водном растворе.
| Очередность окисления анионов | Процессы окисления на аноде. |
| 1. | Окисляются анионы бескислородных кислот (Cl — , Br — , J — , S 2- , и др.) Например: 2Cl — -2ē = Cl2 |
| 2. | Окисляются ОН — ионы 4ОН — -4ē = О2 + 2Н2О |
Если в водном растворе присутствуют анионы кислородсодержащих кислот (  , ,  , , 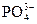 , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + , и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды. 2H2O — 4е = О2+4H + |
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe 0 – nē = Me n +
УРОВЕНЬ А
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов (анод инертный): а) хлорида меди (II), б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| РЕШЕНИЕ а) CuCl2 = Cu 2+ + 2Cl — , Схему электролиза составляем в соответствии с таблицами 11.1 и 11.2: K(-) A(+) инертный Cu 2+ + 2ē = Cu 2Cl — — 2ē = Cl2 H2O H2O |
На катоде выделяется Cu, на аноде выделяется Cl2.
б) NaОН = Na + + ОН —
Na + 4ОН 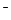
На катоде выделяется Н2, на аноде выделяется О2.
2.Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?

| РЕШЕНИЕ а) анод – инертный NiSO4 = Ni 2+ +  Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: Схему электролиза составляем в соответствии с таблицами 11.1. и 11.2: |
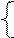
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni 2+ +
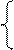

2H2O+2ē = H2+2OH — Ni — 2ē = Ni 2+
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3.При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
|
 | РЕШЕНИЕ а) Ca(NO3)2 = Ca 2+ + 2  Схема электролиза: K(-) A(+) инертный Ca 2+ Схема электролиза: K(-) A(+) инертный Ca 2+  2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) 2H2O+2ē=H2+2OH — 2H2O — 4ē = О2+4H + На катоде выделяется Н2, на аноде выделяется О2 По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) |
В соответствии со схемой электролиза:
nэк (О2)(анод) = nэк (Н2)(катод) или 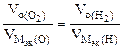


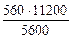
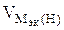
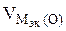
На катоде выделилось 1120 см 3 водорода.
Ответ: 1120 см 3 водорода.
б) AgNO3 = Ag + +
Ag + + ē = Ag
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(Ag)(катод) = nэк(О2)(анод) или 
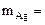


где
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ В
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
Дано: Электролит: K2SO4 τ = 4 ч Т = 298 К I = 2 A Р = 99 кПа Анод инертный  1. Схема электролиза-? 2. 1. Схема электролиза-? 2.  (катод) — ? 3. (катод) — ? 3.  (анод) — ? (анод) — ? | РЕШЕНИЕ K2SO4 = 2K + + 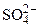 Схема электролиза: K(-) A(+) (инертный) K + Схема электролиза: K(-) A(+) (инертный) K +  2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): 2H2O + 2ē = 2H2O — 4ē = = H2 + 2OH — = О2 + 4H + На катоде выделяется H2, на аноде выделяется О2 По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.): |


где 
F = 96500 Кл/моль, если τ – cек,
F = 26,8 А∙ч/моль, если τ – час.
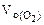

где 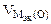

Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:

откуда: 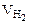

Объем кислорода при заданных условиях:

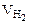
Ответ: 3,73 л водорода, 1,865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см 2 , необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0,15 мм. Плотность меди – 8,9 г/см 3 .
  Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3 Дано: Электролит: CuCl2 S = 100 см 2 h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см 3  Анод медный Схема электролиза-? Анод медный Схема электролиза-?  Время электролиза, τ -? Время электролиза, τ -? |  РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ= РЕШЕНИЕ CuCl2 = Cu 2+ + 2Cl — Схема электролиза: K(-) A(+) (Cu) Cu 2+ + 2ē = Cu Cl — H2O H2O Cu – 2ē = Cu 2+ На катоде выделяется Cu, на аноде растворяется Cu. ВТ=  ; mCu(факт) = mCu(теор)·ВТ ; mCu(факт) = mCu(теор)·ВТ |
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна:
mCu(факт) = 
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S∙h∙ρ (г), где S – см 2 , h – см, ρ – г/см 3 .
S∙h∙ρCu = 
откуда
τ = 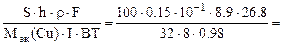
где Mэк(Cu) = 
10 -1 – коэффициент пересчета мм в см.
3.Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см 3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
   Дано: Электролит: AgNO3 I = 4 A Дано: Электролит: AgNO3 I = 4 A  = 75 см 3 τ = 25 мин Анод инертный = 75 см 3 τ = 25 мин Анод инертный  Схема электролиза-? Схема электролиза-?  — ? — ? | РЕШЕНИЕ AgNO3 = Ag + +  Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag Схема электролиза: K(-) A(+) инертный Ag + + ē= Ag  H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. H2O 2H2O — 4ē = О2 + 4H + На катоде выделяется Ag, на аноде выделяется О2. |
Молярная концентрация эквивалента раствора AgNO3:

nэк(Ag) = 
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току.
mAg = 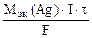

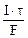
Молярная концентрация эквивалента раствора AgNO3:


где τ – c, F – 96500 Кл/моль, Vр-ра – л.
60 – коэффициент пересчета мин. в сек.
10 -3 – коэффициент пересчета см 3 в л.
Ответ: 
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Электрохимическая коррозия металлов.
ЛАБОРАТОРНАЯ РАБОТА №9
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Работу выполнил_____________ Работу принял________________
Дата выполнения_____________ Отметка о зачете______________
Основные понятия
Характерной особенностью окислительно-восстановительных реакций является возможность пространственного разделения процессов окисления и восстановления, т.е. проведения их на отдельных электродах. Окислительно-восстановительный процесс, протекающий на электродах, называется электрохимическим.
Электрод представляет собой систему, включающую проводник электронов и окислительно-восстановительную пару. В общем случае между окислителем (О) и соответствующим ему восстановителем (В) устанавливается равновесие: О + ne Û В.
В зависимости от условий на любом электроде может быть осуществлен как окислительный так и восстановительный процесс. Электрод, на котором протекает процесс окисления, называется анодом. Электрод, на котором протекает процесс восстановления, называется катодом.
Если материал электрода не принимает участия в окислительно-восстановительном процессе, электрод называется инертным (к ним относятся электроды из графита и благородных металлов). Если материал проводника участвует в электрохимическом процессе, электрод называется активным или растворимым (большинство металлических электродов).
Электрохимический процесс, как и любая окислительно-восстановительная реакция, представляет собой совокупность процессов окисления и восстановления, протекающих одновременно. Поэтому он может осуществляться только при наличии двух электродов: анода, на котором идет окисление и катода, на котором идет восстановление.
В состоянии равновесия каждый электрод (окислительно-восстановительная пара) характеризуется величиной стандартного электродного потенциала (Е°О/В), измеренного относительно стандартного водородного электрода, потенциал которого принимается равным нулю Е°2Н + /Н2 = 0 В.
Электродный потенциал зависит от химической природы окислителя и восстановителя, температуры и концентраций ионов в растворе. Для металлических электродов, равновесие в которых можно выразить общим уравнением Ме n + +ne – Û Me, электронный потенциал рассчитывается по уравнению Нернста:
Е Ме n + /Ме =Е° Ме n + /Ме + (RT/nF)ln C Ме n + = Е° Ме n + /Ме+ (0,059/n) lg C Ме n + , (l) где C Ме n + — концентрация ионов металла в растворе, F = 96500 Кл/моль – постоянная Фарадея.
Гальванический элемент
Двухэлектродная система, в которой самопроизвольно протекает окислительно-восстановительный процесс, называется гальваническим элементом. При протекании электрохимического процесса в гальваническом элементе передача электронов от восстановителя к окислителю осуществляется через внешний участок цепи, в котором создается направленный поток электронов – электрический ток. Таким образом гальванический элемент представляет собой систему, в которой происходит самопроизвольное превращение химической энергии в электрическую, т.е. гальванический элемент является источником электрического тока.
ПРИМЕР 1. Гальванический элемент с железным и серебряным электродами.
Гальванический элемент состоит из двух электродов, каждый из которых представляет собой металлическую пластинку, помещенную в раствор соли соответствующего металла.
Электрическая цепь гальванического элемента состоит из внешнего и внутреннего участов. Внешний участок цепи соединяет металлические пластинки электродов через потребителя электрической энергии или электроизмерительный прибор. Внутренний участок цепи соединяет растворы солей через «солевой мостик» — трубку, заполненную раствором сильного электролита.
Гальванические элементы принято обозначать условными схемами. Схема гальванического элемента записывается начиная с анода и включая в себя последовательное обозначение фаз, находящихся в непосредственном контакте. Граница раздела фаз обозначается вертикальной чертой. Для рассматриваемого гальванического элемента схема записывается: Fe | Fe (NО3)2| | AgNО3| Ag.
Характер электродных процессов определяется значениями электродных потенциалов. Окисление протекает на электроде, включающем более сильный восстановитель, т.е. анодом (отрицательным полюсом гальванического элемента) является электрод с меньшим значением электродного потенциала. Электрод с большим значением электродного потенциала является катодом гальванического элемента (положительным полюсом).
Разность потенциалов катода (Ек) и анода (Еа) представляет собой электродвижущую силу (ЭДС) гальванического элемента:
Е = Ек – Еа (величина всегда положительная!)
Таким образом, полная схема рассматриваемого гальванического элемента, включающая уравнения электродных процессов выглядит так:
Анод — Fe | Fe 2 ׀ | | Ag ׀ | Ag + Катод
Е° Fe 2+ / Fe = — 0,44 В Е° Ag + / Ag = 0,8 В
Анодный процесс Fe = Fe 2+ +2е — окисление
Катодный процесс Ag + + еˉ = Ag восстановление
Суммарное уравнение Fe+2 Ag + = Fe 2+ +2 Ag
Стандартная (ЭДС): Е° = Е°к — Е°а = Е° Ag + / Ag — Е° Fe 2+ / Fe =0,8 – (-0,44) = 1,24В
Для условий, отличных от стандартных, электронные потенциалы рассчитываются по уравнению Нернста. (см. ур.1)
Электролиз растворов
Электролиз – процесс окисления – восстановления протекающий на электродах при пропускании через электролит постоянного электрического тока.
При электролизе электроды включаются в цепь внешнего источника постоянного тока. Под действием приложенной разности потенциалов положительные ионы – катионы – перемещаются к отрицательному полюсу внешнего источника, отрицательные ионы- анионы – к положительному. На аноде и катоде протекают процессы окисления и восстановления соответственно.
Электролизу могут подвергаться как расплавы, так и растворы электролитов. Характерным для электролиза водных растворов является то, что в электродных процессах могут участвовать кроме ионов растворенных электролитов молекулы растворителя – воды, а также материал самого электрода (если электрод активный). Таким образом, на электроде теоретически могут протекать несколько окислительно-восстановительных процессов. Однако в первую очередь могут протекать энергетически выгодные процессы, а именно: на аноде окисляется наиболее сильный восстановитель (с наименьшим значением электродного потенциала); на катоде восстанавливается наиболее сильный окислитель (с наибольшим значением электродного потенциала).
ПРИМЕР 2. Электролиз раствора сульфата никеля (с активным – никелевым анодом).
Напишем уравнение диссоциации соли и укажем направление движения ионов к электродам:
Составляем уравнение возможных электродных процессов и выписываем из справочных таблиц значения соответствующих электродных потенциалов:
Анод (окисление): Катод (восстановление):
2SO4 2- = S2O8 2- + 2 еˉ Е°=2,01В Ni 2+ +2 еˉ= Ni Е°= −0,25 В
2Н2О = 4Н + + О2 + 4 еˉ Е° =1,23В 2Н2О+2 еˉ= 2ОН + Н2 Е°=−0,83 В
Ni= Ni 2+ +2 еˉ Е°= −0,25 В −растворение никелевого анода.
Сопоставляя значения электродных потенциалов для анодного и катодного процессов, делаем вывод о преимущественном протекании процесса электролиза на каждом электроде: на аноде идет окисление никеля (наименьший потенциал), на катоде идет выделение металлического никеля (наибольший потенциал). Суммируя уравнения анодного и катодного процессов, получаем полное уравнение электролиза: Ni + Ni 2+ = Ni 2+ + Ni. Записанное уравнение показывает, что при электролизе с растворимым анодом происходит перенос материала анода на катод.
Электрохимическая коррозия металлов.
Коррозией металлов называется процесс их разрушения в результате взаимодействия с окружающей средой. Коррозия металлов может протекать по химическому и электрохимическому механизму. Химическая коррозия является следствием химического взаимодействия металла с тем или иным окислителем окружающей среды. Электрохимическая коррозия в простейшем случае протекает вследствие работы на поверхности металла короткозамкнутых гальванических элементов – гальванопар.
Причин образования короткозамкнутых гальванопар множество: например, кристаллическая неоднородность металла, микрошероховатость поверхности, наличие примесей и пр. все это приводит к тому, что различные участки поверхности имеют различные значения электродного потенциала, т.е. поверхность металла может рассматриваться как совокупность электродов, одни из которых в условиях контакта поверхности с электролитом окружающей среды будут играть роль анода, другие катода. В отличие от обычных гальванических элементов анод и катод гальванопар на поверхности металла имеют общий электролит.
В типичных случаях электрохимической коррозии короткозамкнутые гальванопары имеют микроскопические размеры и потому называются микрогальванопарами. Коррозию металла вызывает работа не всех микрогальванопар, а лишь тех, в которых металл играет роль анода. Общую схему таких микрогальванопар можно записать следующим образом:
А − Ме │электролит окружающей среды│катодный участок + К
При работе таких микрогальванопар коррозию металла вызывает процесс его анодного окисления: Ме = Ме n + +neˉ. На катодных участках происходит восстановление окислителя электролита. В кислой среде восстанавливаются ионы Н + согласно уравнению: 2Н + + 2еˉ = Н2. В остальных случаях протекает процесс восстановления атмосферного кислорода с участием воды: О2 + 2Н2О + 4 еˉ = 4ОН‾
ПРИМЕР 3: электрохимическая коррозия железа в кислой среде.
В качестве конкретного примера рассмотрим коррозию железа в воздухе, содержащем сернистый газ SO2. На поверхности железа в данном случае образуется пленка сернистой кислоты вследствие взаимодействия сернистого газа с парами воды: SO2 +Н2О = Н2 SO3. Записываем схему микрогальванопар, работа которых в рассматриваемых условиях будет приводить к коррозии железа:
А — Fe| Н2 SO3| катодный участок +К
Записываем уравнение электродных процессов, протекающих при работе таких микрогальванопар:
А: Fe = Fe 2+ +2е‾ − окисление железа на анодных участках (коррозия железа)
К: 2Н + + 2еˉ = Н2 − восстановление ионов Н + на катодных участках.
Fe + 2Н + = Fe 2+ +Н2 − суммарное уравнение электрохимической коррозии.
ПРИМЕР 4: Атмосферная коррозия железа.
Атмосферная коррозия – это электрохимическая коррозия металлов, протекающая в нейтральной среде. Коррозия железа в данных условиях происходит вследствие работы микрогальванопар: А − Fe| O2 , Н2О | катодный участок +К. процессы, протекающие при работе таких микрогальванопар, выражаются следующими уравнениями:
А: Fe = Fe 2+ +2е — − окисление железа на анодных участках (коррозия железа)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на катодных участках
2 Fe + О2 + 2 Н2О = 2 Fe 2+ +4ОН‾ − суммарное уравнение электрохимической коррозии.
Чтобы предохранить металл от разрушения применяются разнообразные способы защиты от электрохимической коррозии, но все они имеют одно общее: обеспечение условий, предотвращающих работу микрогальванопар.
Наиболее распространенным является метод защиты от коррозии путем создания на поверхности металлов изолирующих покрытий: лакокрасочные покрытия, покрытие металлов другими металлами и пр. Механизм защитного действия изолирующих покрытий заключается в том, что они предотвращают доступ окружающей среде к поверхности металла, тем самым делая невозможным работу микрогальванопар (для работы микрогальванопар необходимы не только анодный и катодный участки, но и электролит). При разрушении покрытия, даже незначительном, в месте нарушения сплошности открывается доступ окружающей среды к поверхности металла и тем самым создаются условия для работы микрогальванопар.
Среди изолирующих защитных покрытий особое место занимают металлические покрытия. По механизму коррозионного разрушения при нарушении целостности покрытия различают анодные и катодные металлические покрытия.
Если электродный потенциал металла покрытия меньше электродного потенциала защищаемого металла, то по отношению к защищаемому металлу металл покрытия является анодом. Поэтому такие металлические покрытия называются анодными. При работе гальванопар в местах нарушения сплошности анодного покрытия разрушается металл покрытия (анод), а защищенный металл (катод) не разрушается.
Если же электродный потенциал металла покрытия больше электродного потенциала защищаемого металла, такое покрытие называется катодным, т.к. по отношению к защищаемому металлу металл покрытия является катодом. Поэтому при работе гальванопар в местах нарушения сплошности катодного покрытия коррозии подвергается защищаемый металл.
ПРИМЕР 5: коррозионные процессы в нейтральной среде при нарушении сплошности анодного и катодного покрытия на железе.
Для железа (Е°= −0,44 В) анодным является покрытие из любого металла с меньшим значением электродного потенциала, например, цинк (Е°= −0,76 В). при нарушении сплошности такого покрытия в нейтральной среде будут работать гальванопары: А–Zn | O2 , Н2О | Fe + К. анодный и катодный процессы, протекающие при том, выражаются уравнениями:
А: Zn = Zn 2+ +2е — − окисление цинка (коррозия металла покрытия)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на железе.
2Zn + О2 + 2 Н2О = 2 Zn 2+ +4ОН‾ − суммарное уравнение электрохимической коррозии.
Из записанных уравнений видно, что цинк (и любое анодное покрытие) защищает железо от коррозии не только, пока оно цело, но и в случае нарушения сплошности покрытия.
Для создания на железе катодного покрытия необходимо использовать любой металл с большим значением электродного потенциала, например, никель (Е°= −0,25 В). При нарушении сплошности никелевого покрытия в нейтральной среде будут работать гальванопары: А– Fe | O2 , Н2О | Ni + К. Анодный и катодный процессы при работе данных гальванопар следующие:
А: Fe = Fe 2+ +2е — − окисление железа (коррозия защищаемого металла)
К: О2 + 2Н2О + 4 еˉ = 4ОН‾ − восстановление на никеле.
2 Fe + О2 + 2 Н2О = 2 Fe 2+ +4ОН‾ − суммарное уравнение электрохимической коррозии.
Как видим, при нарушении сплошности катодное покрытие не защищает железо от коррозии.
Из всех случаев коррозии металлов наиболее типичной и часто встречающейся является коррозия железа (сплавов железа). Из выше рассмотренных примеров видно, что электрохимическая коррозия железа заключается в его анодном окислении, в результате чего образуются ионы Fe 2+ во внешней среде. Для этого в лабораторной работе используется качественная реакция с красной кровяной солью К3 |Fe (CN6)|. Данная качественная реакция заключается в том, что комплексные ионы красной кровяной соли, взаимодействуя с ионами Fe 2+ , образуют соединение с характерной синей окраской –турнбулеву синь Fe 3|Fe (CN)6|2 : 3 Fe 2+ +2|Fe (CN6)| 3- = Fe 3|Fe (CN)6|2
Экспериментальная часть
ОПЫТ 1.Гальванический элемент.
Рассматривается гальванический элемент с медным и цинковым электродами.
Получите у преподавателя индивидуальное задание для оформления расчетной части опыта концентрации растворов: CCuSO4 = CZnSO4 =
1) Соберите гальванический элемент с гальванометром во внешней цепи.
2) Замкните электроды проводником электронов и наблюдайте работу гальванического элемента по отклонению стрелки гальванометра.
3) Запишите схему гальванического элемента (см. ПРИМЕР 1).
4) В записанной схеме укажите направление перемещения электронов.
5) Выпишите значение стандартных электродных потенциалов (см. ПРИЛОЖЕНИЕ).
6) По уравнению Нернста (ур. 1) рассчитайте значение электродного потенциала каждого электрода согласно полученному индивидуальному заданию.
7) Составьте уравнение электродных процессов и общее уравнение электрохимического процесса.
8) Рассчитайте стандартную ЭДС гальванического элемента и ЭДС, отвечающую полученному индивидуальному заданию.
ОПЫТ 2. Электролиз растворов.
Электролиз проводится в электролизере –U-образной трубке, заполненной раствором электролита, в которую помещаются графитовые электроды. Напряжение на электроды подается через выпрямитель тока в течении 0,5 ÷ 1 мин. Определение продуктов электролиза производится визуально (выделение газа, осаждение металла; изменение окраски раствора, изменение окраски индикатора).
2.1. Электролиз раствора иодида калия.
Проведите процесс электролиза. Отключите источник питания. Удалите электроды из электролизера и промойте их дистиллированной водой.
В катодное колено электролизера добавьте 2-3 капли раствора фенолфталеина, в анодное пространство электролизера добавьте несколько капель раствора крахмала. Все наблюдения отметьте в таблице.
1) Запишите уравнение диссоциации соли: КI =
2) В таблице запишите уравнения теоретически возможных электродных процессов и выпишите значения соответствующих электродных потенциалов (см. ПРИЛОЖЕНИЕ).
3) Сделайте вывод о характере электродных процессов. Сопоставьте вывод с опытными данными.
4) Соответственно этому заполните последнюю колонку таблицы.
| Электрод | наблюдения | Возможные процессы | Е°, В | Продукты электролиза |
| Анод (окисление) | ||||
| Катод (восстановление) |
5) Запишите полное уравнение процесса электролиза:
2.2. Электролиз раствора сульфата натрия.
Проведите процесс электролиза. Отключите источник питания. Удалите электроды из электролизера и промойте их дистиллированной водой.
В катодное и анодное пространство электролизера добавьте несколько капель раствора лакмуса. Все наблюдения отметьте в таблице.
1) Запишите уравнение диссоциации соли: Na2SO4 =
2) В таблице запишите уравнения теоретически возможных электродных процессов и выпишите значения соответствующих электродных потенциалов (см. ПРИЛОЖЕНИЕ).
3) Сделайте вывод о характере электродных процессов. Сопоставьте вывод с опытными данными.
4) Соответственно этому заполните последнюю колонку таблицы.
| Электрод | наблюдения | Возможные процессы | Е°, В | Продукты электролиза |
| Анод (окисление) | ||||
| Катод (восстановление) |
5) Запишите полное уравнение процесса электролиза:
2.3. Электролиз раствора сульфата меди.
Проведите процесс электролиза. Отключите источник питания. Удалите электроды из электролизера. Осмотрите поверхность электродов. Все наблюдения отметьте в таблице.
1) Запишите уравнение диссоциации соли: CuSO4 =
2) Сделайте вывод о характере электродных процессов. Сопоставьте вывод с опытными данными.
3) Соответственно этому заполните последнюю колонку таблицы.
| Электрод | наблюдения | Возможные процессы | Е°, В | Продукты электролиза |
| Анод (окисление) | ||||
| Катод (восстановление) |
4) Запишите полное уравнение процесса электролиза:
2.4. Электролиз раствора сульфата меди с растворимым анодом.
Измените полярность полюсов электродов. Таким образом, электрод с осажденной на нем медью, полученной в предыдущем опыте, будет анодом.
Проведите процесс электролиза. Отключите источник питания. Удалите электроды из электролизера. Осмотрите поверхность электродов. Все наблюдения отметьте в таблице.
1) Составьте уравнения теоретически возможных электродных процессов и выпишите значения соответствующих электродных потенциалов (см. ПРИЛОЖЕНИЕ).
2) Сделайте вывод о характере электродных процессов. Сопоставьте вывод с опытными данными.
3) Соответственно этому заполните последнюю колонку таблицы.
| Электрод | наблюдения | Возможные процессы | Е°, В | Продукты электролиза |
| Анод (окисление) | ||||
| Катод (восстановление) |
4) Запишите полное уравнение процесса электролиза:
ОПЫТ 3: Электрохимическая коррозия металлов.
3.1. Роль гальванопар в процессах электрохимической коррозии.
В пробирку внесите 5-6 капель разбавленной H2SO4 и гранулу цинка. Наблюдать выделение газа-водорода. 1) Запишите уравнение химической реакции:
Коснитесь медной проволокой поверхности цинка. Как изменяется интенсивность газовыделения?
2) На каком металле происходит выделение газа?
3) Объясните наблюдаемое явление, записав схему гальванопары, образующейся при контакте цинка с медью. Обозначьте в ней анод и катод, запишите уравнения электродных реакций и суммарное уравнение электрохимического процесса.
3.2. Коррозия оцинкованного и луженого железа.
2 химических стакана заполните (на половину объема) 3%растворами NaCl и в каждый из них добавьте по 3-4 капли раствора Fe 3|Fe (CN)6|. В один стакан опустите железную пластинку, покрытую цинком, в другой – покрытую оловом (луженую). На пластинах предварительно нанесите глубокие царапины.
Через несколько минут в одном из стаканов наблюдайте окрашивание раствора в синий цвет.
1) Какая реакция протекает в этом стакане? Запишите ее уравнение:
2) Какая пластинка находится в этом стакане?
3) Происходит ли коррозия железа в данном случае? Ответ мотивируйте, записав для каждой из 2-х пластинок схемы гальванопар, уравнение электродных реакций и уравнение электрохимического процесса.
4) Определите тип покрытия (анодное или катодное) для каждой пластинки.
Вариант контрольного теста
I. Какие реакции могут протекать самопроизвольно в стандартных условиях:
1). Cu + NiSO4 = 2). Fe + ZnCl2 = 3).Al + NiCl2 = 4).Cu + AgNO3 =
II. Концентрация ионов никеля в растворе 1 моль/л. определите электродный потенциал никелевого электрода:
1).- 0,25 В 2).0,25 В 3).0 В 4).-0,264 В
III. Катодом гальванического элемента является свинец Pb. Анодом может быть электрод:
1).Cu 2+ /Cu 2). Fe 2+ /Fe 3).Ni 2+ /Ni 4).Zn 2+ /Zn
IV. В гальваническом элементе Zn |Zn 2+ | |H + |H2 на аноде происходит процесс:
1). Zn 2+ + 2еˉ = Zn 2). Н2 = 2Н + + 2еˉ 3). Zn = Zn 2+ + 2еˉ 4). 2Н + + 2еˉ = Н2
V. Величина стандартной ЭДС гальванического элемента Zn |Zn 2+ | |H + |H2 равна:
1). 0 В 2). 0,76 В3). – 0,76 В 4). 1,1 В
VI. В процессе электролиза происходит преобразование:
1). Электрической энергии в химическую 2). Химической энергии в
VII. При электролизе расплава NaOH с инертными электродами на катоде протекает процесс:
1). 4ОН‾ = О2 + 2Н2О + 4 еˉ 2). Na + + еˉ = Na
3). О2 + 2Н2О + 4 еˉ = 4ОН‾ 4). Na = Na + + еˉ
VIII. При электролизе раствора CuSO4 с медным анодом на аноде протекает процесс:
1). Cu = Cu 2+ + 2еˉ 2). 2Н2О = О2 + 4Н + + 4еˉ
3). Cu 2+ + 2еˉ = Cu 4). О2 + 4Н + + 4еˉ = 2Н2О
IX. В растворе содержатся ионы Sn 2+ ,Ag + ,Cu 2+ в одинаковой концентрации. В какой последовательности они будут восстанавливаться при электролизе раствора:
1). Sn 2+ ,Ag + ,Cu 2+ 2). Ag + ,Sn 2+ , Cu 2+
3). Ag + ,Cu 2 + ,Sn 2+ 4). Cu 2+ ,Sn 2+ ,Ag +
X. При электролизе водного раствора величина рН среды в катодном пространстве:
1). Уменьшается 2). Увеличивается3). Не изменяется
правильные ответы выделены жирным шрифтом.
Контрольные вопросы.
I. Один из электродов гальванического элемента – железный. Другой электрод:
1). Zn 2+ /Zn 2). Sn 2+ /Sn 3). Mn 2+ /Mn 4). Pb 2+ /Pb 5). Ni 2+ /Ni
Запишите схему гальванического элемента, составьте уравнения электродных процессов и суммарное уравнение электрохимического процесса, рассчитайте значение стандартной ЭДС.
II. Гальванический элемент состоит из двух железных электродов. Электролитом каждого электрода является раствор хлорида железа (II). Раствор соли одного электрода 0,01 моль/л, концентрация раствора соли равна:
1). 0,1 моль/л 2). 10 -3 моль/л 3) 1 моль/л 4). 10 -4 моль/л 5).10 -5 моль/л
Запишите схему гальванического элемента, составьте уравнения электродных процессов и суммарное уравнение реакции, рассчитайте ЭДС.
III. Составьте уравнение электродных процессов, протекающих на инертных электродах при электролизе водного раствора:
Напишите молекулярное и ионо-молекулярное уравнение электролиза.
📸 Видео
Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Электрохимическая коррозия (алюминий — медь)Скачать

Электродные потенциалы металлов. Электроды сравненияСкачать

Коррозия металловСкачать

§13, 9 кл. Коррозия металловСкачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Ингибиторы коррозииСкачать

Электрохимическая коррозия в кислой средеСкачать

Классификация коррозионных процессовСкачать

Химия 9 Коррозия металловСкачать

Коррозия металлов и способы защиты от неё. Видеоурок 25. Химия 9 классСкачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

9 класс § 20 "Коррозия металлов и способы защиты от нее".Скачать

Межкристаллитная коррозияСкачать

Урок 22. Коррозия металлов. Химия 11 классСкачать


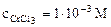 ε — ?
ε — ?


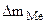 = 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
= 3,7·10 -3 г. S = 20 см 2 ρFe = 7,9 г/см 3 Km — ? П -?
 = 560 см 3 Анод инертный 1. Схема электролиза-? 2.
= 560 см 3 Анод инертный 1. Схема электролиза-? 2.  -? 3.
-? 3.  -? 4.
-? 4.  -?
-?

