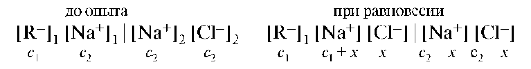Измерения осмотического давления растворов ВМС полиэлектролитов могут быть связаны с ошибками, вызванными присутствием электролитов. Во избежание ошибок необходимо вводить поправки на мембранное равновесие. Теория мембранного равновесия была создана в 1911 г. английским физикохимиком Ф. Доннаном.
Мембранным равновесием Доннана (эффект Доннана) называют равновесие, устанавливающееся в системе растворов, разделенных мембраной, непроницаемой хотя бы для одного вида присутствующих в системе ионов.
Задерживаемый мембраной ион называется недиализируемым. Присутствие такого иона приводит к неравномерному распределению ионов по обе стороны мембраны при равновесном состоянии системы.
Пусть слева от мембраны находится белок в виде соли RNa, где R — — анион, имеющий коллоидные размеры и не проходящий через мембрану. Справа находится раствор NaCl, для ионов которого мембрана проницаема:
При равновесии произведение концентраций диффундирующих ионов по обе стороны мембраны должно быть одинаковым (недиализуемые ионы в расчет не принимаются). Тогда: (c1 + x)x = (c2 — x)2.
При c1 = 0х = ½с2 концентрация NaCl в равновесных растворах одинакова. При c1 >> c2 значение х очень мало, т.е. NaCl практически не переходит через мембрану, и осмотическое давление определяется только полиэлектролитом. При c1
Дата добавления: 2015-05-26 ; просмотров: 9740 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Обратимые и необратимые реакции | Химическое равновесие и условия его смещенияСкачать

МЕМБРАННОЕ РАВНОВЕСИЕ ДОННАНА
Наличие в клетках ионов полиэлектролитов, ионов белков или гранул лиофобных коллоидов, которые в отличие от низкомолекулярных ионов обычных электролитов, не могут диффундировать сквозь мембрану приводит к установлению мембранного равновесия Доннана.
Мембранным равновесием Доннана называют равновесие, устанавливающееся в системе растворов, разделённых мембраной, непроницаемой хотя бы для одного вида ионов, присутствующих в системе.
Рассмотрим случай равновесия двух электролитов с одним общим ионом (Cl ‾ ) между двумя жидкостями, разделёнными полупроницаемой мембраной. Эта мембрана является проницаемой для всех ионов, кроме одного (его называют недиализуемым ионом).
Пусть вначале опыта во внутренней части осмотической ячейки осмометра налит раствор электролита RCl. Электролит диссоциирует, образуя положительные ионы R + (они не могут проходить через мембрану) и ионы Cl ‾ , которые свободно проходят через мембрану. Концентрации тех и других ионов равны С1, то есть [R] = C1 и [Cl ‾ ] = C1. Всё это справедливо для внутренней жидкости.
Во внешней жидкости (она занимает такой же объём как и внутренняя) имеются ионы Na + и Cl ‾ , но их концентрации уже другие и равны С2: [Na + ] = C2 и [Cl ‾ ] = C2.
В начале опыта мы имеем систему:
Внутренняя жидкость ( i) Мембрана внешняя жидкость (e)
Каковы будут концентрации ионов по обе стороны мембраны после наступления равновесия?
Оказалось, что в системе устанавливается равновесие следующего вида:
Внутренняя жидкость (i) Мембрана внешняя жидкость (e)
Причём Х является функцией обеих начальных концентраций С1 и С2.
Доннан, учитывая законы и положения термодинамики, пришел к выводу, что условием равновесия является равенство произведений концентраций ионов, находящихся внутри ячейки и в наружной жидкости:
условием равновесия Доннана является равенство произведений концентраций подвижных ионов по обе стороны мембраны.
Подставим в приведенное произведение концентраций их численные значения:
Х =
Полученное выражение называют уравнением Доннана. Оно показывает количество низкомолекулярного вещества (Х), переносимого в сторону ВМС через полупроницаемую перегородку.
Из уравнения Доннана следует, что при С1 = 0 Х = С2/2, т.е. при отсутствии недиффундирующих ионов полиэлектролита или гранул мицеллы лиофобного золя распределение NaCl будет равномерным. Если же С1 » С2, то величина Х очень мала. То есть в этом случае свободно диффундирующий NaCl всё же не может свободно проникать внутрь мембраны, а поэтому распределение NaCl по обе стороны мембраны будет неодинаковым.
За счёт присутствия в клетке солей белка сумма концентраций подвижных ионов внутри клетки всегда будет больше, чем в наружном растворе. Неравномерное распределение ионов по обе стороны мембраны приводит к возникновению разности потенциалов, которая может быть измерена в виде так называемого мембранного потенциала, например, в следующей цепи:
Каломельный внешний внутренний каломельный
Электрод раствор раствор электрод
с насыщ. KCl с нас. KCl
В организме доннановский эффект имеет большое значение для распределения электролитов между кровью и лимфой, для возникновения биопотенциалов.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какие дисперсные системы называются коллоидными растворами?
2. Как можно классифицировать методы получения коллоидных растворов?
3. В чём состоит сущность метода диспергирования? Какое оборудование используют для этого?
4. Охарактеризуйте методы получения коллоидных систем путём конденсации.
5. Какие условия должны соблюдаться при получении коллоидных систем путём химической конденсации?
6. Какие методы очистки коллоидных систем вам известны? Охарактеризуйте их.
7. Каково строение мицеллы лиофобного золя?
8. Какие вы знаете пути образования ДЭС?
9. Каково строение ДЭС?
10. В чём состоит отличие электрокинетического потенциала от термодинамического?
11. Какие электрокинетические явления вы знаете? В чём состоит сущность каждого из них?
12. Как экспериментально определяют величину дзета-потенциала?
13. Каково строение мицеллы лиофобного золя?
14. В каких случаях при добавлении электролита происходит перезарядка коллоидной частицы?
15. Являются ли коллоидные системы термодинамически устойчивыми?
16. Чем определяется седиментационная устойчивость дисперсных систем? Являются ли коллоидные системы седиментационно устойчивыми?
17. Какие факторы агрегативной устойчивости лиофобных золей вам известны?
18. Сформулируйте правила коагуляции золей электролитами.
19. В чём состоит сущность теории ДЛФО? Что называется расклинивающим давлением?
20. Какие случаи коагуляции смесью электролитов вы знаете?
21. В чём заключается защитное действие и сенсибилизация?
22. Напишите формулы мицелл следующих золей:
а) золя карбоната бария ВаСО3, стабилизированного хлоридом бария;
б) золя сульфида свинца PbS, стабилизированного сульфидом натрия;
в) золя бромида серебра AgBr, стабилизированного нитратом серебра;
г) золя гидроксида железа Fe(OH)3, стабилизированного Fe(NO3)3;
д) золя хлорида свинца PbCl2, стабилизированного хлоридом калия;
е) золя сульфата бария BaSO4, стабилизированного сульфатом калия.
Видео:Потенциал покоя и равновесный потенциалСкачать

Доклад на тему «Мембранное равновесие Доннана»
Мембранное равновесие, связанное с различием концентрации солей внутри и вне клеток, известно давно. В 1911 г. Ф. Доннан объяснил это явление, впоследствии названное его именем.
Мембранное равновесие Доннана связано с переносом некоторого количества вещества низкомолекулярного электролита внутрь пространства, содержащего полимер, и, вследствие этого, неравномерного распределения концентраций этого электролита по обе стороны полупроницаемой мембраны.
Пусть в некоторый начальный момент времени концентрации ионов низкомолекулярного и высокомолекулярного соединений по обе стороны мембраны распределяются следующим образом:
В левой части сосуда, разделенного полупроницаемой мембраной, находится раствор полимера, который в результате диссоциации представлен поликатионом R(Z+) и противоионом Cl–, концентрации которых равны соответственно C1 и ZC1. В левой части – раствор низкомолекулярного электролита, например KCl, с концентрацией С2, диссоциирующий на К+ и Cl–. При установлении равновесия вследствие диффузии в такой системе малые ионы K+ перемещаются преимущественно из правой части сосуда в левую. Макрокатионы R(Z+) не могут проникать через мембрану, поэтому для сохранения электронейтральности вместе с катионами K+ справа налево происходит перемещение избыточного числа анионов Cl–. В результате этих процессов концентрация низкомолекулярного электролита в растворе ВМС повышается:
Условием равновесия является равенство произведений концентраций электролитов в левой и правой части сосуда, разделенного полупроницаемой мембраной:
Подставляя обозначения из рис.2, имеем уравнение:
X (ZC1 + X) = (C2 – X)2
Нужна помощь в написании доклада?
Мы — биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Решая это уравнение относительно X, получаем:
Это и есть уравнение Доннана, которое показывает количество низкомолекулярного вещества, переносимого в фазу ВМС через полупроницаемую мембрану. Из него следует вывод, что низкомолекулярный электролит распределяется неравномерно по обе стороны мембраны. Перенос вещества всегда существует из внешнего раствора во внутренний, в результате чего во внутреннем растворе наблюдается более высокая концентрация переносимых электролитов по сравнению с внешним раствором. Этим же объясняется некоторый избыток осмотического давления в растворах, содержащих ВМС и электролиты.
Если концентрация низкомолекулярного электролита намного больше концентрации полимера (С2 >> C1), то X = C2/2, т.е. при малых концентрациях макроионов и больших концентрациях малых ионов наблюдается равномерное распределение малых ионов по обе стороны мембраны.
🎦 Видео
Условия смещения химического равновесия. 9 класс.Скачать

3. Gibbs-Donnan EquilibriumСкачать

Урок 70. Виды равновесия. Условие равновесия тела при отсутствии вращения.Скачать

Техническая механика/ Определение равнодействующей. Плоская система сходящихся сил.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

Лекция 84 Мембранный потенциалСкачать

Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Равновесие в системе диоксида азота и его димерСкачать

Урок 133. Закон Бернулли. Уравнение БернуллиСкачать

Смещение равновесия в растворе аммиака при нагреванииСкачать