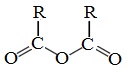
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
Классификация. Номенклатура
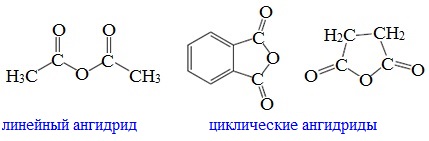
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот:
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
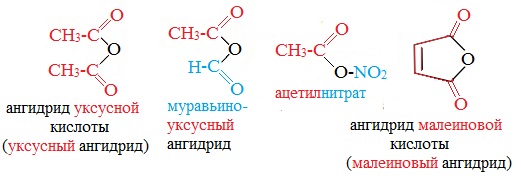
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).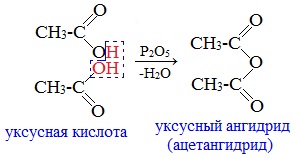
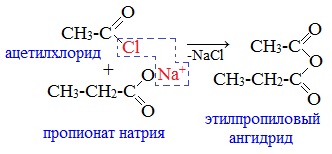
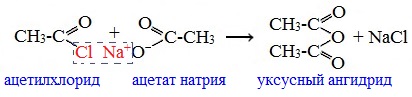
2. Взаимодействием галогенангидридов с солями карбоновых кислот
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот:
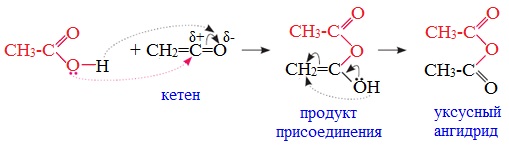
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
Характеристика реакционной способности
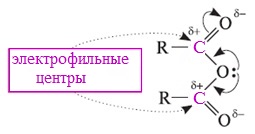
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами . Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
Химические свойства
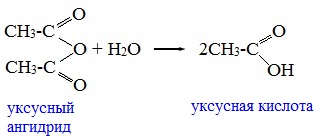
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
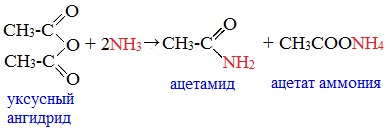
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
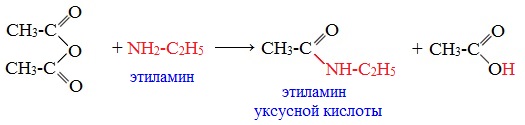
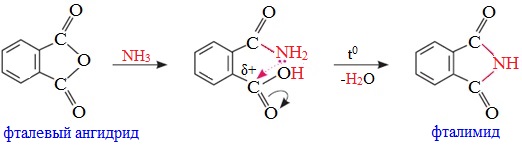
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
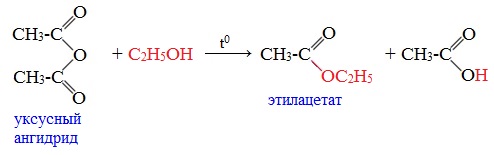
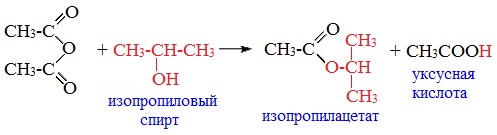
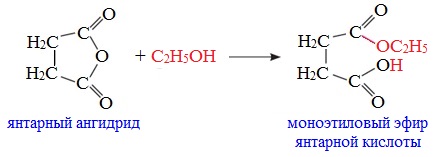
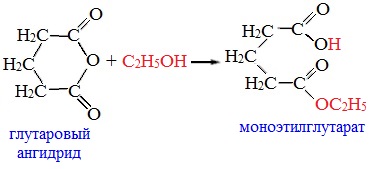
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
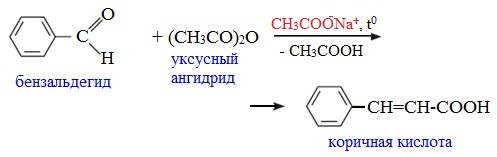
4. Реакции α-водородного атома
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
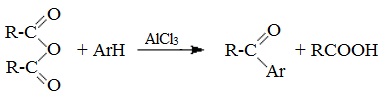
5. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
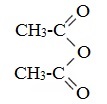
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
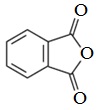
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать  Уксусный ангидрид химические свойства уравненияПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ Функциональные производные карбоновых кислот можно рассматривать как результат замещения гидроксильной группы кислоты на какую-либо другую группу Х. Эти вещества могут быть гидролизованы в кислоту в соответствии с уравнением. Общим элементам структуры этих соединений является ацильная группа Однако нитрилы R-C º N также часто рассматриваются как производные карбоновых кислот, поскольку их гидролиз приводит к карбоновым кислотам. Соединения этого ряда выражаются формулой: Названия соединений этого ряда складывается из названия ацильного радикала и галогена с окончанием «ид».
Так получают бромиды и хлориды.
Эти реакции лежат в основе синтеза ацилхлоридов. Физические свойства и строение Ацилгалогениды представляют собой бесцветные жидкости или кристаллические вещества с острым запахом, легколетучие, на воздухе «дымят». Низшие ацилфториды газообразны. В воде растворяются плохо, но быстро с ней реагируют. В ацильной группе заряд на карбонильном углероде существенно завышен по сравнению с карбонильным углеродом карбоновых кислот из-за сильных электроакцепторных свойств атомов галогенов Это обусловливает высокую склонность галогенангидридов к взаимодействию с нуклеофильными реагентами. Реакции нуклеофильного замещения Ацилгалогениды легко реагируют с различными нуклеофильными реагентами, причем эти реакции не требуют катализа. Общая схема этих реакций может быть представлена уравнениями Важными реакциями нуклеофильного замещения по ацильному углероду являются:
По этому суммарно реакцию можно представить следующей схемой
Реакция с диазометаном (реакция Арндта-Эйстерта) Эта реакция является синтетическим средством увеличения длины углеводородных цепей органических соединений на один атом углерода. Строение ангидридов выражается следующей общей формулой
Таким способом получают несимметричные ангидриды.
Химические свойства ангидридов карбоновых кислот Одна ацильная группа действует на другую как сильный акцептор, поэтому на карбонильном атоме углерода концентрируется достаточно высокий положительный заряд. Это обусловливает высокую реакционную способность ангидридов в реакциях нуклеофильного замещения Реакция нуклеофильного замещения А нгидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами, хотя скорость реакции меньше, чем в случае ацилгалогенидов. Общий механизм реакции ангидридов карбоновых кислот с нуклеофилом может быть представлен схемой: Можно видеть, что в результате реакции кроме продукта нуклеофильного замещения образуется карбоновая кислота. Важнейшими реакциями нуклеофильного замещения с участием ангидридов карбоновых кислот является: (RCO)2O + R’OH ® RCOOR’ + RCOOH
Кетен формально может рассматриваться как ангидрид уксусной кислоты. Кетен получают следующими методами:
Химическое поведение кетена определяют два фактора: напряженность молекулы и высокий положительный заряд на карбонильном углероде Наиболее типичными реакциями кетенов являются реакции нуклеофильного присоединения. Наиболее важными среди этих являются реакции гидратации, образования ангидридов сложных эфиров и амидов карбоновых кислот: Поскольку в результате этих реакций не образуется каких-либо других продуктов, то кетен является идеальным ацилирующим агентом. Сложные эфиры – производные карбоновых кислот, которые можно рассматривать как результат замещения гидроксильной группы карбоновой кислоты на алкоксирадикал Методы получения сложных эфиров:
Методы синтеза лактонов (циклических сложных эфиров)
Физические свойства и строение сложных эфиров Сложные эфиры являются бесцветными жидкостями или кристаллическими веществами с приятным запахом. Температура кипения сложных эфиров обычно ниже чем температура близких по молекулярной массе карбоновых кислот. Это свидетельствует об уменьшении межмолекулярных взаимодействий, что объясняется отсутствием межмолекулярных водородных связей. Полярность связей в молекуле сложного эфира подобна полярности связи в карбоновых кислотах. Основное отличие от карбоновых кислот – отсутствие подвижного протона, вместо него находится углеводородный остаток. Электрофильный центр находится на карбонильном и алкильном углеродном атоме. В то же время карбонильный кислород обладает основностью. Объектами нуклеофильной атаки могут быть ацильный или алкильный углерод. В то же время кислотность водородных атомов при a -углеродном атоме радикала кислоты обусловливает склонность сложность эфиров к реакции конденсации. Реакции нуклеофильного замещения Различают кислотнокаталитический гидролиз и основной гидролиз (омыление). Кислотный гидролиз представляет собой обратимую реакцию. Механизм этой реакции – см в разделе Кислотно-каталитическая этерификация – Химические свойства карбоновых кислот. Реакция омыления необратима. Основание не только ускоряет реакцию гидролиза, но выступает в качестве реагента. Эффективность реакции обусловлена высокой нуклеофильной активностью гидроксил-анионов. RCOOR’ + NaOH ® RCOONa + R’OH Реакция катализируется кислотами или основаниями.
а) Реакция с магнийорганическими соединениями подобна реакции с галогенангидридами. б) Взаимодействие с Li-органическими соединениями. Конденсация Кляйзена – наиболее важная в синтетическом отношении реакция. Ее стехиометрический результат заключается в автоконденсации этилацетата, катализируемая этилатом натрия. Условия равновесия неблагоприятны для всех трех стадий. Поэтому равновесие брутто-реакций существенно смещено в левую сторону. Факторами смещения равновесия могут быть: отгонка этилового спирта, применение избытка этилата натрия. Последний метод оказывается эффективным, так как этанол более слабая кислота, чем енол сложного эфира, и избыток этилата смещает равновесие нацело вправо вследствие превращения b -кетоэфира в соль енола. Очевидно, что продукт конденсации необходимо получить из соли енола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается «замораживание» реакционной смеси для чего ее вливают в избыток холодной кислоты. Для протекания конденсации Кляйзена необходимы следующие структурные предпосылки: исходный эфир должен иметь водородный атом при a -углеродном атоме, чтобы могли осуществиться реакции, представленные в механизме (реакции (1)-(3)) и два водородных атома при a -углероде, для того чтобы оказалось возможным смещение равновесия реакции в сторону продукта за счет образования енолят-аниона ацетоуксусного эфира. Очевидно, что этилизобутират не вступает в присутствии этилата натрия в реакцию автоконденсации, поскольку в продукте конденсация отсутствует a -водородные атомы. Конденсация Кляйзена может быть проведена между двумя сложными эфирами, но поскольку при этом возможно образование четырех различных продуктов, в результате реакции часто получают сложные смеси. Этого удается избежать, если один из сложных эфиров не содержит a -водородных атомов и легко реагируется с карбанионом. Реакции в этом случае напоминают перекрестную альдольную конденсацию. К числу применимых для этой цели сложных эфиров, не содержащих a -водородные атомы и обладающих высокой реакционной способностью относятся эфиры бензойной, муравьиной, щавелевой и угольной кислот. 📹 ВидеоЛабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  3.3. Алкины: Химические свойстваСкачать  Крещенская вода - ученые раскрыли тайну ! Научные факты которые взрывают представления о водеСкачать  Практическая работа.Получение и свойства уксусной кислоты.Скачать  Химия с нуля — Химические свойства АлкеновСкачать  Химия, 12-й класс, Практическая работа № 1 Химические свойства уксусной кислотыСкачать  5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать  Агрессия в древности | Станислав ДробышевскийСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Ангидриды кислот это?Скачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать  Вот ранние очевидные ПРИЗНАКИ что... Печень признаки болезниСкачать  Как Яблочный уксус влияет на поджелудочную железу: безопасное применениеСкачать  4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать  Химические свойства алканов. 1 часть. 10 класс.Скачать  |