При ознакомлении учащихся с галогенопроизводными углеводородов следует показать малую подвижность атомов галогена, соединенных с углеводородным радикалом, и в связи с этим особенности открытия галогенов в органических веществах.
Взаимодействие галогенопроизводных с нитратом серебра. Учащиеся знают, что при действии раствора нитрата серебра на растворы галогеноводородных кислот и их солей моментально образуется осадок галогенида серебра. Связь атомов галогена с углеводородными радикалами является ковалентной, поэтому подобная реакция здесь если и происходит, то значительно медленнее.
Чтобы раствор нитрата серебра мог хорошо смешиваться с органическими веществами, в опытах пользуются спиртовым, а не водным раствором его. Чтобы галогенопроизводные углеводородов не содержали примеси галогеноводородных кислот (это может исказить результаты опыта), их предварительно очищают. Для этого вещество взбалтывают в делительной воронке с водным раствором
соды, отделяют нижний слой и еще раз промывают его таким же способом водой.
Необходимые для опытов органические вещества, при отсутствии их в лаборатории, могут быть синтезированы учащимися в химическом кружке.
· В пробирку к спиртовому раствору бромэтана С2Н5Вг приливают спиртовой раствор нитрата серебра (слабой концентрации). Осадок не образуется. Приливают спиртовой раствор нитрата серебра к раствору бромида натрия или бромида калия — моментально образуется желтоватый творожистый осадок AgBr. Через некоторое время бромид серебра начинает появляться и в пробирке с бромэтаном (черный фон!). Реакцию можно ускорить нагреванием.
· В четыре пробирки со спиртовыми растворами хлороформа СНСI3, бромэтана С2Н5Вг, иодэтана С2Н5I и хлорида натрия NaCI приливают спиртовой раствор нитрата серебра. В последней пробирке тотчас образуется осадок, вслед за тем осадок появляется в пробирке с иодэтаном, через некоторое время осадок начинает появляться в пробирке с бромэтаном, в пробирке с хлороформом осадок не образуется.
Вытеснение галогенами друг друга из соединений. В цилиндр с хлором наливают немного иодэтана и быстро закрывают цилиндр пробкой. Наблюдают появление фиолетовых паров иода:
Термическое разложение йодоформа. Сравнительно слабой связью атомов иода с углеродом объясняется дезинфицирующее действие йодоформа СНI3. Отщепляющиеся атомы иода в силу своих окислительных свойств разрушают болезнетворные бактерии. Разложение йодоформа можно ускорить нагреванием.
На шпателе или листочке бумаги нагревают высоко над пламенем небольшое количество йодоформа. На белом фоне наблюдают образование паров иода.
Открытие галогенов в органических веществах Из предыдущих опытов следует, что нитрат серебра не может непосредственно применяться для открытия галогенов в органических веществах. Для этой цели здесь существуют следующие способы:
1. Органическое вещество растворяют в спирте и на спирт действуют натрием. Образующийся при реакции спирта с натрием водород вытесняет галоген из органического вещества подобно тому, как галоген замещает водород в молекуле углеводорода.
На примере хлороформа эти реакции можно представить в следующем виде:
Образующийся хлористый водород уже нетрудно открыть с помощью нитрата серебра.
В пробирку наливают 3-4 мл этилового спирта, прибавляют 0,5 мл хлороформа и бросают 2—3 маленьких кусочка свежеочищенного натрия. Большая часть водорода при этом выделяется в виде газа, его можно поджечь после того, как из пробирки будет вытеснен воздух. Когда весь натрий прореагирует, раствор подкисляют азотной кислотой и прибавляют раствор нитрата серебра. Сразу образуется характерный осадок хлорида серебра.
2. Если в веществе содержится галоген, то можно получить его соединение с медью; образующаяся соль летуча и окрашивает пламя в характерный зеленый цвет (проба Бейльштейна).
Медную проволоку скручивают на конце в спираль и прокаливают по возможности в бесцветном пламени до тех пор, пока пламя от спирали не будет окрашиваться. После этого спираль вносят в испытуемое вещество, например в хлороформ, и затем снова помещают в пламя. Появляющееся зеленое окрашивание свидетельствует о наличии галоидных солей меди и, следовательно, о наличии того или иного галогена в испытуемом веществе
Видео:Реакции разложения. Как понять?Скачать

Опыт 6. Получение и свойства йодоформа
Реактивы: этиловый спирт, йод, 10-процентный раствор гидроксида натрия, 1-процентный раствор нитрата серебра; 5-процентный раствор аммиака,1-процентный раствор перманганата калия, 20-процентный раствор азотной кислоты.
Оборудование: химические воронки, предметные и покровные стекла, микроскоп, водяные бани.
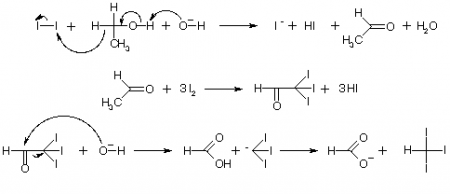
При встряхивании растворяют в пробирке 0,5 г йода в 1 мл спирта. К спиртовому раствору йода добавляют 5 мл воды (йод при этом выпадает в осадок), затем при встряхивании по каплям приливают 10-процентный раствор гидроксида натрия до тех пор, пока не исчезнет бурый цвет йода и реакционная смесь приобретает светло-желтую окраску. Избыток щелочи недопустим, так как щелочь гидролизует йодоформ. Для ускорения реакции пробирку осторожно подогревают на водяной бане (температура воды в бане 70-80 0 С). При охлаждении выпадает обильный осадок йодоформа в виде светло-желтых кристаллов со специфическим запахом. Осадок йодоформа отфильтровывают, отжимают в фильтровальной бумаге и очищают перекристаллизацией из этилового спирта или ацетона. Для этого кристаллы переносят в пробирку, наливают около 1 мл органического растворителя (спирта или ацетона) и нагревают пробирку в водяной бане до полного растворения осадка. После охлаждения на воздухе выпавшие кристаллы йодоформа отфильтровывают и промывают небольшим количеством дистиллированной воды. Каплю водной взвеси кристаллов йодоформа переносят на предметное стекло и рассматривают кристаллы под микроскопом. Они имеют форму правильных шестиугольников или шестиконечных звездочек. Реакция получения йодоформа описанным способом очень чувствительна, она дает возможность обнаруживать даже следы этилового спирта в водном растворе. Йод реагирует с гидроксидом натрия с образованием NaIO3, который окисляет этанол до уксусного альдегида. Затем происходит замещение атомов водорода в СН3-группе уксусного альдегида на йод при действии избытка NaIO3 и расщепление образующегося йодаля (трииодуксусного альдегида) щелочью.
Напишите уравнение реакции получения йодоформа из этилового спирта, йода и щелочи (по проведенной выше схеме).
Проведите гидролиз полученного йодоформа 10-процентным раствором гидроксида натрия и качественные реакции с гидролизатом, описанные в опыте 17, г.
Напишите уравнения реакций гидролиза йодоформе щелочью, обнаружения иодид-иона (нитратом серебра), определения в гидролизате формиата натрия (реакция серебряного зеркала, окисление перманганатом калия). Какой из галоформов (хлороформ, бромоформ, йодоформ) наиболее легко гидролизуется в щелочной среде?
Опыт 7. Термическое разложение поливинилхлорида
Реактивы: 1-процентный раствор нитрата серебра.
Оборудование: поливинилхлоридная смола – винипласт (изоляция осветительного провода ППВ – провод плоский виниловый; ТРВК – телефон, радиовиниловый кабель или другой образец), изогнутые газоотводные трубки, синяя лакмусовая бумага.
Поливинилхлоридные смолы и пластмассы на их основе при нагревании выше 140 0 С разлагаются с выделением хлороводорода.
Напишите схему реакции полимеризации винилхлорида (получение поливинилхлорида).
Помещают кусочек (1-2 см) винипласта в пробирку с изогнутой газоотводной трубкой, конец которой опущен в другую пробирку с 1,5 мл раствора нитрата серебра. Осторожно нагревают пробирку пламенем горелки. Винипласт размягчается, темнеет и разлагается с выделением газообразных продуктов, в том числе хлороводорода. В пробирке с раствором нитрата серебра появляется белый осадок. Напишите уравнение реакции. Хлороводород можно также обнаружить по покраснению влажной синей лакмусовой бумаги, поднесенной к отверстию газоотводной трубки.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Йодоформ
| Йодоформ | |||
|---|---|---|---|
| |||
| Систематическое наименование | Йодоформ | ||
| Хим. формула | CHI3 | ||
| Состояние | жёлтые кристаллы | ||
| Молярная масса | 393.73 г/моль | ||
| Плотность | 4.008 г/см³ | ||
| Температура | |||
| • плавления | 123 °C | ||
| • кипения | 217 °C | ||
| • разложения | 410 ± 1 °F | ||
| Растворимость | |||
| • в воде | 0.1 г/л | ||
| Координационная геометрия | тетрагональная | ||
| Кристаллическая структура | гексагональная | ||
| Рег. номер CAS | [75-47-8] | ||
| PubChem | 6374 | ||
| Рег. номер EINECS | 200-874-5 | ||
| SMILES | |||
| RTECS | PB7000000 | ||
| ChEBI | 37758 | ||
| ChemSpider | 6134 | ||
| ЛД50 |
мг/кг | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
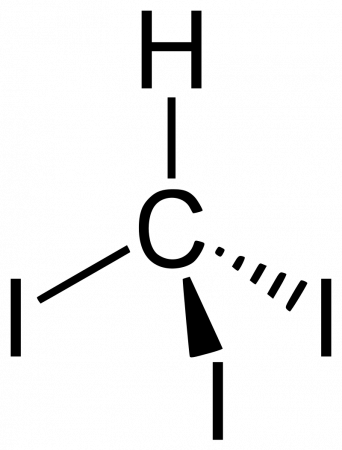
Йодоформ (трийодметан) — органическое соединение с химической формулой CHI3, имеет вид жёлтых кристаллов с сильным характерным запахом.
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Содержание
Видео:Уравнивание реакций горения углеводородовСкачать

Свойства
Жёлтые кристаллы, практически нерастворимые в воде. Трудно растворимы в спирте, хорошо растворяются в эфире, хлороформе.
Видео:Реакции разложенияСкачать

Получение
Йодоформ получают из этанола или ацетона, действием йода и щелочей или карбонатов щелочных металлов:
Реакция протекает по следующей схеме:
Йодоформ также можно получить электролизом йодида калия или натрия в спиртовом растворе. При электролизе образуются йод и щёлочь, необходимые для процесса. Образующийся при реакции йодид калия (натрия) снова подвергается электролизу, и таким образом весь йод соли идёт на образование йодоформа.
Также йодоформ можно получить йодоформной пробой.
📹 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Задание 17: Реакции исключения - разложение дихромата аммония и перманганата калия | Химия ЕГЭСкачать

Классификация химических реакций в неорганической химии + 1 балл | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Как читать анализ кукурузного силосаСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Вулкан: разложение дихромата аммонияСкачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Синтез йодоформа и регенерация иода (synthesis of iodoform) CHI3Скачать

Химия 8 класс: Реакции разложенияСкачать