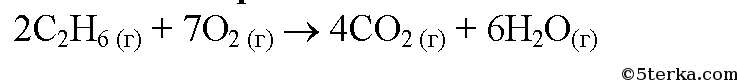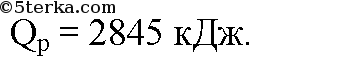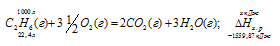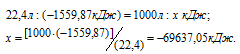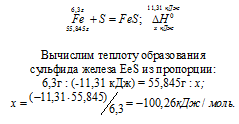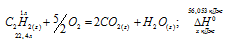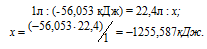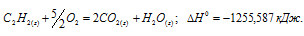задача №5
к главе «Глава 3. Химические реакции. §12. Почему протекают химические реакции».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
- Правильный расчет теплового эффекта реакций и теплот образования веществ
- Тепловой эффект реакции
- Теплота образования вещества
- Термохимическое уравнение сгорания этана имеет вид: 2C2H6+7O2=4CO2+6H2O+2940 Сколько теплоты (в кДж) выделится при полном сгорании 8,96 л (н.у.) этана?
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 🎬 Видео
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Правильный расчет теплового эффекта реакций и теплот образования веществ
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Тепловой эффект реакции
Задание 95.
Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(г); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования бензола равна +33,9 кДж. Ответ: —3135,58 кДж.
Решение:
∆H°С6Н6(парообр.) = +33,9 кДж/моль;
∆H°С6Н6(г) = +82,9 кДж/моль;
∆H°Н2О = -241,98 кДж/моль;
∆H°СО2 = -393,51 кДж/моль;
(С6Н6(ж) → (С6Н6(г); ∆H = +33,9 кДж;
ΔН = ?
Зная мольную теплоту парообразования и мольную теплоту образования газообразного бензола, рассчитаем мольную теплоту образования жидкого бензола из соотношения:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Ответ: ΔН = -3136 кДж.
Задание 96.
Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м 3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
Решение:
Уравнение реакции горения этана имеет вид:
С2Н6 (г) + 31/2O2 = 2СО2(г) + 3Н2О (ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Рассчитаем теплоту, выделяющуюся при сжигании 1м 3 этана из пропорции:
Ответ: . Q = 69637,05 кДж.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Теплота образования вещества
Задание 97.
Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Ответ: —46,19 кДж/моль.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном дав-лении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Отсюда вычислим теплоту образования NH3:
4 


4 
4

Ответ: –46,19 кДж/моль.
Задание 98.
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS. Ответ: —100,26 кДж/моль.
Решение:
Уравнение реакции имеет вид:
Ответ: —100,26 кДж/моль.
Задание 99.
При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н2(г). Ответ. 226,75 кДж/моль.
Решение:
Уравнение реакции горения ацетилена имеет вид:
Рассчитаем теплоту, выделяющуюся при сжигании 1моль ацетилена из пропорции:
Термохимическое уравнение реакции горения ацетилена будет иметь вид:
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:




Ответ: 226,75 кДж/моль.
Задание 100.
При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Решение:
Так как молярная масса эквивалента гидроксида кальция равна 1/2M(Са(ОН)2), то при по-лучении 1моль его выделится 65,06 кДж теплоты (2 . 32,53 = 65,06).
Термохимическое уравнение получения гидроксида кальция из СаО(к) и Н2О(ж) будет иметь вид:
СаО(к) + Н2О(ж) = Са(ОН)2(к); 
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:





Видео:Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Термохимическое уравнение сгорания этана имеет вид: 2C2H6+7O2=4CO2+6H2O+2940 Сколько теплоты (в кДж) выделится при полном сгорании 8,96 л (н.у.) этана?
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Ваш ответ
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

решение вопроса
Видео:Тепловой эффект реакции. ЗадачиСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
🎬 Видео
78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

2 2 Закон Гесса, тепловой эффект реакцииСкачать
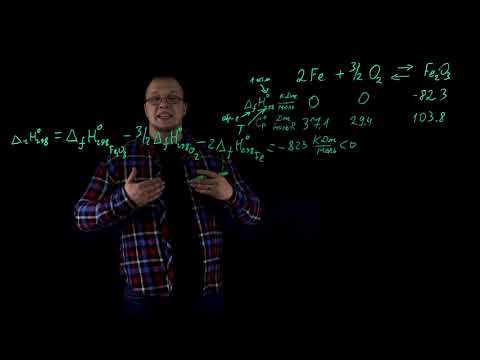
Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тепловой эффект химической реакции | ХимияСкачать

Расчёт тепловых эффектов реакций по табличным даннымСкачать
Решение задач по термохимическим уравнениям реакций, 8 классСкачать
Типы химических реакций. Тепловой эффект химической реакции | Химия ЕГЭ, ЦТСкачать

Химия | Задачи на термохимиюСкачать

ЕГЭ по химии: 27 задание. Тепловой эффект | НШ ХимияСкачать

Тепловой эффект реакции/ Страницы 115 - 118/ № 1 - 50/Сборник тестов по химии 2021/Скачать

ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Химия. 10 класс. Тепловой эффект химической реакции и его значение /04.12.2020/Скачать