Стадия массопереноса присуща любым гетерогенным реакциям, но в электрохимических процессах происходит еще и переход заряженных частиц через границу раздела. Если эта стадия является лимитирующей, то соответствующее этому процессу перенапряжение называется перенапряжением перехода (перенапряжение разряда — ионизации). В этом случае замедленной является собственно электрохимическая стадия.
Долгое время считалось, что скорость переноса заряда (электрона) не может быть замедленной, поскольку ее скорость всегда существенно выше, чем скорость любой другой стадии всего процесса. Только в 1930г. М.Фольмер (Германия) и Т.Эрдей — Груз (Венгрия) сформулировали теорию замедленного разряда, позволяющую объяснить такую возможность. В 1933г. эта теория была усовершенствована А.Н.Фрумкиным, который учёл влияние электрического поля двойного слоя на перенос заряженных частиц.
Рассмотрим электрохимическую реакцию восстановления:
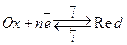
Общий ток (плотность тока, скорость реакции) будет определяться уравнением (11.1)

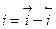
При равновесном потенциале 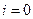
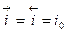
Этот ток (плотность тока) 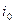
При лимитирующей стадии разряда – ионизации (реакция 11.а) нарушается само электродное равновесие и уравнение Нернста, которое справедливо для равновесных процессов, не может быть использовано для расчёта электродных потенциалов.
М.Фольмер и Т.Эрдей – Груз показали, что в этом случае величина плотности тока (скорости реакции) определяется следующим соотношением:
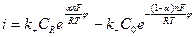
где 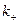
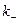
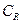
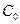
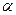
Для обычных реакций 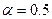
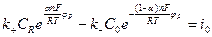
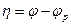

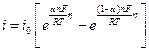
Из уравнения (11.6) следует, что скорость электрохимической реакции прямо пропорциональна плотности тока обмена и разнице двух экспоненциальных членов, содержащих перенапряжение. То есть, скорость электрохимической реакции определяется: плотностью тока обмена, перенапряжением и коэффициентом переноса. Соотношение (11.6) справедливо, если 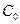
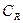
Дата добавления: 2017-01-29 ; просмотров: 1142 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Лекция 136 Введение в теорию замедленного разрядаСкачать

Теория замедленного разряда уравнение тафеля
Лекция 41. Закономерности электрохимической кинетики в условиях замедленной стадии разряда-ионизации.
Теория, описывающая кинетические закономерности переноса частиц через границу раздела фаз, называется теорией замедленного разряда. Пусть скорость электродного процесса Ох+nē↔Red лимитируется стадией разряда-ионизации. В этих условиях суммарная скорость процесса, определяемая плотностью тока i : 

Если Е 

Сдвиг потенциала от равновесного значения, обусловленный замедленным протеканием стадии разряда-ионизации называется перенапряжением.
Положительному катодному току соответствует «+» перенапряжение. При лимитирующей стадии разряда-ионизации нарушается электродное равновесие и уравнение Нернста не может быть использовано для расчета Е.
Основные уравнения теории замедленного разряда.
Кинетические уравнения для прямого и обратного электрохимических процессов на основе теории абсолютных скоростей реакций в первом приближении записаны в виде: 
К – константа скорости.
ΔG * – стандартная свободная энергия активации образования активированного комплекса катодного и анодного процессов.
Сi адс – концентрация реагентов в адсорбированном состоянии, то есть в плотной части дв. слоя или на границе между плотным и диффузным слоем.
Если потенциал в месте нахождения реагирующей частицы обозначить ψ1 *
gi – стандартная свободная энергия специфически адсорбированного компонента i.
ziFψ 1 * — электростатическая энергия адсорбции компонента.
Для расчета энергии активации рассматривается энергетическая диаграмма реакции:
Под путем реакции понимают те параметры, которые меняются в ходе электродного процесса. При таком рассмотрении 

Из теории реорганизации растворителя следует, что изменение Е активации прямого процесса составляет долю α от изменения разницы энергетических уровней.

0 ≤ α ≤ 1 – коэффициент переноса.
Соотношение было установлено для объемных химических реакций по переносу протона от кислоты ВН + к основанию D : ВН + + D → В + D Н + .
Теория замедленного разряда в начальной стадии развития основывалась на закономерностях восстановления иона гидроксония:
Если в качестве основания рассматривается металлический электрод, а ион гидроксония как кислоту, то реакция оказывается аналогичной предыдущей. На этом основании Фрумкин ввел соотношение Бренстеда в теории замедленного разряда. С учетом этого:


Множитель (1) показывает, что скорость стадии разряда тем выше, чем больше энергия специфической адсорбции реагентов. Этот множитель можно объединить с абсолютной константой скорости К S 0 :
К S зависит природы Ме.
Множитель (2) отражает влияние дв. слоя на скорость стадии разряда и его так же объединяют с константой К S :

С учетом данных соотношений плотности катодного и анодного токов записываются в виде:


К S (измер) одна и та же, если потенциал Е измерен относительно потенциала Е 0 рассмотренной реакции.
Так как ток обмена 

η = Еp – Е – перенапряжение
Так как 


(1) и (2) – основные уравнения теории замедленного разряда.
Частные случаи использования уравнений теории замедленного разряда.
В предположении, что α и ψ 1 * не зависят от η можно рассмотреть частные случаи для измеряемой плотности тока.
1) при | η | RT / nF =25 мВ

При малых перенапряжениях поляризационная характеристика стадии разряда-ионизации линейна: η = θi, θ = RT / nFi 0 – сопротивление разряда (анолог закона Ома).
2) при η >> RT / nF , i ≈ i 0 exp ( αnF η/RT) или lni ≈ ln i 0 + αnF η/RT, отсюда η = (- RT / αnF )ln i 0 + ( RT / αnF ) lni .
Если (- RT / αnF )ln i 0 = а, (2,3 RT / αnF ) = b , то η = а + blgi – уравнение Тафеля (уравнение прямой в координатах η от lgi ).
По наклону тафелевой прямой можно найти коэффициент переноса α , а затем вычислить ток обмена. В случае больших отрицательных перенапряжений -η >> RT / nF уравнение Тафеля изменится:
η = (- RT /(1- α ) nF )ln i 0 + ( RT /(1- α ) nF ) ln | i |
Видео:Лекция 147 Основные уравнения теории замедленного разрядаСкачать

Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения
Перенапряжение выделения водорода. Уравнение Тафеля. Теории водородного перенапряжения.
Электролиз может начаться после того, как приложенная извне разность потенциалов достигает величины, равной (вернее, очень незначительно превышающей) разности обратимых потенциалов электродов электрохимической ячейки (потенциалы разряда ионов). Однако во многих случаях для того, чтобы электролиз начался, необходимо приложить к электролитической ванне разность потенциалов, на конечную величину большую, чем разность равновесных потенциалов электродов, образующихся при электролизе. Эта минимальная величина приложенной извне разности потенциалов называется напряжением разложения. То избыточное напряжение, которое необходимо приложить к ванне сверх ее равновесной ЭДС, чтобы начался электролиз, включает в себя, во-первых, перенапряжение на электродах (на катоде и на аноде), а во-вторых, омическое падение напряжения в растворе, соответствующее электросопротивлению этого раствора.
Величина перенапряжения на электроде зависит от природы электрода, плотности тока, состава раствора и др. факторов. Величина перенапряжения различна для разных электрохимических процессов.
В связи с большим практическим значением реакции выделения водорода для ряда технических процессов (электролиз воды, хлорный электролиз, эксплуатация аккумуляторов и гальванических элементов, коррозия) эта электрохимическая реакция изучена наиболее детально.
ЗАКОНОМЕРНОСТИ ПЕРЕНАПРЯЖЕНИЯ ВЫДЕЛЕНИЯ ВОДОРОДА.
1. Влияние плотности тока
Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, т.е. со скоростью электрохимического процесса :
Видео:Лекция 149 Второй частный случай теории замедленного разряда Уравнение ТафеляСкачать

Рекомендуемые файлы
h – перенапряжение, В; a и b – константы; i – плотность тока, А/см 2 .
Смысл величины а : а дает значение перенапряжения при i = 1 А/см 2 . Величина а существенно зависит от материала электрода.
Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 2×2,303RT/zF , т.е. 0,116 В при z = 1 и комнатной температуре. Это значит, что при увеличении плотности тока в 10 раз h увеличивается на 0,116 В. Однако величина b в ряде случаев может составлять и 0,030 В.
Формула Тафеля соответствует опыту в очень широком интервале величин i; при очень малых i она, естественно, неприменима. В области малых отклонений от равновесного потенциала наблюдается линейная связь между h и i :
2. Влияние природы металла
В зависимости от величины перенапряжения водорода (величины а) металлы можно разбить на 3 группы :
1. Металлы с высоким значением перенапряжения выделения водорода (в кислотах а = 1,2 – 1,55 В) : Pb, Tl, Hg, Cd, Zn, Sn.
2. Металлы со средним значением перенапряжения водорода ( а = 0,5 – 0,8 В) : Cu, Ag, Fe, Co, Ni.
3. Металлы с низким перенапряжением водорода ( а = 0,1 – 0,3 В) : Pt, Pd.
Помимо материала электрода, на величину а влияет состояние его поверхности. Константа а уменьшается при развитии поверхности и при освобождении ее от поверхностных окислов.
Величина b меняется в более узких пределах – от 0,03 до 0,12 В, и только в редких случаях (для технических и окисленных металлов) она больше 0,12. Низкие значения b наблюдаются для металлов с низким перенапряжением (Pt, Pd); для многих металлов, в том числе для всех металлов с высоким перенапряжением b составляет около 0,12 В.
Измерения, проведенные с монокристаллами различных металлов, показали, что h в значительной степени зависит от символа грани монокристалла, на которой катодно выделяется водород. Поэтому величины h, найденные для твердых катодов с поликристаллической структурой, представляют собой некоторые усредненные значения.
Было предпринято много попыток установить связь между перенапряжением водорода на данном металле и каким-либо другим его физическим свойством : каталитической активностью по отношению к реакции рекомбинации атомов водорода, теплотой плавления металла или теплотой его испарения, работой выхода электрона, минимальным межатомным расстоянием в решетке кристалла, коэффициентом сжимаемости и т.п. Было отмечено, например, что чем выше Т плавления, тем ниже h, однако это наблюдение нельзя рассматривать даже как приближенное правило. Найдено, что чем выше каталитическая активность металла по отношению к реакции рекомбинации атомарного водорода, тем ниже на нем перенапряжение водорода. Была также установлена зависимость, существующая между работой выхода электрона и h, между минимальным расстоянием между атомами в металлах и h.
3. Влияние природы и состава раствора
а) Влияние растворителя. Наибольшее число исследований по перенапряжению водорода выполнено с водными растворами. Для ртути и для некоторых др. металлов были получены данные также и в неводных растворах кислот. Характер изменения h с изменением растворителя точно не установлен. Перенапряжение выделения водорода на ртути из раствора HCl в этиловом и метиловом спиртах ниже, чем из водных растворов; для Cu и Ni в спиртовых растворах оно выше, чем в водных. Для металлов с низким h природа растворителя играет меньшую роль.
б) Влияние рН раствора на перенапряжение водорода с наибольшей полнотой изучено на ртути. Установлено, что в растворах чистых кислот в области концентраций до 0,1н h не является функцией рН; при более высоких концентрациях h зависит от рН, уменьшаясь с увеличением концентрации кислоты, причем Dh/DрН составляет примерно 60 мВ. Если растворы кроме кислоты содержат также избыток постороннего электролита, то подобное изменение h с рН наблюдается и для концентраций кислоты, меньших 0,1н. При избытке постороннего электролита такой ход h с рН наблюдается и для разбавленных растворов щелочей. Т.о., максимальное перенапряжение водорода соответствует нейтральным растворам и линейно уменьшается с отклонением рН в ту или иную сторону от точки нейтральности. В концентрированных растворах кислот и оснований соотношение между h и составом раствора становится более сложным. Для других металлов : на Ni h изменяется с рН незначительно и не подчиняется простой линейной зависимости; на Pb и Pt оно почти не зависит от рН раствора.
в) h водорода очень чувствительно к присутствию в электролите посторонних веществ. Добавки солей к разбавленным растворам кислот увеличивают h на ртути, причем увеличение концентрации 1-1 зарядного электролита в 10 раз (при постоянном рН) повышает h примерно на 55–58 мВ. Первоначальная добавка электролита с поливалентным катионом оказывает большее действие, чем такая же добавка 1-1 зарядного электролита. Поверхностно-активные вещества (анионы, катионы и молекулярные вещества) или повышают, или понижают h на ртути, в зависимости от их природы. ПАВ сильнее всего влияют на величину h в области малых плотностей тока; действие этих добавок ослабляется с ростом плотности тока и при высоких ее значениях полностью исчезает. На Pt, Fe и Ni h также возрастает при введении ПАВ; характер влияния ПАВ на h и на этих металлах является функцией потенциала электрода.
4. Влияние температуры и некоторых других факторов
h водорода уменьшается с ростом Т, причем температурный коэффициент зависит от природы металла и плотности тока. Т.к. константа b увеличивается, а константа а уменьшается с ростом Т, то температурный эффект больше выражен в области низких плотностей тока. В среднем (dh/dT)i составляет 1 – 4 мВ/К. Если считать, что полулогарифмическая зависимость сохраняется неизменной до высоких плотностей тока, то, начиная с некоторого значения плотности тока, можно ожидать пересечения полулогарифмических прямых и изменения знака температурного коэффициента перенапряжения.
Зависимость h от давления водорода почти не изучена. Есть данные, что h на ртути и гладкой платине несколько уменьшается при повышении давления.
На h водорода на металлах железной и платиновой групп влияют ультразвуковые колебания. h изменяется под действием светового облучения и потока радиоактивных частиц.
ТЕОРИИ ВОДОРОДНОГО ПЕРЕНАПРЯЖЕНИЯ.
Электрохимические реакции являются сложными процессами с последовательными стадиями, и малая скорость любой из них приводит к нарушению равновесия и появлению перенапряжения. Разряд ионов гидроксония, приводящий к выделению молекулярного водорода, несмотря на простоту суммарного выражения процесса, является сложной электродной реакцией. Рассмотрим стадии этого процесса.
1. Диффузионная стадия. Электрохимический процесс протекает на электроде, поэтому необходима доставка ионов Н3О + к поверхности, что осуществляется за счет переноса ионов и их диффузии. Отметим, что в данном случае эта стадия протекает без существенного торможения.
2. Стадия разряда протона с образованием адсорбированных атомов водорода (собственно электрохимический процесс):
3. Для стационарного протекания электролиза необходимо поддерживать постоянной поверхностную концентрацию атомов водорода, т.е. обеспечивать их непрерывный отвод с поверхности катода. Атомы водорода могут удаляться тремя путями : каталитической рекомбинацией, электрохимической десорбцией и эмиссией. При каталитическом механизме отвод атомов водорода происходит за счет их рекомбинации в молекулы с одновременной десорбцией :
При электрохимической десорбции удаление атомов водорода с поверхности электрода происходит в результате разряда ионов гидроксония на уже адсорбированных атомах :
При эмиссионном механизме адсорбированные атомы водорода испаряются с поверхности электрода в виде свободных атомов
с их последующей объемной рекомбинацией в атомы водорода.
4. Молекулярный водород, образующийся из адсорбированного атомарного водорода, должен удаляться от границы раздела электрод–электролит в газовую фазу (в виде пузырьков газа).
Теории водородного перенапряжения различаются между собой по тому, какая из указанных стадий считается наиболее медленной и, следовательно, лимитирующей скорость общего электрохимического процесса. Некоторые из этих теорий представляют лишь исторический интерес; остановимся на тех, которые сохранили свое значение до настоящего времени.
Критерием правильности той или другой теории являются опытные факты, поэтому справедливость той или иной теории перенапряжения определяется возможностью с помощью этой теории объяснить формулу Тафеля. Однако все основные теории приводят при известных предположениях к формуле Тафеля.
Теория замедленной рекомбинации
Теория выдвинута Тафелем еще в 1905 г. Согласно этой теории наиболее медленной является стадия молизации адсорбированного водорода, поэтому в процессе электролиза концентрация атомарного водорода на поверхности увеличивается по сравнению с равновесной, что и приводит к сдвигу потенциала электрода в отрицательную сторону.
Скорость рекомбинации атомов водорода в молекулы пропорциональна квадрату поверхностной концентрации адсорбированного водорода :

С другой стороны, скорость электрохимического выделения водорода равна :

(Т.к. сила тока I, т.е. количество протекшего в единицу времени электричества, равна произведению числа молей водорода, выделившихся в единицу времени, на zF = 2F:

Если стадия рекомбинации является лимитирующей, то



h = j – jR = 


где [HR] – поверхностная концентрация атомарного водорода на электроде при равновесии этого водорода с молекулярным водородом в газовой фазе.
Подставим в последнее уравнение вместо [H] его значение :
h = 
Т.к. k и HR – постоянные величины, уравнение легко привести к виду
h = а + 
Как видно, уравнение правильно отражает найденную на опыте полулогарифмическую зависимость перенапряжения от силы тока (формула Тафеля). Однако величина b оказывается на основании изложенного вывода равной 0,029 В, а не 0,116, т.е. в 4 раза меньше опытной величины, что являлось серьезным недостатком теории Тафеля.
В дальнейшем эта теория была развита рядом ученых. Кобозев связал замедление молизации водорода с энергией адсорбции водорода металлом. При выводе своего уравнения Тафель не учитывал неоднородности поверхности и наличия отталкивательных сил между адсорбированными атомами. Если это сделать, то значение коэффициента b увеличивается и при некоторых предположениях может достигать 0,116 В. Т.о., основной недостаток теории – малое значение b – может быть устранен.
В рекомбинационной теории впервые было объяснено влияние материала электрода на величину перенапряжения водорода.
Теория замедленного разряда
Согласно этой теории наиболее медленной стадией сложного электрохимического процесса является процесс разряда ионов. Эта теория привлекла должное внимание лишь после работ Эрдей-Груза и Фольмера (1930), предположивших, что разряд ионов требует значительной энергии активации и поэтому может происходить с малой скоростью. Фольмеру удалось вывести уравнение Тафеля. Рассмотрим этот вывод.
Применим к электрическому процессу обычное уравнение для скорости химического процесса :
где Е – энергия активации процесса.
Т.к. скорость электрохимического процесса определяется силой тока
It = zFn ; IDt = zFDn ; v = 
то для силы тока можно написать :
Для раствора постоянного состава получим :
Роль перенапряжения сводится к снижению энергии активации, и величина этого снижения пропорциональна перенапряжению. Положим его равным aFh (a – коэффициент пропорциональности), тогда
где Ео – энергия активации неполяризованного электрода.
Т.о., при наличии перенапряжения
I = k 

ln I = ln k1 +
Решив уравнение относительно h, получим :
h = 

От силы тока I переходим к плотности тока, подставив I = is. Полагая s постоянной, переходя к десятичным логарифмам и обозначая сумму постоянных при данной температуре слагаемых через а, получим формулу Тафеля :
h = а + 

Если a = 0,5, то b = 0,058/а = 0,116. Достоинством теории медленного разряда является то, что она приводит к правильной величине коэффициента b.
Теория медленного разряда в том виде, в каком она была изложена Фольмером, не учитывала строения границы раздела электрод–раствор, потому не могла объяснить влияния состава электролита на величину h. Влияние строения ДЭС на кинетику электрохимических реакций впервые было принято во внимание А.Н.Фрумкиным. Это позволило объяснить большое количество экспериментальных данных о влиянии состава раствора на величину h, а также на кинетику др. электродных процессов, в частности на кинетику реакций электровосстановления анионов.
Ни рекомбинационная теория водородного перенапряжения, ни теория замедленного разряда не являются всеобщей. К металлам с большим перенапряжением (малой энергией адсорбции водорода) – Hg, Pb – применима теория замедленного разряда, которая объясняет большинство явлений, связанных с изменением h. К металлам с малым перенапряжением (большой энергией адсорбции водорода) – Pt – наиболее применима теория рекомбинации.
Возникновение перенапряжения – общее явление для электрохимических процессов. Значительные перенапряжения возникают при электролитическом выделении не только водорода, но и других газов, а также некоторых металлов.
Перенапряжение является проблемой, имеющей не только теоретическое, но и важнейшее практическое значение. Наличие h приводит к тому, что при промышленном электролизе непроизводительно затрачиваются значительные количества электрической энергии. Следовательно, снижение h на электроде – одна из важнейших задач прикладной электрохимии. Решить эту задачу невозможно без установления истинного механизма электрохимического процесса, без установления его лимитирующей стадии. Поэтому задача электрохимической кинетики заключается в нахождении способов увеличения скорости наиболее медленной стадии.
🎬 Видео
Лекция 156 Двухимпульсный гальваностатический методСкачать

Lecture 44 Melts conductivityСкачать

Лекция 144 Применение соотношения Бренстеда для электрохимических процессовСкачать

Лекция 173 Рекомбинационная теория ТафеляСкачать

Лекция 15 Закон ТафеляСкачать

Лекция 152 Изучение стадии разряда ионизацииСкачать

Предельные вероятности состоянийСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Лекция 153 Релаксационные методыСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Урок 132. Основные понятия гидродинамики. Уравнение непрерывностиСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать











